Книга_Физические методы
3. Термический анализ
Термический анализ представляет собой метод исследования физико-химических и химических превращений, происходящих в веществе при программированном изменении температуры как при нагревании, так и при охлаждении.
Родоначальник термического анализа французский физик и химик (фр. Henri Louis Le Chatelier, годы жизни 8 октября 1850 — 17 сентября 1936).

С помощью этого метода обнаруживают тепловую природу, эндо- или экзотермический характер и температурный интервал превращения
В процессе нагревания или охлаждения вещества, регистрируются не только его тепловые свойства, но и изменения массы, объема, состава и количества выделяющихся газов, электропроводности, магнитной восприимчивости и т.д. термические методы делятся:
Классификация термических методов анализа
|
Название |
Принцип метода |
|
Дифференциальный термический анализ(ДТА) |
Основан на регистрации тепловых эффектов,сопровождающих физические превращения и химические реакции, происходящие под воздействием высоких температур. |
|
Термогравиметрия (ТГ) |
Основан на получении и изучении закономерностей изменения веса вещества при нагревании. |
|
Термодилатометрия |
Позволяет определять изменение длины и объема образца в зависимости от температуры. |
|
Термомагнитометрия |
Изучение магнитных свойств минералов в зависимости от температуры
|
|
Термоволюметрия |
Позволяет регистрировать объем выделяющегося из образца газов при повышении температуры. |
Результатом термического анализа являются термические кривые - термограммы (кривые нагревания), которые зависят главным образом от химического состава и структуры исследуемого вещества.
С помощью термогравиметрии исследуют:
- Термодеструкцию материалов
- Содержание примесей
- Содержание растворителей и воды
- Сложные многокомпонентные смеси
- Термостойкость и др.
Калориметрия (от лат. calor — тепло и лат. metro — измеряю) — совокупность методов измерения количества теплоты, выделяющейся или поглощаемой при протекании различных физических или химических процессов. Основателем калориметрии можно считать шотландского химика и физика (англ. Joseph Black, годы жизни 16 апреля 1728 — 6 декабря 1799).(материал из Wikipedia® )
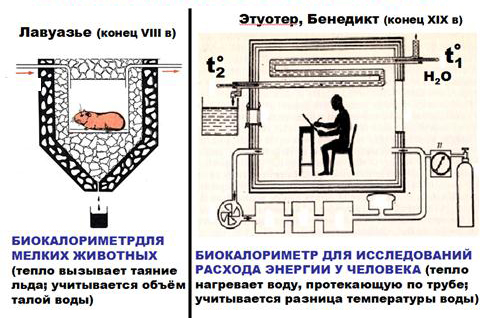
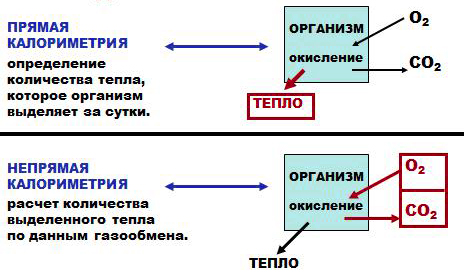
Прямая калориметрия – непосредственный учет количества тепла, выделяемого организмом в биокалориметрах (камерах Лавуазье- Лапласа и Этуотера-Бенедикта), грубо говоря определение количества тепла, которое организм выделяет за сутки.
Непрямая калориметрия – определение теплообразования в организме по его газообмену – учет количества потребляемого кислорода и выделяемого углекислого газа с последующим расчетом основного обмена организма (способ Дуглас-Холдена, оксиспирография).
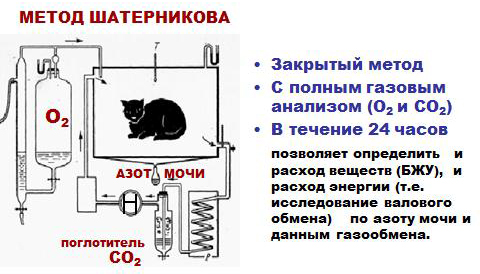

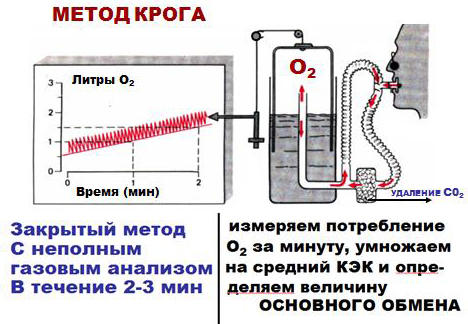
ДЫХАТЕЛЬНЫЙ КОЭФФИЦИЕНТ - Отношение
количества выделенного углекислого газа к количеству поглощенного кислорода.
ДК=СО2/О2
ДК зависит от характера пищи
ДКдля белков =0,8
ДК для углеводов =1,0
ДК для жиров =0,7
ДК при смешанной пище =0,85
С помощью дифференциальной сканирующей калориметрии (ДСК)
можно измерить характеристические температуры и выделяемое или поглощаемое
тепло физических процессов или химических реакций, происходящих в образцах
твердых тел и жидкостей при их контролируемом нагреве или охлаждении. ДСК
является наиболее часто используемым методом в термическом анализе.

Области применения:
Химическая и фармацевтическая промышленность, научные исследования
- Процессы с участием химически активных газов, таких как O2, H2 и CO2, а также горючих и токсичных газов
- Безопасные исследования под давлением
- Подавление процессов испарения (за счет повышения температуры кипения)
- Разделение химических реакций и процессов испарения, которые протекают одновременно при нормальном давлении
- Исследование реакций с участием летучих компонентов
- Исследование каталитических реакций
- Исследование гетерогенных реакций
- Исследование процессов адсорбции и десорбции
- Измерение зависимости давления от температуры кипения
- Определение энтальпии парообразования
Закон теплообмена Ньютона
q = a S (Тср – T),
где a – коэффициент теплообмена, Вт/м2·К,
S – площадь поверхности, через которую осуществляется теплообмен, м2,
Т – температура образца, К,
Тср – температура среды, окружающей образец (температура печи), К.
Тср = Т0 + v t,
где Т0 – начальная температура, К,
v º dТср/dt = const – скорость нагрева (охлаждения), К/с
Тепловой поток, передаваемый образцу при нагреве в процессе термического анализа
q = mCv [1– exp (– t / t)],
где
t = mC/(aS) – постоянная времени, характеризующая термическую инерцию образца.
Тепловой поток при фазовом превращении
qфп = – DH m (ρ/ρ0) dy/dt,
где DH – удельная теплота (энтальпия) превращения,
y º (V/V0) – объёмная доля новой фазы,
m и V0 – масса и начальный объём образца,
ρ0 и ρ – исходная плотность и плотность новой фазы.
Знак «–» введён для случая выделения тепла при фазовом превращении (как, например, в случае кристаллизации).
Форма кривой охлаждения согласно теории термического анализа
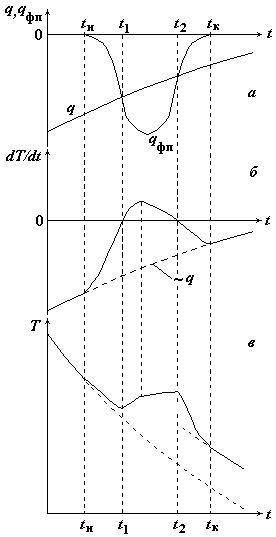
а – зависимости от времени теплового потока, отводимого от образца (q), и скорости выделения тепла в образце из-за фазового превращения (qфп);
б – временная зависимость скорости изменения температуры образца;
в – кривая термического анализа при охлаждении
Методика обработки кривых термического анализа
Интерпретация кривой термического анализа основана на изучении наклона кривой:
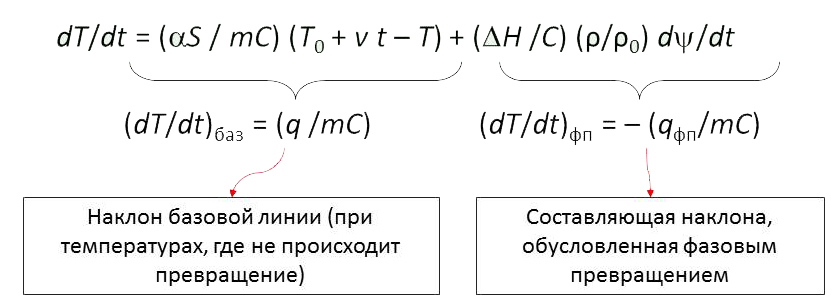
Поиск температур начала и конца превращения проводится путем построения касательных к кривой термического анализа и нахождения точки, где наклон касательных резко изменяется.
Закон охлаждения Ньютона в калориметре
q = αA(Tоб – T)
α – коэффициент теплообмена, Вт/м2·К.
Условия применимости на примере калориметра смешения:
1.Разность температур калориметрической системы и оболочки не должна превышать 2–3 градуса: (Tоб – T) < 2…3 К.
2. Внешняя поверхность калориметра и внутренняя поверхность оболочки должны обладать хорошей отражательной способностью.
3.Расстояние между стенками калориметрического сосуда и оболочки должно составлять около 10 мм; при том конвекция практически исключается, а тепловые потери из-за теплопроводности воздуха невелики.
4. Подъём температуры в опыте не должен превышать 2 К.
В методах смешения нагретый образец вводят в калориметр, температура которого повышается. Количество теплоты, введённое в калориметр:
Q = Cкал·(Tf – T0),
где Cкал – теплоёмкость калориметра (тепловой, или энергетический, эквивалент),
Tf и T0 – конечная и начальная температуры калориметрической системы (калориметрического вещества – не путать с температурой образца!).
Термин "микрокалориметрия'' неразрывно связано с именем Э. Кальве, который существенно усовершенствовал первые калориметры Тиана, основанные на измерении потока энергии, и разработал теорию метода для измерения малых количеств энергии.
Особенности калориметра Кальве
- Предназначен для измерения очень малых количеств
энергии и для исследования очень медленных процессов.
- Тепло отводится от калориметрической ячейки к
оболочке через термопары.
- Для повышения чувствительности измерений
используются термобатареи, состоящие из многих десятков и даже сотен
термопар.
- Измеряемый тепловой поток частично компенсируется
эффектом Пельтье.
Теория метода микрокалориметрии основывается на уравнение Тиана.
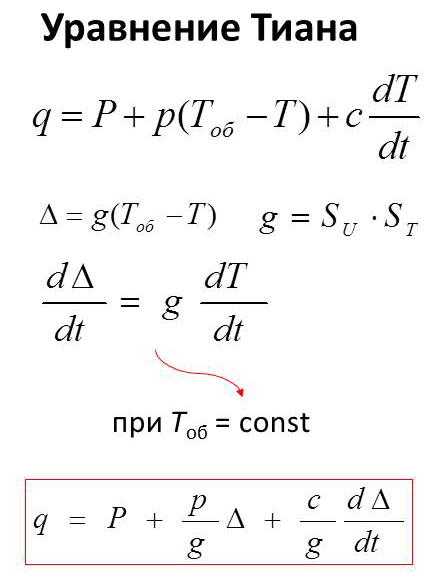
q – тепловой поток в калориметрической ячейке (количество энергии, выделяемое в калориметрической ячейке в единицу времени), Вт;
Р – та часть теплового потока (тепловой мощности), которая скомпенсирована эффектом Пельтье, Вт;
р = αS – количество энергии, теряемое калориметрической ячейкой в единицу времени при разности температур (Тоб – Т), равной 1 оС, Вт/К;
с – теплоёмкость (энергетический эквивалент) калориметрической ячейки, Дж/К,
Δ – отклонение гальванометра,
SU и Sт – чувствительности гальванометра и термобатареи.