Возрастные особенности межклеточного матрикса кожи
7. Стратегии против старения, связанные с коллагеном кожи
Сообщается, что здоровье и красота кожи являются основными факторами, определяющими общее самочувствие и связанное с ним восприятие здоровья потребителями [81]. Различия между кожей с хроническим возрастом (которая обычно бывает тонкой, сухой и мелко морщинистой) и кожей с фотостарением (которая имеет тенденцию быть утолщенной, гиперпигментированной, глубоко морщинистой и демонстрирует грубую профилометрическую топографию) позволяет разработать целевые стратегии вмешательства. Исследование успешного старения, проведенное Фондом Макартура, было провозглашено «новой геронтологией» и отстаивало потенциал здоровой и активной старости [82,83]. Это альтернативный взгляд на более старую парадигму «упадка и утраты», которая рассматривает старение как серию индивидуальных сокращений или потерь, к которым и пожилым людям, и обществу необходимо адаптироваться или приспосабливаться. Обе эти концепции поддерживаются желанием свести к минимуму видимые признаки старения кожи.
Стимуляция выработки коллагена и / или ингибирование деградации коллагена может быть достигнута несколькими способами, включая использование хирургических эстетических процедур, местного лечения или использование пероральных добавок (часто называемых «нутрикосмецевтиками»). В отчете, опубликованном Европейским Союзом, критическая важность питания в активном и здоровом старении четко описана как для макронутриентов, так и для микронутриентов [84]. Связь между питанием и старением кожи также была подробно рассмотрена Шагеном и др. [85]. Из 11 путей / стратегий вмешательства, упомянутых в этом обзоре, 7 напрямую связаны с содержанием коллагена в коже, что подчеркивает важность этого белка для целостности кожи и старения.
Добавки напитков, содержащие гидролизованные биоактивные пептиды коллагена, в сочетании с витаминами, минералами и растительными антиоксидантами, часто используются в нутрикоосмецевтических продуктах для улучшения эластичности кожи, увлажнения и видимых признаков тонких линий и морщин [86–89]. Кроме того, в исследованиях сообщается о преимуществах для роста ногтей и уменьшении симптомов, связанных со сломанными, ломкими или секущимися ногтями [90].
Все белки и пептиды необходимо гидролизовать в кишечнике, чтобы обеспечить всасывание в кровоток и транспортировку по организму [Рисунок 12]. После приема внутрь частично гидролизованные пептиды коллагена в добавках дополнительно перевариваются и гидролизуются в кишечнике [91]. Это осуществляется действием кислой среды в желудке, а также действием определенных ферментов в кишечнике (трипсин, химотрипсин, эластаза, карбоксипептидаза), которые расщепляют пептиды коллагена на фрагменты с меньшей молекулярной массой. Пептиды постепенно расщепляются по мере того, как они попадают в кишечник и через него, с образованием небольших пептидов (обычно ди- и трипептидов) и свободных аминокислот. Было подсчитано, что 90% абсорбированных белков представлено в системе кровообращения в виде аминокислот, из которых только 10% представлены в виде ди- или трипептидов [92,93]. Этот ферментативный процессинг способствует клеточному поглощению, как правило, через белки-переносчики (такие как системы котранспортеров аминокислот или низкоаффинный, мощный пептидный переносчик PEPT1) для доставки питательных веществ из просвета в клетки энтероцитов и через базолатеральную мембрану энтероцит в кровоток.
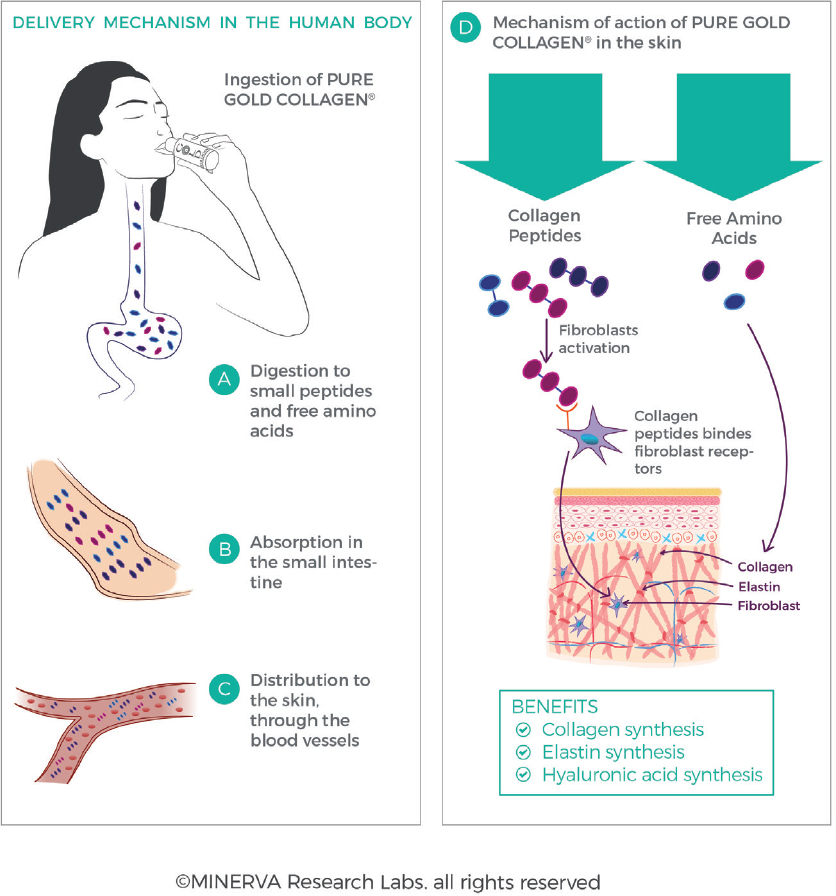
В жидком виде ингредиенты легко всасываются в кровоток (обычно примерно через 20 минут после приема внутрь). Для сравнения, всасывание из твердой пищи может занять несколько часов. Подобно процессу переваривания и всасывания белков, большинство минералов, витаминов и других питательных веществ (например, сахара, липиды) всасываются в кровоток в виде простых соединений [94]. Затем эти ингредиенты из кровотока распределяются по всему телу. Перфузия микроэлементов из петель капилляров в кожу создает обогащенную питательными веществами микросреду, омывающую дерму.
Гидролизованный коллаген выполняет 2 различные, но взаимодополняющие функции. Во-первых, аминокислоты, образующиеся при гидролизе коллагена в желудочно-кишечном тракте, являются строительными блоками, используемыми клеткой фибробластов для производства большего количества коллагена. Поскольку коллаген уникально богат глицином, пролином (и гидроксипролином, который образуется в результате посттрансляционной модификации во время синтеза коллагена), он представляет собой обогащенный запас определенных аминокислот, необходимых для образования новых фибрилл коллагена. Во-вторых, известно, что уникальные олигопептидные последовательности, особенно дипептиды, содержащие гидроксипролин, стимулируют фибробласты через рецептор-опосредованные пути активации, вызывая синтез новых коллагеновых волокон [95]. Хотя эти пептиды присутствуют на более низких уровнях, чем аминокислоты, они могут стимулировать рецепторы фибробластов и, таким образом, являются биологически активными даже при более низких абсолютных концентрациях.
Биологическая эффективность и клиническая эффективность гидролизованного коллагена могут быть связаны как с его уникальным аминокислотным профилем, так и с конкретными олигопептидными последовательностями, что подчеркивает ключевые характеристики, способствующие большому успеху гидролизованного коллагена в качестве добавки, полезной для здоровья организма. Другие белки, например, из казеина, арахиса или тофу, имеют другой аминокислотный состав и имеют меньший относительный вклад определенных аминокислот, необходимых для рибосомного синтеза белка (который использует фермент аминоацил тРНК-синтазу для присоединения соответствующей аминокислоты. через сложноэфирную связь). Соответствующий комплекс тРНК используется для синтеза белка на рибосомах эндоплазматического ретикулума клетки [96,97]. Поскольку коллаген является наиболее распространенным белком ЕСМ, виды тРНК должны быть обогащены соответствующими протеиногенными предшественниками для синтеза коллагена. Однако эта ситуация осложняется тем фактом, что такие аминокислоты, как глутамин, глутамат и аспартат, сильно метаболизируются в кишечнике и не попадают в заметных количествах в кровоток. Подробный обзор Albaugh et al. [98] исследует исследование, посредством которого добавление определенных аминокислот, таких как пролин, проводилось для стимуляции синтеза коллагена, но доказательство более высокой эффективности по сравнению с гидролизованным коллагеном требует дальнейших исследований.
Во время пищеварения многие ди- и трипептиды продуцируются in situ. В принципе, из 18 протеиногенных аминокислот можно получить 324 дипептида или 5832 трипептида. Даже если учесть обогащение разновидностями глицина, пролина и гидроксипролина, количество пептидов, которые потенциально могут стимулировать фибробласты к синтезу новых коллагенов, слишком велико для тестирования in vivo. Исследования показали, что значительные количества ди- и трипептидов, Pro-Hyp, Ala-Hyp, Ala-Hyp-Gly, Pro-Hyp-Gly, Leu-Hyp, Ile-Hyp и Phe-Hyp могут быть измерены в кровь человека после перорального приема различных гидролизатов коллагена [95–100]. Было показано, что некоторые из этих ди- или трипептидов стимулируют фибробласты in vitro [101,102]. Однако до настоящего времени не было продемонстрировано превосходящей эффективности индивидуальных или синтетических пептидов над сложной смесью олигопептидов, образующихся при переваривании коллагена. Пока не будут предоставлены такие доказательства, лучше продолжать использовать гидролизованный коллаген, обрабатываемый пищеварительной системой, в качестве источника стимулирующих фибробласты пептидов. Точно так же продукты для местного применения с использованием пептидов коллагена не могут обеспечить этот широкий спектр биоактивных пептидов, в дополнение к проблемам, связанным с чрескожной абсорбцией олигопептидов через роговой слой, которая ограничена.nnВыражение «витамины красоты» применялось к нескольким витаминам, но важность витамина С для кожи уникальна тем, что аскорбиновая кислота может действовать как кофактор нескольких ферментов при производстве коллагена, помимо своей роли антиоксидант в защите от повреждения свободными радикалами. Было показано, что важность витамина С в производстве функциональных коллагеновых волокон зависит от его использования в качестве кофактора при гидроксилировании остатков пролина в проколлагене (который стабилизирует структуру тройной спирали) и остатков лизина (которые используются для поперечного сшивания волокна, придающие конструкции жесткость и устойчивость). Гидроксилирование катализируется Fe (II) -зависимыми диоксигеназами в случае пролил- и лизилгидроксилаз [103]. Ферменты коллагена пролил-4-гидроксилазы (C-P4H) катализируют образование 4-гидроксипролина (4-Hyp) на коллагенах, модифицируя остатки пролина в положении Y (последовательности XY-Gly) в процессе, который требует Fe2 +, молекулярный кислород и аскорбиновая кислота [104]. Эта модификация происходит в эндоплазматическом ретикулуме до образования тройной спирали коллагена. Содержание 4-Hyp является ключевым фактором стабильности тройной спирали коллагена, без которой могут проявиться такие состояния, как цинга.
Как можно видеть на Фигуре 3, в эндоплазматическом ретикулуме клетки фибробластов специфические остатки лизина гидроксилируются ферментом лизилгидроксилазой с образованием гидроксилизина. Конкретные гидроксилизиновые остатки проколлагенового пептида могут подвергаться О-связанному гликозилированию до галактозилгидроксилизина или глюкозилгалактозилгидроксилизина под действием соответствующих ферментов трансферазы [105].
Модификация остатков лизина имеет решающее значение для заключительного этапа ковалентного внутримолекулярного и межмолекулярного поперечного сшивания, которое придает прочность, жесткость и долговечность коллагеновому волокну [Рисунок 3] [106]. Коллаген типа I имеет только 4 участка, в которых происходит этот процесс, то есть 2 участка телопептида на каждом конце пептида и 2 участка тройной спирали вдоль остова пептида. Существует два пути, используемых для поперечного сшивания коллагена: один основан на образовании альдегида, производного лизина, а другой - на образовании альдегида, производного гидроксилизина [25]. Первые пути являются ключевыми для создания кожного внеклеточного матрикса на основе коллагена.
Во внеклеточном пространстве остатки лизина N- и C-телопептидов могут подвергаться окислительному дезаминированию с образованием реакционноспособных альдегидов за счет активности лизилоксидазы [105]. Лизилоксидаза представляет собой медь-металлофермент, которому необходим витамин B6 (пиридоксальфосфат) в качестве кофактора, который может превращать аминовую боковую цепь лизина (и / или гидроксилизина) в соответствующий альдегид. Эти реакционноспособные частицы могут затем претерпевать серию неферментативных реакций конденсации с гидроксилизиновыми остатками вдоль пептидного остова с образованием ковалентных внутримолекулярных и межмолекулярных поперечных связей [Рисунок 3]. Хотя эта последовательность ферментативных модификаций на первый взгляд кажется сложной, это элегантная система, которая позволяет заключительным стадиям поперечного сшивания крупных коллагеновых волокон происходить вне клетки и в ECM, обеспечивая образование большого структурного белкового каркаса и эластичная матрица, поддерживающая кожу.