Возрастные особенности межклеточного матрикса кожи
1. Синтез и структура коллагена в коже
Синтез коллагена фибробластами
Коллаген обеспечивает поддерживающую матрицу/матрас, лежащую в основе здоровой кожи, и является ключевым фактором сохранения упругости и эластичности кожи [1,2]. Тип I - это основной коллаген кожи, составляющий 80–90% коллагена кожи. Он продуцируется клетками, называемыми фибробластами, которые относятся к типу мезенхимальных клеток, обнаруживаемых преимущественно в дерме [3]. Фибробласты также производят белок эластин, который придает коже гибкость для растяжения, обеспечивая деформируемость на большие расстояния, за которой следует отдача, позволяющая тканям вернуться к своей исходной конформации [4,5]. Это критически важная функция для поддержания эластичности и упругости кожи [Рисунок 1]. Другим продуктом метаболической функции фибробластов является производство гликозаминогликанов (ГАГ), которые представляют собой неразветвленные длинные гетерополисахариды, такие как гиалуронаты и дерматансульфат (наиболее распространенный ГАГ в коже). Уникальное сочетание высокой вязкости, высокой гигроскопичности и низкой сжимаемости является ключом к их многим функциям, включая поддержание необходимого содержания влаги в коже [6].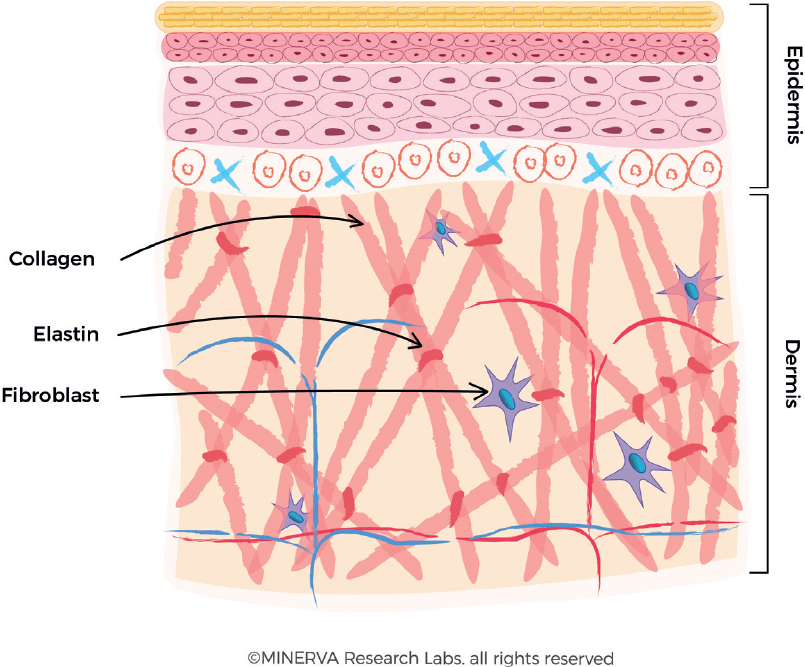
Рисунок 1. Образование коллагеновых волокон в дерме. Фибробласты секретируют проколлагеновые волокна во внеклеточный матрикс, где они образуют более крупные коллагеновые пучки. Эластин также секретируется и собирается в макромолекулярную структуру на основе коллагена.
Фибробласты чувствительны к физическому напряжению внеклеточного матрикса (ЕСМ), в который они встроены, а также к биохимическим стимулам и сигнальным путям, которые могут вызывать активацию и пролиферацию фибробластов [7]. Маломолекулярные, диффундирующие лиганды могут связываться с рецепторами, расположенными на внеклеточной мембране фибробластов, вызывая их активацию. Физическое напряжение в ECM может напрямую вызывать активацию механорецепторов и закрепляющих фибрилл внутренней структуры цитоскелета и инициировать сигнальные пути, участвующие в коммуникации между клетками и ECM [8]. Активация фибробластов приводит к увеличению продукции коллагена, эластина и ассоциированных ГАГ [9].
Многие стратегии против старения нацелены на то, чтобы повлиять на продукцию компонентов внеклеточного матрикса фибробластами. На пролиферацию и активацию фибробластов может влиять широкий спектр лигандов, включая биоактивные пептиды, антиоксиданты, ретиноиды, витамины, ω6- и ω3-жирные кислоты, факторы роста, гидроксикислоты и множество растительных экстрактов [10–12]. Общей темой для большинства этих ингредиентов является то, что они могут прямо или косвенно влиять на выработку коллагена и компонентов ECM.
С раннего взросления фибробласты становятся менее активными, и производство коллагена снижается примерно на 1,0–1,5% в год [13,14]. Это также может усугубляться определенным образом жизни, например курением, и внешними факторами, такими как пребывание на солнце [15]. Постоянный солнечный свет и загрязнение окружающей среды, а также снижение эффективности удаления свободных радикалов усугубляют ущерб. Многие исследования показали, что при проглатывании пептидов коллагена (и других активных соединений) они будут перемещаться по всему телу, в том числе к участкам, где присутствуют фибробласты. Это стимулирует фибробласты производить больше коллагена, эластина и гиалуроновой кислоты, тем самым омолаживая кожу и другие ткани. Этот механизм является ключом к успешному производству коллагена, о котором сообщалось в клинических исследованиях, после длительного использования добавок и последующего улучшения эластичности и гидратации кожи.
Недавнее исследование in vitro, проведенное Эдгаром и др. [16] показал, что гидролизованные пептиды коллагена значительно увеличивают синтез коллагена и эластина фибробластами, в то же время значительно ингибируя высвобождение двух коллагеназ, а именно металлопротеиназы-1 (MMP-1) и MMP-3. В исследовании в первую очередь изучалось взаимодействие между пептидами коллагена и другими составляющими (включая ГАГ и антиоксиданты), присутствующими в нутрицевтике на основе гидролизованного коллагена, Gold Collagen® Forte, на нормальную функцию первичных дермальных фибробластов. Эффекты добавления пептидов коллагена, по отдельности или в комбинации с другими биологически активными и антиоксидантными составляющими, были протестированы и сравнены с эффектом только среды. Увеличение синтеза коллагена и эластина сопровождалось снижением активности ферментов ММП. Ферменты ММП ответственны за разрушение матрикса и деградацию эластина, а увеличение активности ММП связано с УФ-облучением и повреждением компонентов ЕСМ свободными радикалами на основе реактивного кислорода [17,18]. Эти данные предоставили научное клеточное обоснование положительного воздействия нутрицевтических добавок на основе коллагена на свойства кожи, предполагая, что усиленное образование стабильных внеклеточных клеток, полученных из дермальных фибробластов, может следовать за их пероральным приемом.
Collagen fibril formation and characterization
Существует около 28 различных форм коллагена, экспрессируемых в организме, из которых молекулярная биология, биохимия, структурные и архитектурные компоненты внеклеточного матрикса подробно рассмотрены Shoulders et al. [2,19] и в кратком обзоре Kadler et al. [20]. Семейство белков включает как фибриллообразующие, так и нефибриллообразующие белки, однако основными коллагенами, участвующими в архитектуре и физиологии кожи, являются фибриллообразующие типы, преимущественно тип I и тип III (римские цифры обозначают порядок открытия) . Каждый белок кодируется серией генов с локусами генов для членов семейства коллагена, помеченными аббревиатурой «COL», за которой следует аннотация как для типа коллагена, так и для составляющих цепей, например, COL1A1 для цепи α1 коллагена типа I. [21]. Коллаген типа I, прототип, а также наиболее распространенный член, имеет длинноцепочечную тройную спиральную структуру, включающую гетеротример из двух идентичных цепей αl (l) и одной цепи α2 (I) [Рисунок 2]. Основной структурной детерминантой белка является трехспиральная структура из трех полипептидных цепей с характерной аминокислотной последовательностью (Gly-XY), которая часто повторяется в структуре фибрилл, где Gly - это глицин, а X и Y часто бывают аминокислотами. такие как пролин и гидроксипролин [22].
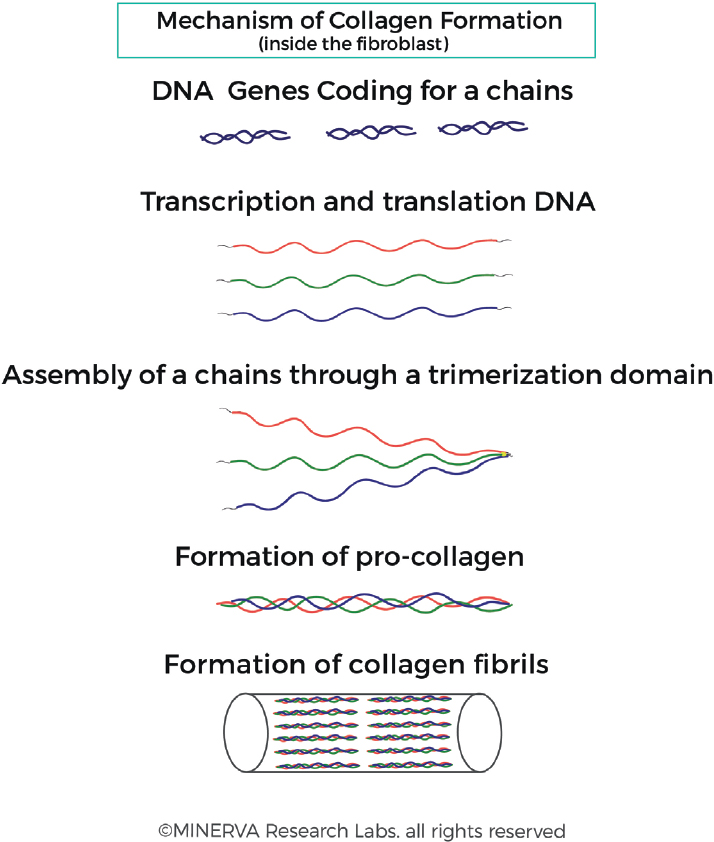
Рисунок 2. Формирование коллагеновых фибрилл. Гены коллагена транскрибируются в РНК и транслируются в белок в клетке фибробласта. Происходит посттрансляционный процессинг с последующим связыванием трех отдельных цепей на С-конце. 3 цепи плотно связаны друг с другом и поддерживаются поперечными звеньями, которые стабилизируют структуру. Этот процесс тримеризации позволяет собирать α-цепи, которые затем собираются в фибриллы.
Гены, кодирующие альфа-цепи коллагенов, транскрибируются в РНК и транслируются в белок в эндоплазматическом ретикулуме клетки фибробластов и обрабатываются в секреторной везикуле. Связывание 3 отдельных цепей на С-конце инициирует образование тройной спирали, которая движется к N-концу подобно застежке-молнии [Рис. 2]. Это позволяет сборку α-цепей в процессе тримеризации с образованием проколлагенов, которые затем собираются в фибриллы [23]. После секреции структуры тройной спирали коллагена в ЕСМ происходит посттрансляционное расщепление N- и C-концевых пептидов [Рисунок 3].
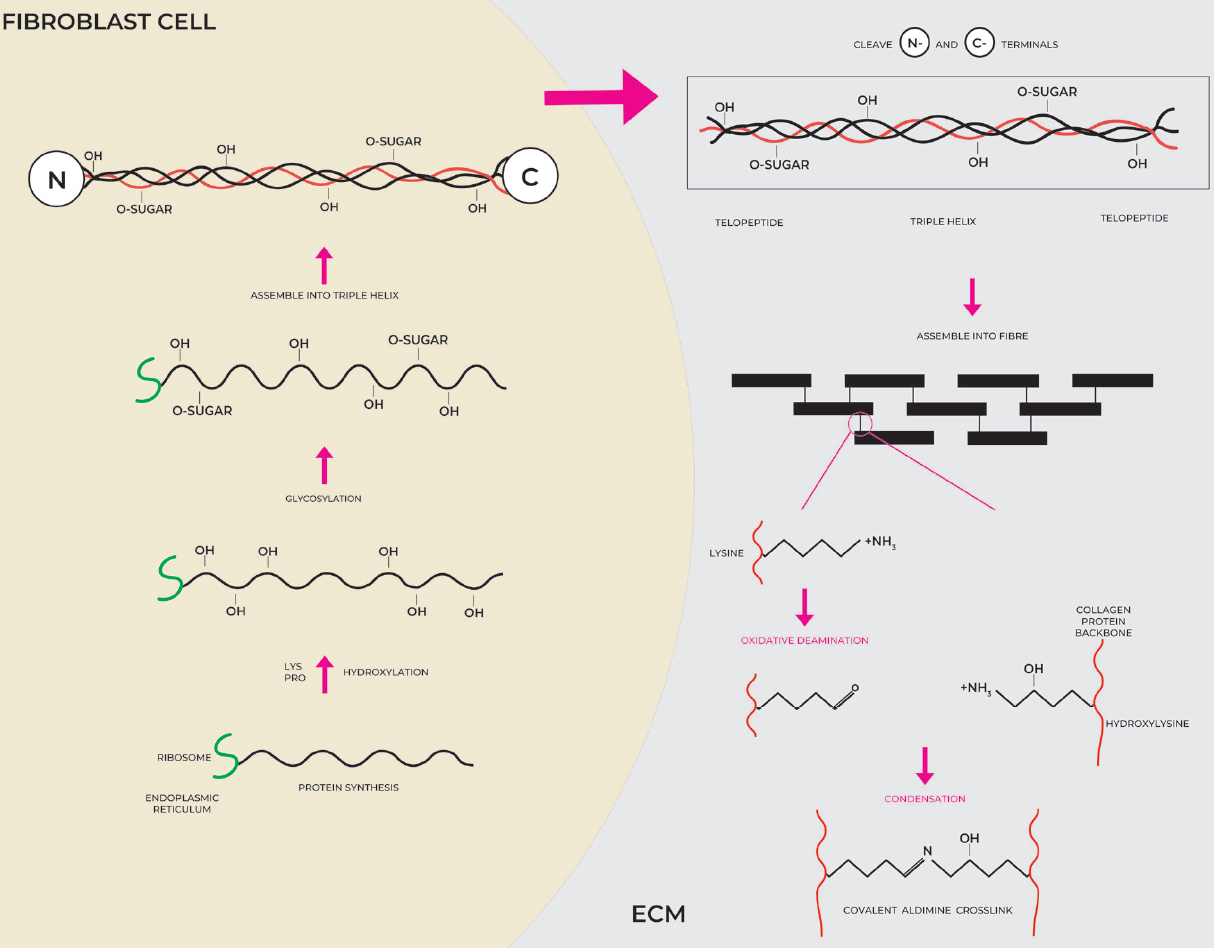
Рисунок 3. Синтез коллагена, секреция в ECM и перекрестное связывание. Коллагены транслируются в белок на рибосомах эндоплазматического ретикулума внутри клетки фибробласта. Гидроксилирование и гликозилирование происходят до того, как 3 спиральные нити будут сплетены вместе, чтобы сформировать разновидности проколлагена. После секреции в ЕСМ N-концевой и С-концевой концы расщепляются, и единицы тропоколлагена могут быть собраны в более крупную структуру, которая удерживается вместе за счет сшитых остатков между производным лизина альдегида одной цепи коллагена и соответствующим гидроксилизином коллагеновой цепи. противоположная нити.
Уникально высокое содержание аминокислот пролина (или, более конкретно, иминокислоты, где вторичный амин приводит к жестко-кольцевой структуре с ограничением вращения, которое придает уникальную структурную стабильность) и лизина позволяет проводить ряд посттрансляционных модификаций из-за гидроксилирования остатки пролина и лизина [24]. Гидроксилирование лизина позволяет сшивать переплетенные волокна и придает нерастворимому белку уникальные характеристики, включая термическую стабильность, механическую прочность и трехмерную структуру, пригодную для производства свернутых в спираль волокон, которые очень устойчивы к различным механическим и биологическим силам, испытываемым в течение всей жизни [Рисунок 3] [25].
Коллаген I типа присутствует в коже, сухожилиях, сосудистой сети, органах и костях (он является основным компонентом органической части кости, каркасом, который впоследствии минерализуется, чтобы создать структуру, более прочную, чем сталь, но при этом достаточно легкую, чтобы облегчить подвижность и скорость). Тип II преимущественно присутствует в хрящах, веществах, во много раз более гладких, чем стекло, с очень низким коэффициентом трения, но при этом они не хрупкие и не трескаются под давлением. Тип III обычно встречается вместе с Типом I и обычно составляет около 15% кожного коллагена. Это гомотример, состоящий из трех идентичных пептидных цепей α1.
Коллагеновые волокна образуют обширные и прочные сети, придающие дерме прочность, упругость и эластичность. Как показано на рисунке 4, коллагеновое волокно обычно имеет диаметр до 3 мкм и имеет характерную спиральную структуру [2,26]. Коллагеновое волокно по существу состоит из пучков более мелких фибрилл. Коллагеновые фибриллы имеют диаметр от 10 до 300 нм и длину несколько микрометров. Коллагеновая фибрилла представляет собой пучок трехцепочечных молекул коллагена (около 1,5 нм в диаметре и примерно 300 нм в длину). Эта тройная спираль, спиральная структура является стереодинамически благоприятной, позволяя переплетать нити вместе, и эта невероятно прочная структура может сохраняться в тканях в течение многих лет [27,28].
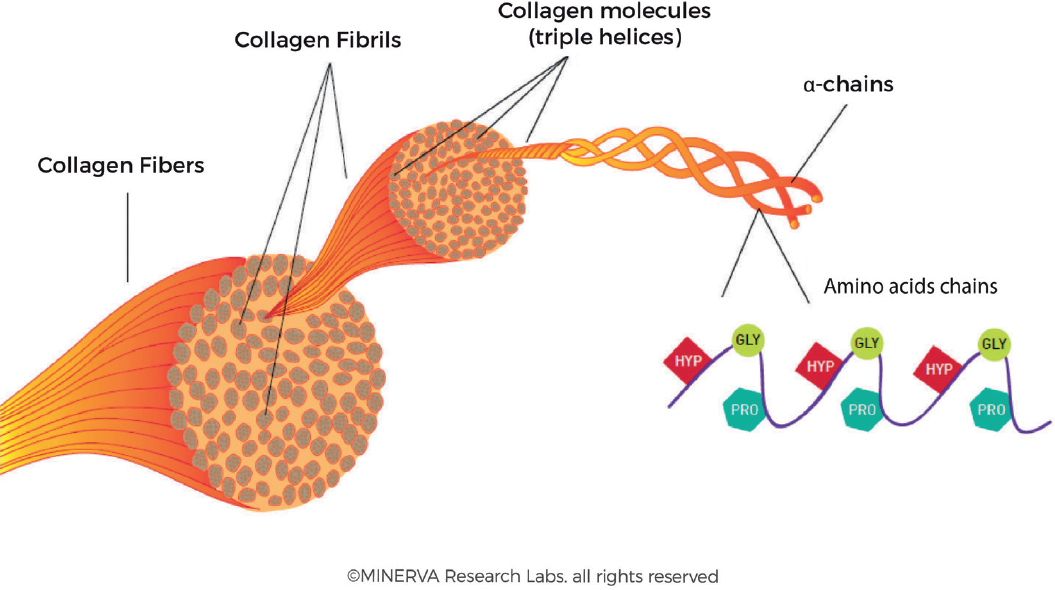
Рисунок 4. Организация фибрилл коллагена в пучки волокон. Отдельные α-цепи сплетены в тройные спирали с помощью механизма застежки-молнии. Связки тройных спиралей образуют фибриллы, и эти фибриллы объединяются в более крупные волокна.
Неинвазивные системы визуализации могут использоваться для визуализации и количественной оценки коллагена в коже. Ультразвуковые устройства доступны для использования в клинических исследованиях в зависимости от требуемого применения и дизайна исследования, например, для измерения коллагена в коже по сравнению с сухожилием, в тестируемом участке тела (рука против лица), разрешающей способности (мкм), чувствительности и измерении глубины кожи (папиллярный по сравнению с ретикулярная дерма). Диапазон частот для визуализации кожи рекомендуется 20-25 МГц. Получение изображений с помощью конфокальной микроскопии приобрело огромное значение, поскольку технологические достижения в разрешающей способности позволили визуализировать и количественно оценить компоненты дермы с мельчайшими деталями. Многофотонная микроскопия (MPM) и отражательная конфокальная микроскопия (RCM) продемонстрировали многообещающие результаты в визуализации микроморфологии кожи. ОКМ стал жизненно важным инструментом для точного анализа клеточных изображений кожи человека in vivo для изучения изменений клеточных параметров, таких как размер клеток, размер ядра, морфология кератиноцитов (которая становится все более нестабильной с возрастом или воспалением) и для диагностики морфометрических особенностей. типа коллагеновых волокон [31]. В дерме фибриллярная классификация типов коллагена классифицируется как гипоотражающие и гиперотражающие структуры, указывающие на интенсивность и четкость волокна, при этом гипоотражающий коллаген затрудняет идентификацию отдельных волокон по сравнению с гиперотражающим коллагеновым волокном, которое хорошо работает. определенная и волокнистая по своей природе [32]. Дальнейшая характеристика типа коллагена как тонкого сетчатого, грубого, скрученного или свернувшегося позволяет более подробно описать коллаген кожи и изменения, наблюдаемые на протяжении всего жизненного цикла.
В элегантной серии исследований Ueda et al. [33] использовали комбинированную визуализацию MPM и двухосное растяжение ткани, чтобы показать in vivo трехмерную архитектуру организации коллагеновых волокон в ретикулярной дерме мужчин и женщин в возрасте от 36 до 75 лет. Ткань была собрана во время реконструктивной операции. Техника позволила детально отобразить волокна в различных ситуациях, от плотной упаковки переплетенных волокон до вытянутой или расширенной конформации. Они показали, что в ретикулярной дерме есть относительно крупные волокна коллагена с характерной волнистой морфологией, плотно упакованные, но все же отчетливо видимые в виде переплетающихся структур с горизонтальной ламинарной организацией. Они также показали, что структура дермы варьируется по глубине, например, коллагеновые волокна расположены толще в глубокой ретикулярной дерме и более плотно упакованы в средней дермальной зоне. Эти открытия продвигают наше понимание фундаментальных механизмов, лежащих в основе роли коллагена в определении податливости кожи человека.