Введение в нейробиологию
12. Мембранный транспорт и генерация мембранных потенциалов
Первичные активные катионные транспортеры активируют многие из основных функций нервной системы. Они превращают свободную энергию из гидролиза АТФ в электрохимическую энергию, которая хранится в градиентах трансмембранной концентрации Na +, K +, Ca2 + и протонов. Эти устройства хранения энергии используются сигнальными белками мембранных каналов, а также вторичными транспортерами, которые избирательно концентрируют многие другие ионы и молекулы. Вторичные транспортеры поддерживают множество различных нервных функций, таких как упаковка нейротрансмиттеров в везикулах и прерывание сигналов в синапсах. Также классифицируются как транспортеры - медиаторы - белки; они позволяют специфическим молекулам диффундировать через мембраны, часто под контролем регулятора, но неспособные «поднимать» транспорт (рис. 5-1). Что касается ионных каналов, которые при открытии позволяют рассеивать тысячи ионов на канал в миллисекундах (глава 6), транспортерам обычно требуется миллисекунды для перемещения ионов 1-3 или молекул в течение реакционного цикла в направлении подъема. Таким образом, транспортеры обычно экспрессируются с гораздо большей плотностью в мембранах, чем ионные каналы.
Первичные транспортеры, обсуждаемые в этой главе, относятся к трем отдельным геномным надсемействам, которые заметно отличаются по структуре и механизму реакции. Эти P-, V0V1- и ABC-суперсемейные элементы все катализируют реакции с АТФ, которые приводят к конформационным циклам для перемещения субстратов через мембраны и «в гору» до более высоких концентраций. Транспортеры типа Р имеют один и тот же общий механизм реакции. Большинство насосов, принадлежащих к надсемейству транспортеров P-типа, эволюционировали для создания градиентов катионов. В случае насосов Na +, K + P-типа Na +, концентрации Na + и K + концентрации, генерируемые во всех эукариотических плазматических мембранах, представляют собой большое потенциальное хранилище энергии, которое используется для электрической сигнализации и для вождения вторичных транспортеров. Градиенты Ca2 + также генерируются транспортерами P-типа, но эти градиенты используются в основном для внутриклеточной сигнализации (глава 22). Структуры и механизмы реакции насосов Na +, K + и Ca2 + аналогичны и обеспечили понимание функционирования всего класса транспортеров P-типа. Из-за различий в роли двух различных катионов субстрата в его механизме реакции насос Na +, K + наиболее удобно иллюстрирует механизм насосов типа P. Насосы Na +, K + управляются циклом конформационных переходов, который обусловлен фосфорилированием их каталитических участков, активированным цитоплазматическим Na +, и гидролизом тех же фосфорилированных сайтов, активированных внеклеточным K + Рис. Цикл инициируется связыванием АТФ с каталитическим сайтом и цитоплазматическим связыванием Na + со всеми тремя ионофорическими сайтами. Каталитические сайты содержат аспартильный остаток, который становится фосфорилированным только тогда, когда все три связывания Na + связываются с ионами натрия. Фосфорилирование аспартила легко обратимо, когда молекула насоса находится в конформации Е1; то есть энергетические состояния E1-аспартилфосфатной связи и фосфатной связи АТФ аналогичны. Это продемонстрировано способностью фосфорилированного фермента рефосфорилировать ADP к АТФ в условиях, которые ингибируют стадию 3 в Рис. Однако активное формирование накачки аспартилфосфатной связи инициирует быстрый переход к конформации E2-P, в котором ионофорические сайты изменили свою избирательность, в результате чего три Na + выгружаются внеклеточно в обмен на связывание двух K +. Это инициирует гидролиз аспартилфосфатной связи в состоянии E2, который, в сочетании с связыванием АТФ, заставляет E2 возвращаться к E1. Вследствие этого ионофорические сайты выгружают два K + в цитоплазму. Связывание ATP инициирует следующий транспортный цикл. Эта реакция переноса может происходить со скоростью ≈10000 циклов в минуту. Как отмечалось выше, насос Na +, K + обменивает три Na + на два K + на транспортный цикл. Это создает чистый поток положительного заряда, который может генерировать электрогенный потенциал. Степень гиперполяризации мембраны насосом может быть оценена путем измерения снижения мембранного потенциала, создаваемого селективными ингибиторами Na +, K +, такими как уабаин. Электрогенный потенциал обычно мал, 10 мВ или менее, потому что противоположные ионные токи протекают через каналы или вторичные транспортеры в смежной мембране. Однако в некоторых нейронах и мышечных клетках гиперполяризация натрийского насоса может сократить продолжительность действия потенциала и способствовать отрицательным послепотенциалам. В сердечной мышце гиперполяризация из-за перекачки Na + происходит после устойчивого увеличения частоты следования импульсов и может быть фактором сердечных аритмий. [1].
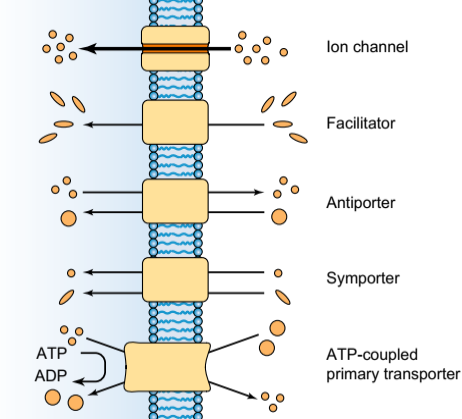
Типы мембранных транспортных белков. Ионные каналы обеспечивают стробированные диффузионные пути через клеточные мембраны, которые регулируются мембранным напряжением, взаимодействиями с лигандами и / или фосфорилированием. Фасилитаторы или несвязанные транспортеры обеспечивают высокоселективные пути, например. для d-глюкозы или воды, но не связаны с источниками энергии и поэтому не могут концентрировать свои субстраты. Транспортеры, которые соединены с источниками энергии, могут изменять стабильное распределение их ионов субстрата и / или молекул. Вторичные транспортеры получают энергию от существующих ионных градиентов для переноса второго иона или молекулы в направлении, которое либо совпадает с (симпортом), либо противоположно (антипорту) с энергией иона. Первичные транспортеры соединяют химическую реакцию с конформационными переходами белка, которые подают энергию для получения градиентов концентрации одного или нескольких субстратов через клеточные мембраны. Для определения и классификации транспортных средств и каналов см. Онлайн-базы данных [41].