Биомаркеры крови при гипертезии
| Сайт: | Электронный информационно- образовательный портал ВолгГМУ |
| Курс: | Дисциплина Медицинская биохимия. Принципы измерительных технологий в биохимии. Патохимия, диагностика. Биохимия злокачественного роста». Часть 3 |
| Книга: | Биомаркеры крови при гипертезии |
| Напечатано:: | Гость |
| Дата: | Вторник, 21 Май 2024, 14:43 |
Оглавление
1. Введение
Артериальная гипертония (АГ) является основной причиной предотвратимой смертности и инвалидности во всем мире и является основным фактором глобального риска сердечно-сосудистых заболеваний (1). По оценкам, его распространенность составляет 30–45% среди населения в целом, что приводит к увеличению бремени болезней сердца, васкулопатии, нефропатии и цереброваскулярных повреждений, часто с разрушительными последствиями (1). АГ является причиной как минимум 45% смертей от болезней сердца, 51% смертей от инсульта и приблизительно 16,5% (9,4 миллиона) всех смертей ежегодно ( 2 ). Диагноз гипертонической болезни (ГБ) основан на классификации уровней артериального давления АД - систолического артериального давления (САД), превышающего или равного 130 мм рт. Ст., И диастолического артериального давления (ДАД), превышающего или равного 80 мм рт. Ст. ( 3 ). Значения АД сильно различаются и имеют тенденцию к увеличению с возрастом в популяции. Риск сосудистых осложнений линейно возрастает с увеличением значений АД (4). Существует много гемодинамических факторов, участвующих в регуляции АД, которые включают сердечный выброс, общее периферическое сопротивление, ударный объем и частоту сердечных сокращений.По крайней мере четыре системы отвечают за прямое регулирование АД, которые включают сердечную систему, почечную систему, тонус кровеносных сосудов и гормональный статус (3).
Приблизительно 90% пациентов с АГ имеют повышенные АД без какой-либо известной причины, и их называют гипертонической болезнью ( 5 ). Эссенциальная гипертония (ЭГ) определяется как идиопатическое хроническое повышение системного АД (5). Этот диагноз часто является одним из исключений, как правило, после исключения других причин АГ (вторичная гипертензия). Среди вторичных АГ выделяют АГ белого халата, легочную АГ, АГ, связанную с беременностью, синдром Кушинга, реноваскулярную АГ, почечную паренхиматозную болезнь, первичный гиперальдостеронизм и феохромоцитому (6).
Методы измерения АД эволюционировали от традиционных офисных измерений с помощью сфигмоманометров до амбулаторного мониторинга АД и домашнего АД-мониторинга (7). Были разработаны неинвазивные устройства центрального АД, которые могут выявлять различия между центральным и периферическим АД, но их использование в клинической практике является спорным, поскольку крупные исследования не выявили клинически значимого различия в оценке этих подходов ( 8 , 9 ). Независимо от устройства, используемого для оценки АД, общепринятая практика предоставляет нам только значения и закономерности. Они не отвечают на такие важные вопросы, необходимые для эффективного управления и индивидуализации управления АГ, как точный патогенный механизм (3). Они также не могут эффективно передавать и прогнозировать существующее, неизбежное или случайное повреждение конечного органа, вызванное АГ.
Биомаркеры являются объективными количественными характеристиками биологических процессов, которые можно точно и воспроизводимо измерить (10). Они могут соотносятся с клиническими симптомами пациента или нет. С другой стороны, что клинические конечные точки представляют здоровье и благополучие субъекта исследования с точки зрения субъекта. Однако современная практика демонстрирует, что некоторые специфические биомаркеры были хорошо охарактеризованы и неоднократно показывали, что они правильно предсказывают соответствующие клинические исходы для различных видов лечения заболеваний и затронутых групп населения.Таким образом, их присутствие в качестве первичных конечных точек в клинических испытаниях широко признано (3).Множественные биомаркеры крови для АГ были идентифицированы за эти годы и могут пролить свет на основные процессы, вовлеченные в развитие и прогрессирование ГБ.
Поэтому в этой главе мы рассмотрим применимость многочисленных изученных биомаркеров крови, чтобы лучше понять патофизиологию, диагностику, прогрессирование и терапевтическую эффективность ЭГ. Схематическое представление разделов, рассматриваемых в этом обзоре, показано на рисунке 1 .
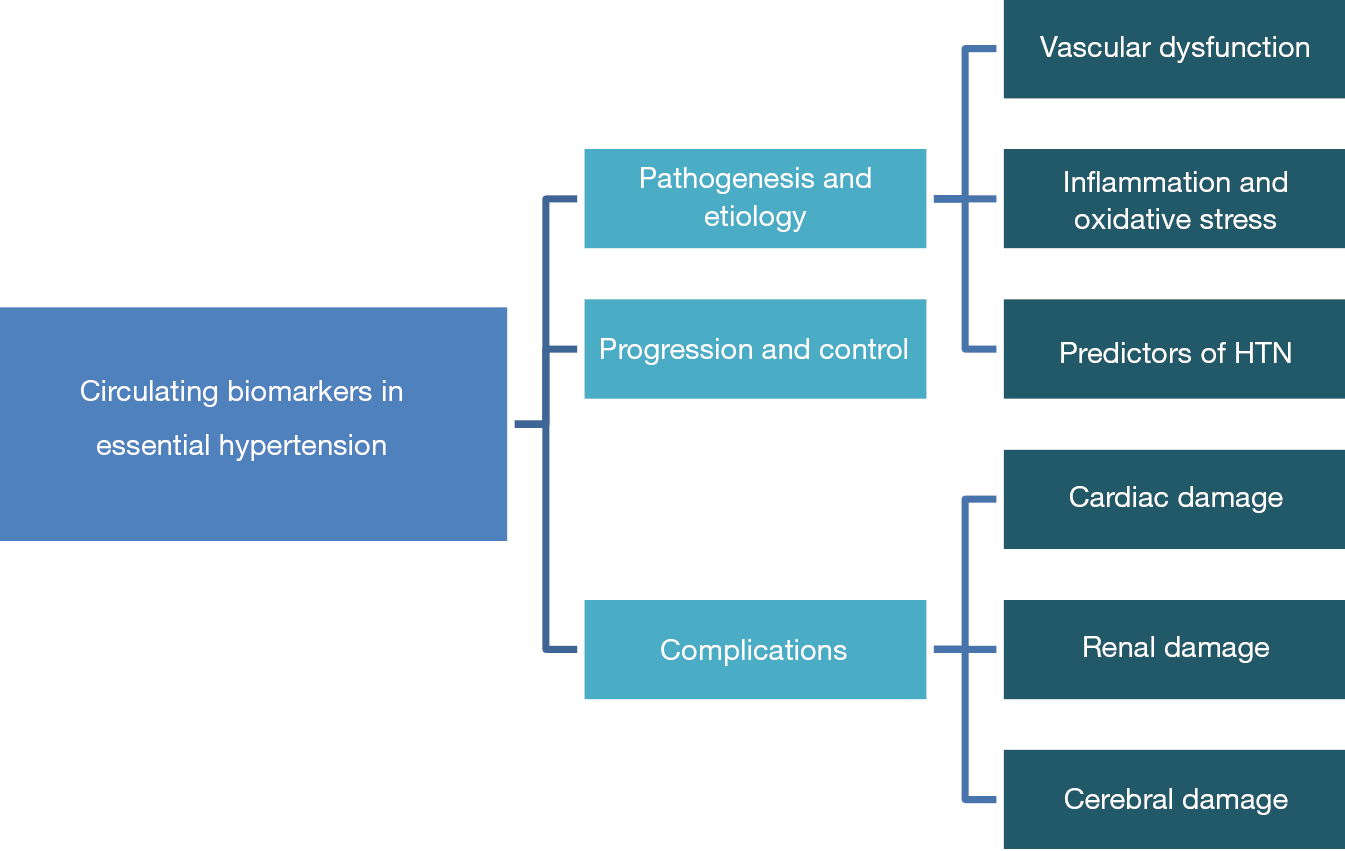
Рис.1.Схематическое представление роли циркулирующих биомаркеров при эссенциальной гипертонии.HTN, гипертония
2. Биомаркеры патогенеза ГБ, имеющие диагностическое значение
В этой группе биомаркеров целесообразно выделить 3 подгруппы:
- Сосудистая дисфункция;
- Воспаление и окислительный стресс;
- Предикторы гипертонии.
2.1. Сосудистая дисфункция
Сосудистая дисфункция является хорошо зарекомендовавшим себя механизмом развития ЭГ ( 7 ). Хотя сосудистая дисфункция играет ключевую роль в развитии HTN, она также может возникать в результате HTN. Таким образом, оценка маркеров сосудистой дисфункции не только позволяет нам понять патогенез HTN, но также помогает нам распознавать прогрессирование заболевания, контролировать эффективность лечения и развитие сопутствующих осложнений ( 7 ).
Система ренин-ангиотензин-альдостерон играет важную и центральную роль в регуляции АД ( 11 ). Некоторые биомаркеры могут быть определены количественно, чтобы помочь нам лучше понять механизмы развития HTN и могут служить потенциальными целями лечения. Ангиотензин A (Ang A) и фактор, ингибирующий вазоконстрикцию (VIF), являются новыми вазоактивными веществами, легко обнаруживаемыми с помощью масс-спектрометрии, которые участвуют в создании равновесия между вазоконстрикцией и вазодилатацией ( 11 , 12 ). Ang A представляет собой биологически активный октапептид, декарбоксилированное производное ангиотензина II (Ang II). Было обнаружено, что в нормальной плазме человека Ang A может модулировать вредное воздействие Ang II. Ang A также оказывает дозозависимый прессорный и почечно-сосудосуживающий эффекты. Было продемонстрировано, что оно вызывает повышение среднего артериального давления (MAP) у мышей, которое блокируется антагонистами рецептора AT 1, такими как лозартан. Выключение рецепторов AT 1 практически устраняет сосудистые эффекты Ang A ( 13 ). В то время как ангиотензин А имеет некоторые доказательства воздействия MAP в исследованиях на животных, необходимы клинические исследования. Клинические данные позволят определить, действительно ли ангиотензин А можно использовать в качестве мишени в терапии для лечения АД.
VIF представляет собой пептид хромогранина А с вазорегуляторными свойствами, которые опосредуются рецептором AT2 ( 12 ). VIF модулирует вазоконстриктивные эффекты Ang II. Уровни VIF значительно повышены у пациентов с почечной и сердечной недостаточностью, что говорит о том, что VIF может быть защитным фактором, противодействующим вредному воздействию Ang II.Ориентация на этот биомаркер может потенциально помочь в разработке новых стратегий лечения против HTN и, в конечном счете, сердечно-сосудистых заболеваний ( 12 ).
Эндотелиальные микрочастицы (ЭМИ) представляют собой субмикронные мембранные фрагменты, которые высвобождаются во внесосудистое пространство клетками, которые находятся либо в состоянии стресса, либо повреждены ( 14 ). Хотя EMP присутствуют в плазме и других жидкостях организма здоровых людей, их уровни также изменяются во многих состояниях, таких как HTN, диабет, дислипидемия и хроническое заболевание почек среди других ( 14 ). Исследования показали, что в HTN наблюдается увеличение EMP CD144 + и, возможно, EMP CD 31 + / CD41- ( 15 ). Также известно, что антигипертензивные препараты, включая бета-адреноблокаторы, блокаторы рецепторов ангиотензина и блокаторы кальциевых каналов, оказывают влияние на определенную подгруппу циркулирующих ЭМП ( 15 ). Хотя ПУОС могли бы дополнительно объяснить патофизиологию сосудистой дисфункции при HTN, измерение является громоздким, и существуют ограничения, которые делают эти новые биомаркеры еще не клинически применимыми. ЭМИ были оценены в очень немногих крупных образцах, потому что они требуют специальной обработки образцов и, следовательно, их трудно измерить ( 15 , 16 ). Измерение циркулирующих ЭМИ зависит от различных методов центрифугирования в плазме, не содержащей тромбоцитов, и от идентификации антигенов на клеточной поверхности. Более того, концентрации обычно измеряют проточной цитометрией для идентификации клеточных и молекулярных маркеров в плазматических клетках. В будущих проспективных когортных исследованиях могут быть использованы подходящие образцы для ЭМИ и другого фенотипирования на основе клеток ( 16 ). Поэтому необходимо провести дополнительные исследования для оценки роли ПУОС в управлении HTN.
2.2. Воспаление и окислительный стресс
Все больше доказательств показывает, что воспаление играет решающую роль в патогенезе и развитии HTN (17-19). Основное ГТН, в частности, характеризуется повышенным сопротивлением периферических сосудов к кровотоку в артериях. Эти резистентные артерии в конечном итоге подвергаются ремоделированию сосудов (например, увеличение ширины среды и уменьшение размера просвета), что приводит к структурным и функциональным изменениям в эндотелии ( 18 ). Эти изменения часто проявляются на ранних стадиях ГТН отчасти из-за системного воспаления. Кроме того, отложение внеклеточного матрикса и воспаление участвуют в ремоделировании сосудов ( 18 ). В исследованиях как на животных, так и на людях было показано, что провоспалительные компоненты системы ренин-ангиотензин-альдостерон играют роль в сосудистых изменениях ( 17 ). Сосудистые изменения в HTN часто связаны с механическими факторами, которые модулируют последующие сигнальные эффекты, что приводит к нарушению функции, отложению внеклеточного матрикса и воспалению. HTN влияет на эндотелий посредством гемодинамических изменений, приводящих к его дисфункции и повышенным уровням воспалительных маркеров, таких как интерлейкин-6 (IL-6), молекула внутриклеточной адгезии 1 (ICAM1), P-селектин и фактор некроза опухоли-α (TNF- α) ( 18 , 19 ).
Поперечные исследования последовательно связывают более высокие уровни IL-6 и C-реактивного белка (CRP) с сердечно-сосудистыми заболеваниями и HTN ( 16 ). СРБ является хорошо известным острофазовым реагентом, который был тщательно изучен в отношении ЭГ (20-22). Сессо и соавт. изучали связь CRP, и развитие HTN в предполагаемой когорте состояло из 525 женщин в возрасте ≥45 лет с нормальным АД ( 21 ). Участники наблюдались в течение среднего периода 7,8 лет. Исходный уровень СРБ в плазме и коронарные факторы риска были собраны. Результаты исследования показали, что более высокие уровни СРБ были в значительной степени связаны с повышенным риском развития HTN, в том числе с низким уровнем исходного АД и без факторов коронарного риска ( 21 ).
Другое исследование Sesso et al. оценивали СРБ наряду с другими плазменными маркерами воспаления и риском развития HTN у мужчин в проспективном, вложенном исследовании случай-контроль ( 20 ). Диагноз ГТН самопровозглашался с помощью контрольных вопросников, которые участники получали каждые 6 месяцев. Были взяты исходные образцы крови и проанализированы маркеры воспаления. Результаты исследования включали более высокие уровни IL-6 и D-димера в плазме в случаях HTN по сравнению с контролем, что было несущественным. Они обнаружили, что у мужчин в самом высоком квартиле СРБ было более высокое исходное АД, они были старше, тяжелее и чаще имели историю гиперлипидемии, курения и неактивности.Самый высокий и самый низкий квартиль IL-6 в плазме не обнаружил различий в САД. Тем не менее, это исследование продемонстрировало, что СРБ и ИЛ-6 не были достоверно связаны с более высоким риском развития HTN у мужчин среднего и старшего возраста, особенно после корректировки на ИМТ ( 20 ).
Исследование Wang et al. оценили около 3500 участников для выявления биомаркеров с самой сильной ассоциацией риска HTN и характеристик мультимаркерного подхода для прогнозирования частоты HTN ( 23 ). Изученные воспалительные биомаркеры включали СРБ, фибриноген и активатор плазминогена-1 (PAI-1), а также мозговой натрийуретический пептид (BNP), гомоцистеин, альдостерон в сыворотке, ренин плазмы и соотношение альбумин / креатинин в моче (UACR). Результаты были значимыми для набора из трех биомаркеров: CRP, PAI-I и UACR, которые были связаны с более высоким риском развития HTN. Интересно, что связь между сывороточным альдостероном и случайной HTN была незначительной после корректировки на CRP, PAI-I и UACR. Это может свидетельствовать о том, что взаимодействия между альдостероном и этими маркерами воспаления могут существовать.Величина ассоциации каждого биомаркера была одинаковой и также имела сходные коэффициенты регрессии. Исследование продемонстрировало, что ассоциация СРБ сохраняется после учета других биомаркеров ( 23 ). Исследование было ограничено тем, что в нем использовались мультимаркерные анализы, а не отдельные биомаркеры. Авторы утверждают, что этот подход ограничен практическими ограничениями, так как не представляется возможным изучить все возможные биомаркеры, так как биомаркеры для включения могут изменяться со временем и достижениями в медицинских знаниях. Другое ограничение заключалось в том, что эта группа была преимущественно белой популяцией, результаты которой не могут быть обобщены для лиц других рас.
В экспериментальных моделях HTN способствует эндотелиальной дисфункции, подавляя эндогенную продукцию оксида азота ( 24 , 25 ). Он также усиливает действие рецепторов ангиотензина-I в гладкой мускулатуре сосудов и, следовательно, вазоконстрикторных и проатерогенных эффектов ангиотензина-II ( 22 , 26 ). Ангиотензин-II способствует воспалению сосудов, стимулируя воспалительные цитокины, привлекая моноциты и вызывая окислительный стресс ( 22 , 26 ).
Уровень мочевой кислоты в сыворотке также оказался полезным маркером воспаления и окислительного стресса в HTN.Исследования показали значительную связь между уровнями мочевой кислоты, HTN и сердечно-сосудистыми осложнениями ( 27 , 28 ). Исследование Feig et al. обнаружили, что введение препаратов, снижающих уровень мочевой кислоты, таких как аллопуринол, у подростков с ожирением с предгипертонией приводило к заметному контролю АД и снижению системного сосудистого сопротивления ( 29 ). Исследователи приняли на работу 30 подростков с впервые диагностированным уровнем ЭГ 1-й стадии и уровнем мочевой кислоты в сыворотке крови 6,0 мг / дл или выше. Обнаружено, что лечение аллопуринолом связано со значительным снижением САД и ДАД. Среднее снижение 24-часового амбулаторного АД во время лечения аллопуринолом составило -6,3 мм рт.ст. и -4,6 мм рт.ст. Снижение амбулаторного АД напрямую коррелировало с лечением аллопуринолом.Ограничениями этого исследования были его небольшой размер и популяция, которая состояла из 30 подростков с легкой, недавно диагностированной HTN.
Кроме того, несколько исследований показали положительную связь между HTN и отношением нейтрофилов к лимфоцитам (NLR), которое также является надежным биомаркером системного воспалительного статуса. NLR является новым биомаркером как сердечных, так и несердечных расстройств. Из большой китайской когорты из 28 850 лиц без HTN, которые наблюдались в течение приблизительно 6 лет, Liu et al. продемонстрировали, что повышенный NLR значительно коррелирует с повышенным риском развития HTN после многомерного анализа ( 30 ). Другое исследование, проведенное Sun et al. 341 пациент в возрасте ≥80 лет обнаружил, что у пациентов с гипертонической болезнью с более высоким квартилем NLR была более высокая смертность от всех причин в течение 90 дней ( 31 ). Рабочая кривая приемника (ROC) NLR для смертности от всех причин показала площадь под кривой (AUC) = 0,714 (95% ДИ: 0,629–0,798, P = 0,000), с критическим значением 2,97, с чувствительностью и специфичность 92,6% и 52,5% соответственно ( 31 ). Аналогичные результаты были получены в отношении NLR с резистентной HTN ( 32 ), вариабельностью АД ( 33 ) и диастолической дисфункцией у пациентов с гипертонической болезнью ( 34 ).
В последнее время ширина распределения эритроцитов (RDW) приобрела огромную популярность в качестве маркера воспаления и прогностического фактора при различных расстройствах ( 35 ). RDW является частью рутинного измерения общего анализа крови (CBC) и отражает индекс гетерогенности эритроцитов в кровообращении. Исследования показали, что он может предсказать прогноз при многих болезненных состояниях, таких как ишемическая болезнь сердца (ИБС), инсульт, сердечная недостаточность, заболевание периферических артерий и легочная артериальная HTN ( 36 ). Исследование Bilal et al. показали, что средние уровни RDW выше у пациентов с гипертонической болезнью, что подтверждает гипотезу о роли воспаления в HTN ( 36 ). Это подтверждает гипотезу, что RDW и воспаление тесно связаны, и что хроническое воспаление приводит к повышению уровня RDW. Поскольку RDW является относительно простым и легкодоступным тестом, RDW может быть полезен для ранней диагностики и выявления пациентов с более высоким риском неблагоприятных исходов от сердечно-сосудистых заболеваний.
Окислительный стресс приводит к окислительно-восстановительному дисбалансу после образования активных форм кислорода (АФК) и активных форм азота (РНС). Несколько сигнальных путей запускаются, что в конечном итоге приводит к ремоделированию артериальной стенки и артериальной жесткости ( 5 ). Кроме того, АФК участвуют в почечной гомеостатической регуляции АД, причем недавние исследования выявили вклад сайт-специфической экспрессии источников АФК, таких как никотинамид-адениндинуклеотид-фосфат-восстановленная оксидаза 5 (Nox5) в почках ( 37 ). Повышенный окислительный стресс приводит к снижению доступности оксида азота, который необходим для поддержания тонуса и стабильности сосудов.
У субъектов с EH окисленный липопротеин низкой плотности (ox-LDL) и 8-изопростангландин плазмы F2a (8-ISO PGF2a) значительно повышаются в кровообращении. Ox-LDL обладает провоспалительными, протромботическими и проапоптотическими свойствами у пациентов с повышенным окислительным стрессом, как при HTN. У субъектов с HTN и пациентов с пониженной артериальной эластичностью наблюдается повышение уровня циркулирующего быка-LDL, что свидетельствует о его роли в снижении растяжимости артерий при HTN. Это приводит к стимуляции моноцитарных инфильтратов; миграция и пролиферация клеток гладких мышц, что в конечном итоге способствует эндотелиальной дисфункции и повреждению ( 38 ). Пациенты с ЭГ также имеют повышенную перекисное окисление липидов. У таких пациентов наблюдается значительное увеличение уровней 8-ISO PGF2a в плазме. Это изомер простагландинов, образующийся в результате каталитического воздействия свободных радикалов этерифицированной арахидоновой кислоты на клеточные мембраны и липопротеины. 8-ISO PGF2a является высокочувствительным и специфическим биомаркером окислительного стресса in vivo ( 38 , 39 ). Это очень стабильный изопростан, который действует как мощный вазоконстриктор почек, а также стимулирует высвобождение эндотелина-1 в эндотелиальных клетках аорты. Исследования показали, что введение антагониста эндотелина свиньям с гипертрофической кардиомиопатией истощает 8-ISO PGF2a, снижая тем самым окислительный стресс ( 38 ). Другие биомаркеры, повышенные при окислительном стрессе, включают асимметричный диметиларгинин (ADMA), симметричный диметиларгинин (SDMA), которые, как было обнаружено, заметно повышаются в неконтролируемой HTN ( 37 ).
2.3. Биомаркеры, которые предсказывают развитие гипертонии
Открытой HTN предшествуют нарушения в нескольких биологических путях ( 38 ). Таким образом, представляется вероятным, что биомаркеры, участвующие в этих множественных нарушениях у пациентов с нормотензией или предгипертонической болезнью, могут предсказать повышенный риск развития HTN. Исследования показали, что фармакологическое лечение пациентов с предгипертонией может отсрочить наступление HTN ( 40 , 41 ). Поэтому важно выделить биомаркеры, которые могут предсказать высокий риск развития HTN. Как обсуждалось выше, поскольку подростки с избыточным содержанием мочевой кислоты, страдающие ожирением, являются молодыми, не имеют установленного сосудистого заболевания и не страдают гипертонией, предлагается, чтобы повышенное содержание мочевой кислоты могло служить биомаркером, повышающим стратификацию риска, и могло бы стать потенциальной мишенью. для терапии.
В нескольких когортах высокие уровни СРБ у нормотензивных пациентов предсказывали развитие ГТН при последующем наблюдении ( 41 - 43 ). Также повышены уровни ингибитора активатора плазминогена-1 (PAI-1), ингибитора сериновой протеазы, который является ингибитором тканевого активатора плазминогена, маркера сниженного фибринолитического потенциала и хорошо известного предиктора ЭГ. Хотя этот обзор сфокусирован на биомаркерах крови, мы должны отметить, что данные из нескольких когорт выявили, что экскреция альбумина с мочой (ОАЭ) предсказывает частоту возникновения ГБН лучше, чем СРБ и PAI-1 ( 23 ). Кроме того, высокий уровень ОАЭ, который указывает на легкое заболевание почек, также участвует в развитии HTN.Это было дополнительно проверено в исследовании Brantsma и его коллег, которые обнаружили, что риск развития HTN был самым высоким в группах с повышенным уровнем ОАЭ и низкой скоростью клубочковой фильтрации (СКФ) ( 42 ). Хорошо известно, что почечная система играет центральную роль в патогенезе HTN у пациентов с тяжелым поражением почек. Это исследование показывает, что даже люди с легким поражением почек могут подвергаться риску развития HTN.
Также имеются данные, свидетельствующие о том, что биомаркеры, такие как фибриноген, ренин, альдостерон, натрийуретический пептид типа В, N-концевой про-предсердный натрийуретический пептид, витамин D3 и гомоцистеин, связаны с развитием HTN.Гомоцистеин - это серосодержащая аминокислота, полученная из метионина в результате метаболизма метильной группы. Широко известно, что гипергомоцистеинемия играет решающую роль в развитии сердечно-сосудистых заболеваний. Существует положительная корреляция между уровнями гомоцистеина и частотой инфаркта миокарда. Было показано, что гомоцистеин негативно влияет на функцию эндотелиальных клеток, влияя на здоровье сердечно-сосудистой системы ( 44 ). Воздействие на гибель эндотелиальных клеток также может способствовать развитию гипертонии. В исследовании 500 пациентов пациенты с высокой концентрацией гомоцистеина в плазме имели отношение шансов 1,66 для развития HTN в течение десяти лет. Уровни гомоцистеина, толщина интима-медиа и СРБ были значительно выше у пациентов с гипертонической болезнью. Более того, у пациентов с гипертонической болезнью циркулирующие уровни гомоцистеина связаны с повышенной артериальной жесткостью и, следовательно, могут быть ценным биомаркером в развитии HTN ( 44 ).
В то время как у ряда этих биомаркеров значительно изменились уровни в кровообращении, отмеченные изменения часто бывают скромными. Также некоторые маркеры коррелируют друг с другом. Примером является уровень альдостерона, который повышается в HTN, но тесно коррелирует с CRP и PAI-1, так что изменение уровней альдостерона становится незначительным после коррекции на CRP и PAI-1. Таким образом, было предложено, что вместо того, чтобы рассматривать биомаркеры по отдельности, наличие «мультимаркерного балла» может предсказать HTN с лучшей чувствительностью и специфичностью ( 23 ).
3. Биомаркеры в развитии и контроле гипертонии
BP остается лучшим методом для контроля HTN, и это является основной целью всех терапевтических подходов в HTN.Независимо от патогенеза и форм HTN было установлено, что снижение АД снижает риск сердечно-сосудистых заболеваний.Мониторинг биомаркеров и нацеливание на механизмы, с помощью которых они экспрессируются, дает возможность разработать «модифицирующую болезнь терапию», что может привести к снижению или задержке заболеваемости ГТН ( 7 ).
3.1. Биомаркеры в прогрессировании заболевания
В случае прогрессирования заболевания наблюдается дальнейшая эндотелиальная дисфункция, окислительный стресс и воспаление. Таким образом, наблюдается увеличение биомаркеров, таких как CRP, PAI-1, ox-LDL, лептин, TNF-альфа, ADMA и SDMA ( 5 ). Некоторые биомаркеры экспрессируются с неизбежной или случайной дисфункцией органа-мишени, и обнаружение таких биомаркеров может помочь нам выявить и справиться с такими осложнениями. Исследование Morillas et al. обнаружили, что сывороточные уровни матриксной металлопротеиназы-1 (ММР-1) и тканевого ингибитора металлопротеиназы-1 (ТИМП-1) были выше у пациентов с ЭГ с дисфункцией органа-мишени. Повышение уровня этих биомаркеров также было связано с увеличением количества поврежденных органов ( 45 ).
Повреждение миокарда также может быть связано с прогрессированием ЭГ в направлении сердечной недостаточности. Сато и соавт. продемонстрировали, что при использовании высокочувствительного сердечного тропонина-Т в качестве биомаркера у многих пациентов с леченной ЭГ уровни были схожи с таковыми у пациентов с сердечной недостаточностью. Это исследование также показало значительную корреляцию между гипертрофией левого желудочка и тропонином Т. Высокие уровни чувствительности тропонина Т> 0,003 нг / мл независимо коррелировали с возрастом, функцией почек и напряжением ЭКГ, что указывает на гипертрофию левого желудочка ( 46 ).
3.2. Биомаркеры в контроле HTN
Обычно сложно предсказать индивидуальный ответ на гипотензивные препараты. Тем не менее, было высказано предположение, что присутствие некоторых биомаркеров могло бы помочь прогнозировать хороший ответ на лечение определенными типами гипотензивного лекарственного средства. Это может исключить практику смены лекарств пациента в случае, если АД пациента не контролируется (7).
Руководящие принципы Национального института здравоохранения и здравоохранения (NICE) в Соединенном Королевстве рассматривают возраст и этническую принадлежность как суррогат ренина и, следовательно, активность системы ренин-ангиотензин-альдостерон (РААС) (7). Следовательно, у пациентов с повышенной активностью РААС применение антигипертензивных препаратов, блокирующих РААС, скорее всего, чем контроль над их АД (47, 48). Экспериментальные исследования на животных на мышах Wang et al. показали, что ангиотензин II не регулирует экспрессию белка CXCR2, что приводит к увеличению клеток CD45 + и CXCR2 + в аорте (49). Рецептор хемокинов CXCR2 опосредует хемотаксис воспалительных клеток, но его точный механизм в патогенезе HTN в значительной степени неизвестен и требует дополнительных исследований. Однако в этом исследовании ингибирование CXCR2 привело к снижению ангиотензин-II-индуцированной дисфункции эндотелия, образованию супероксида сосудов, накоплению воспалительных клеток в стенках сосудов, экспрессии цитокинов, отложению коллагена, снижению АД и обращению HTN, вызванному повышение уровня ангиотензина-II (45). В будущем исследования о том, как это относится к человеческим субъектам, могут быть полезными в управлении ЭГ.
4. Биомаркеры повреждения органа-мишени
Учитывая уже установленную причинно-следственную связь между HTN и полученным повреждением органа-мишени, степень корреляции между уровнем АД и уровнем повреждения конечного органа не так высока, как ожидалось. Таким образом, биомаркеры являются потенциальными инструментами, которые можно использовать для реклассификации отдельных лиц, особенно с промежуточным риском в высокий или низкий риск повреждения конечного органа (50 , 51). Чтобы служить инструментом для рестратификации, биомаркер должен иметь возможность предоставлять информацию, независимую от АД и других факторов риска. Например, вариабельность АД является независимым фактором риска развития инсульта независимо от уровня АД (52).
4.1. Повреждение сердца
На ранних стадиях поражения сердца гипертрофия левого желудочка и нарушение диастолического наполнения являются субклиническими изменениями структуры и функции сердца ( 7 , 53 ). Существуют доказательства того, что гипертрофия левого желудочка является независимым фактором риска сердечно-сосудистых событий и по-разному реагирует на различные гипотензивные средства ( 1 , 54 ). Он также может быть целью фармакотерапии и в настоящее время проверяется с помощью электрокардиографии и эхокардиографии ( 54 ).
Субклиническое повышение микроальбуминурии часто наблюдается при ЭГ ( 55 ). Микроальбуминурия является важным предиктором сердечно-сосудистых событий и почечной недостаточности у пациентов с диабетом. Существует связь микроальбуминурии и развития сердечных повреждений у пациентов с гипертонической болезнью ( 56 ). Исследование, состоящее из 112 субъектов, имевших ЭГ, выявило значительную корреляцию между 24-часовым САД, ДАД и ОАЭ. Было обнаружено, что ОАЭ связаны с субклиническим снижением функции левого желудочка ( 55 ). Было обнаружено, что микроальбуминурия является маркером наличия более высоких значений АД в течение 24-часового периода. Патогенный механизм микропротеинурии при ЭГ недостаточно изучен. Предполагается, что предсердный натрийуретический фактор может играть роль медиатора гиперфильтрации. Повышенное внутригломерулярное давление и другие гемодинамические изменения в почечной системе могут быть причиной гиперфильтрации и ухудшения протеинурии. Тем не менее, микроальбуминурия может быть ранним маркером поражения сердца у пациентов с ГБ ( 55 ). Новый биомаркер; Галектин 3 (gal-3) углевод-связывающий белок, который играет важную регуляторную роль в воспалении, иммунитете и раке, повышен в HTN, и его уровни сильно коррелируют с гипертрофией левого желудочка ( 53 ). Следовательно, он может быть биомаркером субклинического повреждения сердца у вновь диагностированных пациентов с гипертонической болезнью ( 51 ). Исследования также показывают, что другой биомаркер;активность растворимого ангиотензин-превращающего фермента 2 (sACE 2) коррелирует с сердечной недостаточностью, а HTN - с неизбежной сердечной недостаточностью ( 57 ).
Уровни других маркеров, таких как BNP, сердечные тропонины и маркеры оборота коллагена, изменяются в случае повреждения сердца, которое не зависит от HTN ( 58 , 59 ). Тем не менее, измерение всех этих маркеров в настоящее время имеет мало значения, чтобы оправдать их использование в обычной клинической практике по сравнению с использованием традиционных методов скрининга, измерения АД, оценки других факторов риска, ЭКГ и ЭХО ( 7 ).
4.2. Сосудистое повреждение
Изменения в сосудистой сети, вызванные HTN, варьируются от эндотелиальной дисфункции на ранних стадиях до жесткости сосудов и атеросклеротической нагрузки ( 7 , 60 ). Ни один из биомаркеров в настоящее время не может дать полную картину патологии в структуре и функции сосудистой системы ( 5 ). Однако было обнаружено, что маркеры функции и активации эндотелиальных клеток, такие как E-селектин и фибриноген, а также маркеры воспаления, такие как CRP, коррелируют с некоторыми из этих процессов в сосудистой сети ( 5 , 61 ). Другим фактором, который может быть вовлечен в сосудистое повреждение, является фактор роста эндотелия сосудов плазмы (VEGF в плазме) ( 62 ).
Плазменный VEGF является многофункциональным пептидом, способным индуцировать рецептор-опосредованную клеточную пролиферацию и ангиогенез эндотелия ( 62 , 63 ). Была обнаружена связь между VEGF и развитием сердечно-сосудистых заболеваний. Также было показано, что VEGF и его растворимый рецептор, Flt-, часто повышаются в HTN и могут уменьшаться после лечения ( 62 ). Исследование Цай и соавт. обнаружили, что уровни VEGF были значительно выше у пациентов с гипертонической болезнью с ретинопатией по сравнению с нормотензивными пациентами. Исследование пришло к выводу, что уровни VEGF в плазме могут быть полезным маркером для выявления раннего микрососудистого повреждения в HTN ( 62 ). Концентрация цистатина-C в сыворотке крови положительно и независимо коррелирует с увеличением толщины сонной артерии у пациентов с гипертонической болезнью, которые не реагируют на лечение или имеют субклиническую сердечно-сосудистую дисфункцию ( 55 ). Традиционные методы скрининга, такие как ультразвуковое допплеровское исследование сонных артерий и ретинальная визуализация / фундоскопия, остаются методами выбора в клиническом использовании ( 64 ).
4.3. Повреждение почек
Креатинин сыворотки, СКФ и ОАЭ считаются ранними биомаркерами дисфункции почек, которые оценивают выделительную функцию почек ( 7 ). Цистатин-С в сыворотке крови, который коррелирует с СКФ, также может быть очень важен для прогнозирования риска повышения АД ( 64 ). Адреномедуллин (ADM) является маркером, который выполняет множество биологических функций, таких как вазодилатация, натрийурез, ингибирование секреции ренина, альдостерона, пролиферация и миграция клеток гладких мышц сосудов ( 65 ). В проспективном исследовании, проведенном Hu et al. концентрация в плазме ADM, ANP и BNP w первоначально измерялась у пациентов со стадией I, II и III с почечной дисфункцией или без нее. Затем их повторно измеряли через четыре недели после начала лечения гипотензивными средствами. Уровень АДМ в крови положительно коррелировал с предсердным натрийуретическим пептидом (ANP) и BNP (P <0,05). Это также коррелировало положительно с MAP и креатинином в сыворотке, но отрицательно с СКФ (P <0,05). Он увеличивается с серьезностью заболевания наряду с ANP и BNP у пациентов с EH, и его функция может заключаться в том, чтобы инициировать или увековечивать механизмы, которые противодействуют дальнейшему увеличению АД, так же как ANP и BNP. Выводится через почки. Следовательно, при почечном повреждении, возникающем как осложнение HTN, уровни ADM значительно повышены по сравнению с контролем. Циркулирующие уровни ADM, ANP и BNP улучшаются при улучшении MAP и функции почек при антигипертензивном лечении ( 65 ).
В будущем возможной терапевтической системой может быть введение адреномедуллина в ткани или стимуляция эндогенной продукции ADM, ANP и BNP для управления EH (65).
4.4. Повреждение мозга
Что касается мозга, многие исследования касаются острых цереброваскулярных событий, так как уже существует установленная сильная корреляция между неконтролируемой HTN и инсультом ( 50 ). Проводятся исследования, чтобы связать HTN с познанием ( 52 ). Тем не менее, есть доказательства корреляции между познанием и жесткостью аорты ( 66 ). Недавние результаты показали корреляцию между уровнями убиквитин-С-концевой гидролазы-L1 (UCH-L1) и поражениями белого вещества головного мозга ( 67 ). В HTN молекула адгезии сосудистых клеток-1 (VCAM-1) может предоставить информацию о мозговом кровотоке и может идентифицировать тех, кто подвергается наибольшему риску падений ( 68 ).
Несколько биомаркеров были исследованы в качестве средства прогнозирования цереброваскулярных заболеваний, вторичных по отношению к HTN, но ни один из них не был внедрен в клиническую практику из-за непомерных затрат, требований конкретной технологии ( 68 ). Специфичные для мозга белки, такие как нейрон-специфическая энолаза (NSE), являются перспективными будущими биомаркерами, которые будут более доступными и менее дорогостоящими, чтобы помочь обуздать бремя инсульта и снижения когнитивных функций (50, 68).
5. Заключение
ЭГ является основным фактором риска развития ИБС, сердечной недостаточности, инсульта, заболеваний почек и периферических сосудов. Поскольку диагностика и лечение ГТН в основном определяются традиционными показателями АД, циркулирующие биомаркеры могут оказаться полезными для понимания патогенеза, диагностики, прогрессирования и терапевтической эффективности. Изображение, показанное на рисунке 2, изображает биомаркеры, обсуждаемые в этом обзоре, и их соответствующие роли в EH. Хотя различные биомаркеры уже играют определенную роль в отношении ЭГ, большинство из них могут быть неприменимы для повседневного клинического использования по разным причинам. Они варьируются от необходимости дальнейших исследований, непомерных затрат, отсутствия технологий и недостатка опыта. Однако циркулирующие биомаркеры могут стать будущим первичной профилактики, лучшего контроля и снижения заболеваемости и смертности, связанных с HTN.

6. Литература
- Schmieder RE. End organ damage in hypertension. Deutsches Arzteblatt international 2010;107:866-73. [PubMed]
- WHO. A global brief on hypertension. World Health Organization, 2013.
- Whelton PK, Carey RM, Aronow WS, et al. ACC/AHA/AAPA/ABC/ACPM/AGS/APhA/ASH/ASPC/NMA/PCNA Guideline for the Prevention, Detection, Evaluation, and Management of High Blood Pressure in Adults: A Report of the American College of Cardiology/American Heart Association Task Force on Clinical Practice Guidelines. J Am Coll Cardiol 2017.2017. [Epub ahead of print].
- Malyszko J, Muntner P, Rysz J, et al. Blood pressure levels and stroke: J-curve phenomenon? Curr Hypertens Rep 2013;15:575-81. [Crossref] [PubMed]
- Kossaify A, Garcia A, Succar S, et al. Perspectives on the value of biomarkers in acute cardiac care and implications for strategic management. Biomark Insights 2013;8:115-26. [PubMed]
- Faselis C, Doumas M, Papademetriou V. Common secondary causes of resistant hypertension and rational for treatment. Int J Hypertens 2011;2011:236239.
- Currie G, Delles C. Use of Biomarkers in the Evaluation and Treatment of Hypertensive Patients. Curr Hypertens Rep 2016;18:54. [Crossref] [PubMed]
- Herbert A, Cruickshank JK, Laurent S, et al. Establishing reference values for central blood pressure and its amplification in a general healthy population and according to cardiovascular risk factors. Eur Heart J 2014;35:3122-33. [Crossref] [PubMed]
- Mitchell GF. Central pressure should not be used in clinical practice. Artery Res 2015;9:8-13. [Crossref] [PubMed]
- Strimbu K, Tavel JA. What are biomarkers? Curr Opin HIV AIDS 2010;5:463-6. [Crossref] [PubMed]
- Jankowski V, Vanholder R, van der Giet M, et al. Mass-spectrometric identification of a novel angiotensin peptide in human plasma. Arterioscler Thromb Vasc Biol 2007;27:297-302. [Crossref] [PubMed]
- Salem S, Jankowski V, Asare Y, et al. Identification of the Vasoconstriction-Inhibiting Factor (VIF), a Potent Endogenous Cofactor of Angiotensin II Acting on the Angiotensin II Type 2 Receptor. Circulation 2015;131:1426-34. [Crossref] [PubMed]
- Yang R, Smolders I, Vanderheyden P, et al. Pressor and renal hemodynamic effects of the novel angiotensin A peptide are angiotensin II type 1A receptor dependent. Hypertension 2011;57:956-64. [Crossref] [PubMed]
- Burger D, Schock S, Thompson CS, et al. Microparticles: biomarkers and beyond. Clin Sci (Lond) 2013;124:423-41. [Crossref] [PubMed]
- Amabile N, Cheng S, Renard JM, et al. Association of circulating endothelial microparticles with cardiometabolic risk factors in the Framingham Heart Study. Eur Heart J 2014;35:2972-9. [Crossref] [PubMed]
- Leopold JA. Chapter 2 - The Endothelium. In: Creager MA, Beckman JA, Loscalzo J, editors. Vascular Medicine: A Companion to Braunwald's Heart Disease (Second Edition). Philadelphia: W.B. Saunders, 2013:14-24.
- Rodríguez-Iturbe B, Pons H, Quiroz Y, et al. The immunological basis of hypertension. Am J Hypertens 2014;27:1327-37. [Crossref] [PubMed]
- Savoia C, Schiffrin EL. Inflammation in hypertension. Curr Opin Nephrol Hypertens 2006;15:152-8. [PubMed]
- Huang Z, Chen C, Li S, et al. Serum Markers of Endothelial Dysfunction and Inflammation Increase in Hypertension with Prediabetes Mellitus. Genetic testing and molecular biomarkers 2016;20:322-7. [Crossref] [PubMed]
- Sesso HD, Jimenez MC, Wang L, et al. Plasma Inflammatory Markers and the Risk of Developing Hypertension in Men. J Am Heart Assoc 2015;4:e001802. [Crossref] [PubMed]
- Sesso HD, Wang L, Buring JE, et al. Comparison of interleukin-6 and C-reactive protein for the risk of developing hypertension in women. Hypertension 2007;49:304-10. [Crossref] [PubMed]
- Wang CH, Li SH, Weisel RD, et al. C-reactive protein upregulates angiotensin type 1 receptors in vascular smooth muscle. Circulation 2003;107:1783-90. [Crossref] [PubMed]
- Wang TJ, Gona P, Larson MG, et al. Multiple biomarkers and the risk of incident hypertension. Hypertension 2007;49:432-8. [Crossref] [PubMed]
- Verma S, Wang CH, Li SH, et al. A self-fulfilling prophecy: C-reactive protein attenuates nitric oxide production and inhibits angiogenesis. Circulation 2002;106:913-9. [Crossref] [PubMed]
- Venugopal SK, Devaraj S, Yuhanna I, et al. Demonstration that C-reactive protein decreases eNOS expression and bioactivity in human aortic endothelial cells. Circulation 2002;106:1439-41. [Crossref] [PubMed]
- Brasier AR, Recinos A 3rd, Eledrisi MS. Vascular inflammation and the renin-angiotensin system. Arterioscler Thromb Vasc Biol 2002;22:1257-66. [Crossref] [PubMed]
- Mazzali M, Kanbay M, Segal MS, et al. Uric acid and hypertension: cause or effect? Curr Rheumatol Rep 2010;12:108-17. [Crossref] [PubMed]
- Sundström J, Sullivan L, D'Agostino RB, et al. Relations of serum uric acid to longitudinal blood pressure tracking and hypertension incidence. Hypertension 2005;45:28-33. [Crossref] [PubMed]
- Feig DI, Soletsky B, Johnson RJ. Effect of allopurinol on blood pressure of adolescents with newly diagnosed essential hypertension: a randomized trial. JAMA 2008;300:924-32. [Crossref] [PubMed]
- Liu X, Zhang Q, Wu H, et al. Blood Neutrophil to Lymphocyte Ratio as a Predictor of Hypertension. Am J Hypertens 2015;28:1339-46. [Crossref] [PubMed]
- Sun X, Luo L, Zhao X, et al. The neutrophil-to-lymphocyte ratio on admission is a good predictor for all-cause mortality in hypertensive patients over 80 years of age. BMC Cardiovasc Disord 2017;17:167. [Crossref] [PubMed]
- Belen E, Sungur A, Sungur MA, et al. Increased Neutrophil to Lymphocyte Ratio in Patients With Resistant Hypertension. Journal of clinical hypertension 2015;17:532-7. [Crossref] [PubMed]
- Kılıçaslan B, Dursun H, Kaymak S, et al. The relationship between neutrophil to lymphocyte ratio and blood pressure variability in hypertensive and normotensive subjecs. Turk Kardiyol Dern Ars 2015;43:18-24. [Crossref] [PubMed]
- Karagöz A, Vural A, Gunaydin ZY, et al. The role of neutrophil to lymphocyte ratio as a predictor of diastolic dysfunction in hypertensive patients. Eur Rev Med Pharmacol Sci 2015;19:433-40. [PubMed]
- Goyal H, Lippi G, Gjymishka A, et al. Prognostic significance of red blood cell distribution width in gastrointestinal disorders. World J Gastroenterol 2017;23:4879-91. [Crossref] [PubMed]
- Bilal A, Farooq JH, Kiani I, et al. Importance of Mean Red Cell Distribution Width in Hypertensive Patients. Cureus 2016;8:e902. [PubMed]
- Holterman CE, Thibodeau JF, Towaij C, et al. Nephropathy and elevated BP in mice with podocyte-specific NADPH oxidase 5 expression. J Am Soc Nephrol 2014;25:784-97. [Crossref] [PubMed]
- Dhawan V, Sharma I, Mahajan N, et al. Implication of Endothelin-2 and Oxidative Stress Biomarkers in Essential Hypertension. J Hypertension 2014;3:1095-2167.
- Praticò D, Iuliano L, Mauriello A, et al. Localization of distinct F2-isoprostanes in human atherosclerotic lesions. J Clin Invest 1997;100:2028-34. [Crossref] [PubMed]
- Julius S, Nesbitt SD, Egan BM, et al. Feasibility of treating prehypertension with an angiotensin-receptor blocker. N Engl J Med 2006;354:1685-97. [Crossref] [PubMed]
- Lüders S, Schrader J, Berger J, et al. The PHARAO study: prevention of hypertension with the angiotensin-converting enzyme inhibitor ramipril in patients with high-normal blood pressure: a prospective, randomized, controlled prevention trial of the German Hypertension League. J Hypertens 2008;26:1487-96. [Crossref] [PubMed]
- Brantsma AH, Bakker SJ, de Zeeuw D, et al. Extended prognostic value of urinary albumin excretion for cardiovascular events. J Am Soc Nephrol 2008;19:1785-91. [Crossref] [PubMed]
- Hage FG. C-reactive protein and hypertension. J Hum Hypertens 2014;28:410-5. [Crossref] [PubMed]
- Schalinske KL, Smazal AL. Homocysteine imbalance: a pathological metabolic marker. Adv Nutr 2012;3:755-62. [Crossref] [PubMed]
- Morillas P, Quiles J, de Andrade H, et al. Circulating biomarkers of collagen metabolism in arterial hypertension: relevance of target organ damage. J Hypertens 2013;31:1611-7. [Crossref] [PubMed]
- Sato Y, Yamamoto E, Sawa T, et al. High-sensitivity cardiac troponin T in essential hypertension. J Cardiol 2011;58:226-31. [Crossref] [PubMed]
- Williams B, MacDonald TM, Morant S, et al. Spironolactone versus placebo, bisoprolol, and doxazosin to determine the optimal treatment for drug-resistant hypertension (PATHWAY-2): a randomised, double-blind, crossover trial. Lancet 2015;386:2059-68. [Crossref] [PubMed]
- Bühler FR, Bolli P, Kiowski W, et al. Renin profiling to select antihypertensive baseline drugs. Renin inhibitors for high-renin and calcium entry blockers for low-renin patients. Am J Med 1984;77:36-42. [PubMed]
- Wang L, Zhao XC, Cui W, et al. Genetic and Pharmacologic Inhibition of the Chemokine Receptor CXCR2 Prevents Experimental Hypertension and Vascular Dysfunction. Circulation 2016;134:1353-68. [Crossref] [PubMed]
- Lewington S, Clarke R, Qizilbash N, et al. Age-specific relevance of usual blood pressure to vascular mortality: a meta-analysis of individual data for one million adults in 61 prospective studies. Lancet 2002;360:1903-13. [Crossref] [PubMed]
- Devereux RB, Pickering TG, Alderman MH, et al. Left ventricular hypertrophy in hypertension. Prevalence and relationship to pathophysiologic variables. Hypertension 1987;9:II53-60. [Crossref] [PubMed]
- Rothwell PM, Howard SC, Dolan E, et al. Prognostic significance of visit-to-visit variability, maximum systolic blood pressure, and episodic hypertension. Lancet 2010;375:895-905. [Crossref] [PubMed]
- Nar G, Aksan G, Gorgulu O, et al. Galectin-3 as a novel biomarker for the diagnosis of essential hypertension with left ventricular hypertrophy. J Exp Clin Med 2016;33:123-8.
- Levy D, Garrison RJ, Savage DD, et al. Prognostic implications of echocardiographically determined left ventricular mass in the Framingham Heart Study. N Engl J Med 1990;322:1561-6. [Crossref] [PubMed]
- Mettimano M, Specchia ML, Migneco A, et al. Microalbuminuria as a marker of cardiac damage in essential hypertension. Eur Rev Med Pharmacol Sci 2001;5:31-6. [PubMed]
- Palatini P. Microalbuminuria in hypertension. Curr Hypertens Rep 2003;5:208-14. [Crossref] [PubMed]
- Úri K, Fagyas M, Manyine Siket I, et al. New perspectives in the renin-angiotensin-aldosterone system (RAAS) IV: circulating ACE2 as a biomarker of systolic dysfunction in human hypertension and heart failure. PloS One 2014;9:e87845. [Crossref] [PubMed]
- Takeda T, Kohno M. Brain natriuretic peptide in hypertension. Hypertens Res 1995;18:259-66. [Crossref] [PubMed]
- Tanindi A, Cemri M. Troponin elevation in conditions other than acute coronary syndromes. Vasc Health Risk Manag 2011;7:597-603. [Crossref] [PubMed]
- Sypniewska G, Pollak J, Strozecki P, et al. 25-hydroxyvitamin D, biomarkers of endothelial dysfunction and subclinical organ damage in adults with hypertension. Am J Hypertens 2014;27:114-21. [Crossref] [PubMed]
- de la Sierra A, Larrousse M. Endothelial dysfunction is associated with increased levels of biomarkers in essential hypertension. J Hum Hypertens 2010;24:373-9. [Crossref] [PubMed]
- Tsai WC, Li YH, Huang YY, et al. Plasma vascular endothelial growth factor as a marker for early vascular damage in hypertension. Clin Sci (Lond) 2005;109:39-43. [Crossref] [PubMed]
- Nadar SK, Blann AD, Lip GY. Plasma and platelet-derived vascular endothelial growth factor and angiopoietin-1 in hypertension: effects of antihypertensive therapy. J Intern Med 2004;256:331-7. [Crossref] [PubMed]
- Čabarkapa V, Ilinčić B, Đerić M, et al. Cystatin C, vascular biomarkers and measured glomerular filtration rate in patients with unresponsive hypertensive phenotype: a pilot study. Ren Fail 2017;39:203-10. [Crossref] [PubMed]
- Hu W, Zhou PH, Zhang XB, et al. Plasma concentrations of adrenomedullin and natriuretic peptides in patients with essential hypertension. Exp Ther Med 2015;9:1901-8. [Crossref] [PubMed]
- Pase MP, Himali JJ, Mitchell GF, et al. Association of Aortic Stiffness With Cognition and Brain Aging in Young and Middle-Aged Adults: The Framingham Third Generation Cohort Study. Hypertension 2016;67:513-9. [PubMed]
- Li Y, Sun Y, Li J, et al. Changes of ubiquitin C-terminal hydrolase-L1 levels in serum and urine of patients with white matter lesions. J Neurol Sci 2015;357:215-21. [Crossref] [PubMed]
- González-Quevedo A, González-García S, Peña-Sánchez M, et al. Blood-Based Biomarkers Could Help Identify Subclinical Brain Damage Caused by Arterial Hypertension. MEDICC Review 2017;18:46-53.