Болезни ЖКТ
| Сайт: | Электронный информационно- образовательный портал ВолгГМУ |
| Курс: | Дисциплина Медицинская биохимия. Принципы измерительных технологий в биохимии. Патохимия, диагностика. Биохимия злокачественного роста». Часть 3 |
| Книга: | Болезни ЖКТ |
| Напечатано:: | Гость |
| Дата: | Вторник, 21 Май 2024, 05:17 |
Оглавление
- 1. Болезни пищевода
- 2. Язвенная болезнь желудка и двенадцатиперстной кишки
- 3. Helicobacter pylori (vатериал из Википедии)
- 4. Гастропанель
- 5. Парез желудка
- 6. Желудочно-кишечное кровотечение
- 7. Синдром нарушенного всасывания
- 8. Синдром раздраженной кишки
- 9. Панкреатит
- 10. Желчнокаменная болезнь
- 11. Хронические воспалительные заболевания кишечника
- 12. Дивертикулез кишечника
- 13. Болезни аноректальной области
- 14. Рвота
- 15. Понос
- 16. Запор
- 17. Лабораторные исследования кала
1. Болезни пищевода
Рефлюкс-эзофагит развивается вследствие заброса кислого содержимого желудка в пищевод при недостаточности нижнего пищеводного сфинктера, обычно в сочетании с грыжей пищеводного отверстия диафрагмы. Типичные жалобы — изжога, затрудненное глотание, боль в груди, боль в горле и охриплость голоса. Рентгенологическое и эндоскопическое исследование показано при неэффективности терапии и подозрении на инфекционный эзофагит, стриктуру пищевода, рак пищевода и желудка. Осложнения рефлюкс-эзофагита — кровотечение, цилиндроклеточная метаплазия эпителия, язва, стриктура, укорочение и рак пищевода, аспирационная пневмония и бронхоспазм
1. Подъем головного конца кровати на 10—15 см (можно положить деревянные бруски под ножки кровати или подкладку под матрас) облегчает эвакуацию желудочного содержимого из пищевода.
2. Диета. Ограничивают употребление алкоголя, шоколада, мяты, жирной пищи и кофе — все они снижают тонус нижнего пищеводного сфинктера или раздражают слизистую пищевода. При ожирении рекомендуют похудеть.
3. Курение следует прекратить.
4. Лекарственные средства, снижающие тонус нижнего пищеводного сфинктера, — теофиллин, антагонисты кальция, M-холиноблокаторы, нитраты и бета-адреноблокаторы — желательно отменить.
Б. Медикаментозное лечение обычно позволяет достичь ремиссии, однако после его прекращения, как правило, наступает рецидив. Основные задачи медикаментозного лечения — снижение кислотности желудочного содержимого (антациды, H2-блокаторы и ингибиторы H+,K+-АТФазы) и улучшение моторики ЖКТ (цизаприд, домперидон, метоклопрамид).
1. Антациды. Наиболее эффективен комбинированный препарат алюминия гидроксид/магния гидроксид. В нетяжелых случаях достаточно принимать его по 30 мл после еды и при изжоге.
2. H2-блокаторы (начальные дозы) в большинстве случаев позволяют достичь ремиссии, однако это может потребовать высоких доз и длительного (до 3 мес) лечения.
3. Ингибиторы H+,K+-АТФазы — омепразол и лансопразол — более действенные средства, чем H2-блокаторы; они быстро помогают даже при тяжелом рефлюкс-эзофагите (Arch Intern Med 155:2165, 1995). Побочные эффекты (головная боль, головокружение, тошнота и понос) встречаются редко.
4. Метоклопрамид (5—15 мг внутрь 4 раза в сутки в течение 4 нед) повышает тонус нижнего пищеводного сфинктера, улучшает перистальтику желудка и пищевода; его целесообразно сочетать со средствами, снижающими кислотность желудочного содержимого. При длительном применении возможны сонливость, психические и экстрапирамидные расстройства, галакторея и аменорея.
5. Цизаприд (10—20 мг внутрь 2—4 раза в сутки) по действию на моторику ЖКТ сходен с метоклопрамидом (его тоже применяют в сочетании со средствами, снижающими кислотность желудочного содержимого), но не влияет на ЦНС. Побочные эффекты (понос, боли в животе и головная боль) редки. При накоплении в организме цизаприд вызывает тяжелые аритмии, поэтому его нельзя применять с препаратами, замедляющими его метаболизм. К таким препаратам относятся макролиды (эритромицин и кларитромицин), производные имидазола и триазола (противогрибковые средства) и терфенадин.
В. Хирургическое вмешательство показано при безуспешности консервативного лечения, стенозе, кровотечении и других осложнениях. Операция может быть проведена эндоскопически.
Инфекционный эзофагит проявляется болью при глотании и дисфагией; как правило, он развивается при СПИДе и других иммунодефицитах, злокачественных новообразованиях и сахарном диабете. На возбудителя (обычно это Candida albicans, вирус простого герпеса или цитомегаловирус) могут указывать характерные поражения рта (молочница, герпетический стоматит), а если их нет, необходима эндоскопическая биопсия слизистой пищевода.
А. Симптоматическое лечение. Боль при глотании облегчает 2% суспензия лидокаина, 15 мл внутрь каждые 3—4 ч по мере необходимости, и суспензия сукральфата, 1 г внутрь 4 раза в сутки.
Б. Кандидозный эзофагит. В легких случаях назначают суспензию нистатина (400 000—600 000 ед внутрь каждые 6 ч) или клотримазол (таблетки для рассасывания, 10 мг каждые 6 ч), в тяжелых — кетоконазол (200—400 мг/сут внутрь в 1—2 приема) или флуконазол (100 мг внутрь 1 раз в сутки). Если эти препараты не помогают, проводят короткий курс амфотерицина B, 0,3—0,5 мг/кг/сут в/в (см. гл. 15, п. VII.Г.1).
В. Герпетический эзофагит. Больным с иммунодефицитом назначают ацикловир (5 мг/кг в/в каждые 8 ч в течение 7 сут или 800 мг внутрь 5 раз в сутки в течение 14 сут). У людей с сохранным иммунитетом эзофагит проходит без лечения через 7—10 сут.
Г. Цитомегаловирусный эзофагит. Больным с иммунодефицитом назначают ганцикловир.
Язвы пищевода развиваются при эзофагите, злокачественных новообразованиях, СПИДе и при приеме ряда лекарственных средств (препараты калия, алендронат натрия, хинидин). Лечение зависит от этиологии; язвы при СПИДе поддаются лечению кортикостероидами.
Химический эзофагит развивается при приеме доксициклина, хинидина, НПВС, препаратов калия и железа, которые оказывают прямое раздражающее действие на слизистую пищевода.
Нарушения моторики пищевода сопровождаются болью в груди или дисфагией при приеме твердой и жидкой пищи. Если рентгенография с барием или эзофагоскопия не выявляют изменений, производят пищеводную манометрию. Она выявляет спазм пищевода и позволяет воспроизвести симптомы заболевания. Лечение разработано слабо. Назначают нитраты длительного действия, антагонисты кальция и психотропные средства (антидепрессанты и транквилизаторы), такие, как тразодон, 50 мг внутрь 2—3 раза в сутки. Показана консультация гастроэнтеролога.Пищевод Барретта (синдром Барретта — Barrett’s syndrome, CELLO, ) — одно из серьёзных осложнений ГЭРБ, состояние пищевода, при котором в эпителиальной выстилке слизистой оболочки пищевода обнаруживается нехарактерный для нормы цилиндрический эпителий вместо плоского многослойного. Метаплазия клеток нижней части пищевода рассматривается, как состояние, вызванное хроническим кислотным повреждением, эзофагит, и не является очерченным заболеванием[1].
Пищевод Барретта обнаруживается примерно у 10 % пациентов, обратившихся по поводу изжоги отгастроэзофагеального рефлюкса, а в общей популяции — у 1 % населения. Он рассматривается, как предраковое состояние и ассоциируется с повышением риска частоты развития рака кардиоэзофагеальной зоны, аденокарциномы нижней трети пищевода (рака пищевода)[2].
2. Язвенная болезнь желудка и двенадцатиперстной кишки
Общие сведения. Язвенную
болезнь чаще всего вызывают Helicobacter pylori и НПВС; более редкая
причина — синдром Золлингера—Эллисона. Если нет анемии,
желудочно-кишечного кровотечения, анорексии, раннего насыщения и похудания, то
больным моложе 50 лет с первым эпизодом типичных болей назначают
эмпирическую противоязвенную терапию на 4—6 нед. Гастроскопия и другие
исследования показаны только в случае, если ремиссия не достигнута через
2 нед лечения.
А. Helicobacter pylori — грамотрицательная спиральная бактерия, способная жить в кислой среде желудка. Helicobacter pylori вырабатывает уреазу, которая расщепляет мочевину на углекислый газ и аммиак, что используется для выявления этой бактерии. Helicobacter pylori находят у 70—80% больных с язвами желудка и 90% с язвами двенадцатиперстной кишки (Am J Med Sci 306:393, 1993). Обнаружить Helicobacter pylori можно по наличию антител в крови, с помощью экспираторной пробы с 13C-мочевиной, а также при биопсии слизистой желудка с уреазной пробой и бактериологическим исследованием материала. При выявлении Helicobacter pylori показана антибактериальная терапия (см. табл. 16.2).
Б. Язва желудка. Злокачественное перерождение происходит в 5% случаев, поэтому при выявлении язвы необходима биопсия, а заживление требует рентгенологического или эндоскопического подтверждения. Если язва не заживает более 3 мес, показано хирургическое лечение.
В. Язва двенадцатиперстной кишки. Злокачественное перерождение происходит очень редко, поэтому в отсутствие жалоб заживление не требует рентгенологического или эндоскопического подтверждения.
Лечение преследует две цели: уничтожить Helicobacter pylori и снизить кислотность желудочного содержимого.
А. Антибактериальная терапия применяется при выявлении Helicobacter pylori; показано, что она ускоряет заживление язвы и предупреждает рецидивы. Уничтожить Helicobacter pylori можно только с помощью комбинации из нескольких антибиотиков (см. табл. 16.2). В большинстве схем, кроме того, используются препараты висмута. Помимо антацидного действия висмут стимулирует заживление язвы и способствует уничтожению Helicobacter pylori.
Б. H2-блокаторы (дозы — см. табл. 16.1)
1. Язва двенадцатиперстной кишки. При обострении используют циметидин, ранитидин, фамотидин и низатидин. При почечной недостаточности интервал между приемами увеличивают (см. «Фармакологический справочник», приложение Г). К парентеральному введению прибегают только при невозможности приема внутрь. В сочетании с антибактериальными средствами H2-блокаторы применяют и для профилактики рецидивов. Необходимая длительность профилактического приема точно не установлена.
2. Язва желудка. Применяют циметидин, ранитидин и фамотидин.
3. Побочное действие. H2-блокаторы переносятся хорошо. В отдельных случаях возможны головная боль, сонливость, спутанность сознания, депрессия и галлюцинации. Описаны угнетение кроветворения (тромбоцитопения, лейкопения) и гепатит. Циметидин обладает антиандрогенными свойствами и может вызвать гинекомастию и преходящую импотенцию. Кроме того, он замедляет метаболизм варфарина, теофиллина, фенитоина и других препаратов (см. «Фармакологический справочник», приложение Б).
В. Ингибиторы H+,K+-АТФазы — омепразол и лансопразол подавляют секрецию соляной кислоты слизистой желудка.
Г. Сукральфат создает на слизистой желудка пленку, защищающую ее от соляной кислоты. По эффективности не уступает H2-блокаторам и антацидам. Самое частое побочное действие — запор, который возникает в 2% случаев. Сукральфат ухудшает всасывание циметидина, дигоксина, фенитоина, фторхинолонов и тетрациклина.
Д. Антациды применяют в дополнение к основным противоязвенным средствам и только при болях: другие препараты удобнее в применении и приятнее на вкус. Жидкие формы (например, алюминия фосфат), как правило, действуют лучше таблетированных, обычно для облегчения боли достаточно 30 мл. При выборе препарата учитывают побочное действие, например препараты с высоким содержанием натрия не назначают при артериальной гипертонии, а содержащие магний — при поносе.
Е. Другие лечебные мероприятия
1. Диета не ускоряет заживление язвы. Обычно больной сам избегает продуктов, усиливающих боль.
2. Курение следует прекратить — оно тормозит заживление язвы и способствует рецидиву. (Курение способствует и развитию язвенной болезни.)
3. Аспирин и другие НПВС противопоказаны — они повреждают слизистую желудка, усиливают боли и препятствуют заживлению язвы. Если обойтись без НПВС невозможно, лучше использовать кишечно-растворимые таблетки. Токсическое действие НПВС на ЖКТ уменьшают ингибиторы H+,K+-АТФазы, H2-блокаторы и сукральфат. Еще один препарат, защищающий слизистую от повреждающего действия НПВС, — мизопростол (0,2 мг внутрь 4 раза в сутки) — длительно действующий синтетический аналог простагландина E. Препарат может вызывать боли в животе, понос и самопроизвольный аборт.
4. Алкоголь в высоких концентрациях усиливает секрецию соляной кислоты и повреждает слизистую желудка; во время обострения от него лучше отказаться. Способность алкоголя вызывать рецидив язвенной болезни не доказана.
А. Желудочно-кишечное кровотечение — см. гл. 16, пп. I—III.
Б. Стеноз привратника развивается примерно у 5% больных. Рентгенография выявляет расширение желудка с уровнем жидкости натощак. При тяжелой рвоте показано 72-часовое отсасывание содержимого желудка, восполнение потерь воды и калия, коррекция метаболического алкалоза. Если рвота рецидивирует, показана эндоскопическая или хирургическая пилоропластика.
В. Перфорация встречается редко (иногда при бессимптомном течении болезни) и обычно требует экстренной операции. При рентгенографии в положении стоя можно обнаружить свободный газ под диафрагмой.
Г. Пенетрация в поджелудочную железу чаще всего возникает, когда язва расположена на задней стенке луковицы двенадцатиперстной кишки. Первый признак пенетрации — изменение характера болей: они усиливаются, становятся постоянными, иррадиируют в спину и не снимаются антацидами. Активность амилазы сыворотки повышена. Лечение хирургическое.
Хирургическое лечение чревато тяжелыми осложнениями; благодаря появлению современных противоязвенных препаратов к нему прибегают все реже. Выбор операции определяется локализацией язвы (желудок или двенадцатиперстная кишка) и ее осложнениями.
А. Предоперационное обследование: рентгенологическое исследование, эндоскопия, определение уровня гастрина (см. гл. 16, п. XIII), выявление факторов, способствующих развитию язвенной болезни (НПВС, Helicobacter pylori, курение).
1. Боли в животе и рвота после еды могут быть вызваны рецидивом язвы, синдромом приводящей петли, желчным рефлюкс-гастритом, стенозом гастродуоденостомы и раком культи желудка.
2. Демпинг-синдром развивается вследствие ускоренного поступления пищи из желудка в тонкую кишку. Симптомы — рвота, схваткообразные боли в животе, сердцебиение, потливость, головокружение — возникают вскоре после еды. Помогает переход на шестиразовое питание малыми порциями, ограничение легкоусвояемых углеводов и жидкости; назначают M-холиноблокаторы, эфедрин и пектин. При упорном течении показан октреотид — длительно действующий аналог соматостатина. Недостаток препарата — необходимость частых инъекций.
3. Синдром нарушенного всасывания может быть обусловлен ускоренным прохождением пищи по тонкой кишке и недостаточным смешиванием кишечного содержимого с соком поджелудочной железы и желчью. Более редкая причина — избыточный рост бактерий в приводящей петле.
4. Анемия развивается из-за нарушения всасывания фолиевой кислоты, витамина B12 и железа. Может играть роль и кровопотеря, например при рецидиве язвы.
5. Понос, обычно умеренный — частое осложнение ваготомии. Исключив синдром нарушенного всасывания, проводят симптоматическое лечение.
Синдром Золлингера—Эллисона обусловлен гастриномой — гастринсекретирующей опухолью островков поджелудочной железы или двенадцатиперстной кишки; в четверти случаев это компонент МЭН типа I. Основное проявление — язва двенадцатиперстной кишки. Заподозрить синдром Золлингера—Эллисона иногда позволяют необычная локализация и большие размеры язвы, неэффективность медикаментозного лечения и рецидив после операции. В большинстве случаев, однако, язва ничем не отличается от обычной, поэтому должно насторожить и развитие язвы у человека, не принимавшего НПВС и не инфицированного Helicobacter pylori, и наличие других проявлений гастриномы — поноса и рефлюкс-эзофагита. Медикаментозное лечение заключается в применении высоких доз H2-блокаторов и ингибиторов H+,K+-АТФазы под контролем кислотности желудочного содержимого. Гастринома нередко злокачественна; если нет метастазов, хирургическое вмешательство может привести к излечению. Перед операцией проводят обследование для определения локализации и распространенности опухоли.
Неязвенная диспепсия — широко распространенный синдром, характеризующийся симптоматикой язвенной болезни в отсутствие язвы. Этиологическая роль приписывается нарушениям моторики ЖКТ, «микровоспалению», Helicobacter pylori и психическим нарушениям. Лечение не разработано. Эффективность уничтожения Helicobacter pylori не доказана (JAMA 272:65, 1994), некоторым больным помогают H2-блокаторы, другим — средства, улучшающие моторику ЖКТ (цизаприд, метоклопрамид), транквилизаторы (алпразолам, 0,25—0,5 мг внутрь 2 раза в сутки) и антидепрессанты (амитриптилин, 25—50 мг внутрь перед сном).3. Helicobacter pylori (vатериал из Википедии)
| Helicobacter pylori | ||||||||||
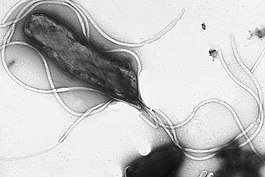 Helicobacter pylori. Микрофотография с использованием СЭМ | ||||||||||
| Научная классификация | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| Международное научное название | ||||||||||
Helicobacter pylori (Marshall et al. 1985) Goodwin et al. 1989 | ||||||||||
| ||||||||||
Helicobacter pylori (лат. спиралевидная бактерия, обитающая в привратнике желудка[1], традиционная транскрипция — Х(Г)еликоба́ктер пило́ри[1][2]) — спиралевидная грамотрицательная бактерия, котораяинфицирует различные области желудка и двенадцатиперстной кишки. Многие случаи язв желудка идвенадцатиперстной кишки, гастритов, дуоденитов, рака желудка и, возможно, некоторые случаи лимфом желудкаэтиологически связаны с инфекцией Helicobacter pylori. Однако у большинства (до 90 %[3]) инфицированных носителей Helicobacter pylori не обнаруживается никаких симптомов заболеваний[4].
Спиральная форма бактерии, от которой произошло родовое название Helicobacter, как полагают, определяет способность этого микроорганизма проникать в слизистую оболочку желудка и двенадцатиперстной кишки и облегчает движение бактерии в слизистом геле, покрывающем слизистую желудка[5].
Содержание
[скрыть]- 1История открытия
- 2Систематика
- 3Строение
- 4Геном
- 5Факторы вирулентности
- 6Патогенетические механизмы
- 7Диагностика инфекции
- 8Лечение Helicobacter pylori-ассоциированных заболеваний
- 9Критика теории решающей роли Helicobacter pylori в возникновении и развитии язвенной болезни желудка и двенадцатиперстной кишки
- 10Примечания
- 11Ссылки
История открытия[править | править вики-текст]
В 1875 году немецкие учёные обнаружили спиралевидную бактерию в слизистой оболочке желудка человека. Бактерия не росла в культуре (на известных в то время искусственных питательных средах), и это случайное открытие было забыто[6].
В 1886 году профессор Валерий Яворский из Ягеллонского университета в Кракове, исследуя осадок из промывных вод желудка человека, обнаружил помимобактерий, напоминавших по форме хворостины, также некоторое количество бактерий характерной спиралеобразной формы. Он назвал обнаруженную им бактерию Vibrio rugula. Он был первым, кто предположил возможную этиологическую роль этого микроорганизма в патогенезе заболеваний желудка. Его работа на эту тему была включена в польское «Руководство по заболеваниям желудка» и опубликована в 1899 году. Однако эта работа не имела большого влияния на остальной врачебный и научный мир, поскольку была написана на польском языке[7].
В 1893 году итальянский исследователь Джулио Бидзодзеро описал похожую спиралевидную бактерию, живущую в кислом содержимом желудка собак[8].
В 1974 году профессор И. А. Морозов из Москвы обнаружил спиралевидные бактерии в материале больных после ваготомии во внутриклеточных канальцах клеток желудка, а также у больных язвой, которым не делали ваготомию. Однако способ выращивания этих бактерий не был известен микробиологам, и обнаруженные бактерии были забыты ещё на десять лет[9][10].
Бактерия была вновь открыта в 1979 году австралийским патологом Робином Уорреном, который затем провёл дальнейшие исследования её вместе с Барри Маршаллом, начиная с 1981 года. Уоррену и Маршаллу удалось выделить и изолировать этот микроорганизм из проб слизистой оболочки желудка человека. Они также были первыми, кому удалось культивировать этот микроорганизм на искусственных питательных средах[11]. В оригинальной публикации[12] Уоррен и Маршалл высказали предположение, что большинство язв желудка и гастритов у человека вызываются инфицированием микроорганизмом Helicobacter pylori, а не стрессом или острой пищей, как предполагалось ранее[13].
Медицинское и научное сообщество медленно и неохотно признавало патогенетическую роль этой бактерии в развитии язв желудка и двенадцатиперстной кишки и гастритов, вследствие распространённого в то время убеждения, что никакой микроорганизм не в состоянии выжить сколько-нибудь длительное время в кисломсодержимом желудка. Признание научным сообществом этиологической роли этого микроба в развитии заболеваний желудка начало постепенно приходить лишь после того, как были проведены дополнительные исследования. Один из наиболее убедительных экспериментов в этой области был поставлен Барри Маршаллом: он сознательно выпил содержимое чашки Петри с культурой бактерии H. pylori, после чего у него развился гастрит[14]. Бактерия была обнаружена в слизистой его желудка, тем самым были выполнены три из четырёх постулатов Коха. Четвёртый постулат был выполнен, когда на второй эндоскопии, спустя 10 дней после преднамеренного заражения, были обнаружены признаки гастрита и присутствие H. pylori. Затем Маршалл сумел продемонстрировать, что он в состоянии излечить свой геликобактерный гастрит с помощью 14-дневного курса лечения солями висмута и метронидазолом[14]. Маршалл и Уоррен затем пошли дальше и сумели показать, что антибиотики эффективны в лечении многих, если не большинства, случаев гастрита и язв желудка и двенадцатиперстной кишки[14].
В 1994 году Национальный институт здравоохранения США опубликовал экспертное мнение, в котором утверждалось, что большинство рецидивирующих язв желудка и гастритов с повышенной кислотностью вызываются инфицированием микробом H. pylori, и рекомендовал включать антибиотики в терапевтическиережимы при лечении язвенной болезни желудка, а также гастритов с повышенной кислотностью[15]. Постепенно накапливались данные также о том, что язвы двенадцатиперстной кишки и дуодениты также ассоциированы с инфицированием H. pylori[16][17].
В 2005 году первооткрыватели медицинского значения бактерии Робин Уоррен и Барри Маршалл были удостоены Нобелевской премии по медицине[18].
До того как стала понятна роль инфекции H. pylori в развитии язвенной болезни желудка и двенадцатиперстной кишки и гастритов, язвы и гастриты обычно лечили лекарствами, которые нейтрализуют кислоту (антациды) или снижают её продукцию в желудке (ингибиторы протонного насоса, блокаторы H2-гистаминовых рецепторов, М-холинолитики и др.). Хотя такое лечение в ряде случаев бывало эффективным, язвы и гастриты весьма часто рецидивировали после прекращения лечения. Весьма часто используемым препаратом для лечения гастритов и язвенной болезни желудка и двенадцатиперстной кишки был субсалицилат висмута (пепто-бисмол). Он часто был эффективен, но вышел из употребления, поскольку его механизм действия оставался непонятным. Теперь стало ясно, что эффект пепто-бисмола был обусловлен тем, что соли висмута действуют на H. pylori как антибиотик. Сегодня большинство случаев язв желудка и двенадцатиперстной кишки, некоторых форм гастритов с доказанной лабораторными тестами геликобактерной этиологией, особенно в развитых странах, лечат антибиотиками в совокупности с ингибиторами протонной помпы, эффективными против H. pylori[19][20]. По последним уточненным данным на долю язвенной болезни, связанной с инфекцией H. pylori, приходится 38 % язв желудка и 56 % язв двенадцатиперстной кишки во всем мире[21].
Хотя H. pylori остаётся наиболее медицински значимой бактерией, способной обитать в желудке человека, у других млекопитающих и некоторых птиц были найдены другие представители рода Helicobacter. Некоторые из них могут заражать и человека. Виды рода Helicobacter были также обнаружены в печенинекоторых млекопитающих, причём они способны вызывать поражения и заболевания печени[22].
Систематика[править | править вики-текст]
Бактерия была вначале названа Campylobacter pyloridis в 1985 году, затем название было исправлено в соответствии с правилами латинской грамматики наCampylobacter pylori в 1987 году[23], и только в 1989 году, после того, как анализ последовательностей ДНК этой бактерии показал, что в действительности она не принадлежит к роду Campylobacter, её и близкие ей виды выделили в отдельный род, Helicobacter Goodwin et al. 1989[24]. Слово pylōri в названии является формой родительного падежа от «pylōrus» (привратник желудка, циркулярный жом, перекрывающий проход из желудка в двенадцатиперстную кишку), которое, в свою очередь, происходит от др.-греч. πυλωρός, означающего буквально «привратник».
Многие виды рода Helicobacter являются патогенными для человека и животных и обитают в ротовой полости, желудке, различных отделах кишечника человека и животных (патогенными для человека и животных кроме H. pylori являются также виды H. nemestrinae, H. acinonychis, H. felis, H. bizzozeronii и H. salomonis))[25]. Наибольший уровень сходства по результатам ДНК-ДНК гибридизации отмечен между видами H. pylori и H. mustelae[25].
Виды рода Helicobacter являются единственными известными на сегодняшний день микроорганизмами, способными длительно выживать в чрезвычайно кислом содержимом желудка и даже колонизировать его слизистую[26].
Разработано много методов определения как внутривидовой дифференциации штаммов H. pylori, так и для дифференцировки от других видов родаHelicobacter, такие как биотипические, и серологические методы, методы определения уреазной активности и токсинообразования, так и молекулярные — белковый электрофорез клеточного лизата, метод определения полиморфизма длин рестрикционных фрагментов (ПДРФ), полимеразная цепная реакция (ПЦР), секвенирование 16S рибосомальной РНК[25]. Показан высокий уровень внутривидового полиморфизма штаммов H. pylori по сравнению с крайне близким видом H. mustelae, проявляющим высокий уровень консерватизма. Полиморфизм заключается в однонуклеотидных заменах, а также крупных внутригеномных перестройках, и высоких частотах трансформации[25].
Типовые штаммы H. pylori: ATCC 43504, DSM 4867, JCM 7653, LMG 7539, NCTC 11637[25].
Строение[править | править вики-текст]
Helicobacter pylori — спиралевидная грамотрицательная бактерия, около 3 мкм в длину, диаметром около 0,5 мкм. Она обладает 4–6 жгутиками и способностью чрезвычайно быстро двигаться даже в густой слизи или агаре. Онамикроаэрофильна, то есть требует для своего развития наличия кислорода, но в значительно меньших концентрациях, чем содержащиеся в атмосфере.
Бактерия содержит гидрогеназу, которая может использоваться для получения энергии путём окислениямолекулярного водорода, продуцируемого другими кишечными бактериями[27]. Бактерия также вырабатывает оксидазу, каталазу и уреазу.
Helicobacter pylori обладает способностью формировать биоплёнки, способствующие невосприимчивости бактерии к антибиотикотерапии и защищающие клетки бактерий от иммунного ответа хозяина[28]. Предполагают, что это увеличивает её выживаемость в кислой и агрессивной среде желудка.
В неблагоприятных условиях, а также в «зрелых» или старых культурах Helicobacter pylori обладает способностью превращаться из спиралевидной в круглую или шарообразную кокковидную форму. Это благоприятствует её выживанию и может являться важным фактором в эпидемиологии и распространении бактерии[29]. Кокковидная форма бактерии не поддаётся культивированию на искусственных питательных средах (хотя может спонтанно возникать по мере «старения» культур), но была обнаружена в водных источниках в США и других странах. Кокковидная форма бактерии также обладает способностью к адгезии к клеткам эпителия желудка in vitro.
Кокковидные клетки отличаются деталями строения клеточной стенки (преобладанием N-ацетил-D-глюкозаминил-β(1, 4)-N-ацетилмурамил-L-Ала-D-Глюмотива в пептидогликане клеточной стенки (GM-дипептида)), изменение строения клеточной стенки приводит к неузнаванию бактерии иммунной системойхозяина (бактериальная мимикрия)[30].
Геном[править | править вики-текст]
Известно несколько штаммов Helicobacter pylori, и геном трёх из них полностью секвенирован[31][32][33][34].
Геном штамма «26695» представлен кольцевой двуцепочечной молекулой ДНК размером 1667867 пар оснований, и содержит 1630 генов, из которых 1576 кодируют белки, доля Г+Ц пар составляет 38 моль %. Геном штамма «J99» представлен кольцевой двуцепочечной молекулой ДНК размером 1643831 пар оснований, и содержит 1535 генов, из которых 1489 кодируют белки, доля Г+Ц пар составляет 39 моль %. Два изученных штамма демонстрируют значительные генетические различия, до 6 % нуклеотидов у них различны.
Изучение генома H. pylori ведётся в основном с целью улучшить наше понимание патогенеза гастритов и язвенной болезни желудка, причин способности этого микроорганизма вызывать заболевание. На данный момент в базе данных генома Helicobacter pylori 62 гена отнесены к категории «генов патогенных» (то есть их наличие у бактерии коррелирует с её патогенностью). Оба изученных штамма имеют общий «остров патогенности» (общую последовательность генов, имеющих отношение к вирулентности и патогенности H. pylori) длиной около 40 Кб, так называемый Cag. Этот участок содержит более 40 генов. Он обычно отсутствует у штаммов, которые выделены от людей, являющихся бессимптомными носителями H. pylori.
Ген cagA кодирует один из важнейших белков вирулентности H. pylori. Штаммы, имеющие ген cagA ассоциированны со способностью вызывать тяжёлые формы язвы желудка. Ген cagA кодирует белок длиной 1186 аминокислотных остатка. Белок cagA транспортируется внутрь клеток, где он нарушает нормальное функционирование цитоскелета. Остров патогенности Cag состоит из примерно 30 генов, кодирующих сложную систему секреции типа IV[35]. После адгезии H.pylori к клеткам эпителия желудка, cagA впрыскивается в клетку посредством системы секреции типа IV. Белок cagA фосфолирируетсятирозиновыми протеинкиназами клетки и взаимодействует с фосфатазой Src, изменяя морфологию клеток[36]. Вирулентные штаммы H. pylori способны активировать рецептор эпидермального фактора роста (epidermal growth factor receptor, EGFR), мембранный белок с тирозинкиназным доменом. Активация EGFR H. pylori ассоциирована с изменённой сигнальной трансдукцией и изменением профиля экспрессии генов клетки хозяина, что может влиять на течение патологического процесса[37].
Показана синергетичность действия генов babA2, cagA, и s1 vacA при патологическом процессе, вовлечённом в метаплазии кишечника[38]. Продукты геновcagA и babA2 идентифицируются иммуногистохимически, гистологически и при помощи in situ гибридизации при метаплазии кишечника и злокачественных новообразованиях желудка, ассоциированных с геликобактерной инфекцией и могут служить возможными диагностическими маркерами[39].
Также идентифицированы некоторые гены, ассоциированные со способностью к колонизации эпителия желудка, такие как flg, flh, tlp (отвечают за наличие жгутиков и хемотаксис), ureA, nixA, amiE (гены, отвечающие за синтез уреазы и продукцию аммиака), fur, pfr, fecA, frpB (гены, отвечающие за метаболизм железа), sod, hptG (ответ на стресс), и algA, rfaJ, lpxB (гены, отвечающие за биосинтез липополисахарида и экзополисахарида)[40]. Показана роль в реакцияхHelicobacter pylori на внешние раздражители продукта гена tlpD, предположительно кодирующего сенсорный белок[41].
Факторы вирулентности[править | править вики-текст]
Способность H. pylori колонизировать слизистую желудка и вызывать гастрит либо язву желудка зависит не только от состояния иммунитета организма хозяина, но и от индивидуальных особенностей конкретного штамма бактерии[42].
Одним из важных факторов вирулентности геликобактера является наличие у него жгутиков, благодаря которым обеспечивается быстрое движение микроорганизма в слое густой слизи, защищающей слизистую желудка от воздействия кислоты, её хемотаксис в места скопления других бактерий этого вида и быстрая колонизация слизистой.
Липополисахариды и белки наружной оболочки бактерии обладают свойством адгезии к наружной оболочке мембран клеток слизистой желудка. Кроме того, липополисахариды наружной оболочки H. pylori вызывают иммунный ответ организма хозяина и развитие воспаления слизистой.
Секретируемые бактерией во внешнюю среду литические ферменты — муциназа, протеаза, липаза — вызывают деполимеризацию и растворение защитной слизи (состоящей в основном из муцина) и повреждение слизистой желудка.
Очень важную роль в вирулентности бактерии и в её способности выживать в кислом содержимом желудка играет секреция бактерией уреазы — фермента, расщепляющего мочевину с образованием аммиака. Аммиак нейтрализует соляную кислоту желудка и обеспечивает бактерии локальное поддержание комфортного для неё pH (около 6–7). Одновременно с этим аммиак вызывает химическое раздражение и воспаление, а впоследствии и гибель, клеток слизистой желудка.
Продукция геликобактером различных экзотоксинов, в частности, вакуолизирующего экзотоксина (продукта гена vacA), также вызывает вакуолизацию, повреждение и гибель клеток слизистой желудка.
Специальная «инжекционная система», имеющаяся у H. pylori, предназначена для непосредственного впрыскивания в клетки слизистой оболочки желудка различных эффекторных белков (в частности, продуктов гена cagA), вызывающих воспаление, повышение продукции интерлейкина-8[43], угнетение апоптоза и избыточный рост определённых типов клеток. Полагают, что именно этим обусловлена наблюдающаяся при инфицировании геликобактером гиперплазия париетальных (кислотообразующих) клеток желудка, гиперсекреция соляной кислоты и пепсина, и в конечном итоге повышение вероятности рака желудка[44].
Штаммы H. pylori, выделенные от больных с язвой желудка или двенадцатиперстной кишки, как правило, проявляют большую биохимическую агрессивность, чем штаммы, выделенные от больных с гастритом, а штаммы, выделенные от больных с гастритом, обычно более агрессивны и вирулентны, чем штаммы, выделенные от бессимптомных носителей[42]. В частности, штаммы, выделенные от больных с язвенной болезнью, чаще бывают cagA-положительными (то есть продуцирующими cagA эффекторные белки). Штаммы, выделенные от больных с гастритом, чаще продуцируют экзотоксин vacA, чем штаммы, выделенные от бессимптомных носителей[45][46].
Патогенетические механизмы[править | править вики-текст]
На начальном этапе после попадания в желудок H. pylori, быстро двигаясь при помощи жгутиков, преодолевает защитный слой слизи и колонизирует слизистую оболочку желудка. Закрепившись на поверхности слизистой, бактерия начинает вырабатывать уреазу, благодаря чему в слизистой оболочке и слое защитной слизи поблизости от растущей колонии растёт концентрация аммиака и повышается pH. По механизму отрицательной обратной связи это вызывает повышение секрециигастрина клетками слизистой желудка и компенсаторное повышение секреции соляной кислоты ипепсина, с одновременным снижением секреции бикарбонатов.
Муциназа, протеаза и липаза, вырабатываемые бактерией, вызывают деполимеризацию и растворение защитной слизи желудка, в результате чего соляная кислота и пепсин получают непосредственный доступ к оголённой слизистой желудка и начинают её разъедать, вызывая химический ожог, воспаление и изъязвление слизистой оболочки.
Эндотоксин VacA, вырабатываемый бактерией, вызывают вакуолизацию и гибель клеток эпителия желудка[47]. Продукты гена cagA вызывают дегенерацию клеток эпителия желудка, вызывая изменения фенотипа клеток (клетки становятся удлинёнными, приобретая так называемый «колибри фенотип»[48]). Привлечённые воспалением (в частности, секрецией интерлейкина-8 клетками слизистой желудка) лейкоциты вырабатывают различные медиаторы воспаления, что приводит к прогрессированию воспаления и изъязвления слизистой, бактерия также вызывает окислительный стресс и запускает механизм программируемой клеточной смерти клеток эпителия желудка[49].
Диагностика инфекции[править | править вики-текст]
Диагностика геликобактерной инфекции обычно производится путём опроса больного на наличие диспептических жалоб и симптомов и затем выполнения тестов, подтверждающих или опровергающих наличие инфекции.
Неинвазивные (не требующие эндоскопии) тесты на наличие геликобактерной инфекции включают определение титра антител в крови к антигенам H. pylori, определение наличия антигенов H. pylori в кале, а также уреазный дыхательный тест, состоящий в том, что пациент выпивает раствор меченной углеродом 14C- или 13C мочевины, которую бактерия расщепляет с образованием, соответственно, 14C- или 13C-диоксида углерода, которую затем обнаруживают в выдыхаемом воздухе при помощи масс-спектрометрии или диодной лазерной спектроскопии.
Существуют также уреазные дыхательные тесты, основанные на определении концентрации аммиака в выдыхаемом воздухе[50]. Данные методы предполагают приём пациентом мочевины нормального изотопного состава и последующее измерение концентрации аммиака с помощью газоанализатора. К достоинствам метода можно отнести невысокую стоимость обследования, скорость получения результатов, высокую чувствительность (96 %), значительно меньшую стоимость оборудования по сравнению с масс-спектрографами. Однако этот метод диагностики не прошёл достаточные клинические испытания. Обладает высоким процентом ложноположительных результатов и не применяется за пределами постсоветского пространства.
Однако самым надёжным и «референсным» методом диагностики геликобактерной инфекции остаётся биопсия, производимая во время эндоскопического обследования желудка и двенадцатиперстной кишки. Взятую при биопсии ткань слизистой подвергают быстрому тестированию на наличие уреазы и антигенов H. pylori, гистологическому исследованию, а также культуральному исследованию с выделением возбудителя на искусственных питательных средах.
Ни один из методов диагностики инфекции не является полностью достоверным и защищённым от диагностических ошибок и неудач. В частности, результативность биопсии в диагностике геликобактерной инфекции зависит от места взятия биоптата, поэтому при эндоскопическом исследовании обязательно взятие биоптатов из разных мест слизистой желудка. Тесты на наличие антител к антигенам H. pylori имеют чувствительность всего лишь от 76 % до 84 %. Некоторые лекарства могут повлиять на активность уреазы, продуцируемой геликобактером, в результате чего при исследовании уреазной активности при помощи меченой мочевины могут получиться ложноотрицательные результаты.
Заражение H. pylori может сопровождаться симптомами или протекать бессимптомно (без каких-либо жалоб со стороны инфицированного). Предполагается, что до 70 % случаев инфекции протекают бессимптомно и что около 2/3 населения Земли инфицированы геликобактером, что делает эту инфекцию самой распространённой в мире. Истинная частота встречаемости бессимптомного носительства геликобактера варьирует от страны к стране. В развитых странах Запада (Западная Европа, США, Австралия) эта частота составляет примерно 25 %; она значительно выше в странах так называемого «третьего мира», а также в посткоммунистических странах Восточной Европы и в особенности в странах бывшего Советского Союза. В странах третьего мира и в посткоммунистических странах, вследствие сравнительно низких санитарных стандартов и условий не редкостью является обнаружение геликобактерной инфекции у детей и подростков. ВСоединённых Штатах и Западной Европе геликобактер чаще всего выявляется в старших возрастных категориях (около 50 % у лиц старше 60 лет, по сравнению с 20 % у лиц моложе 40 лет) и в наиболее бедных социально-экономических слоях.
Разница в частоте встречаемости геликобактерной инфекции в развитых странах Запада и в странах «третьего мира» приписывается более строгому соблюдению гигиенических стандартов и широкому использованию антибиотиков. Однако со временем стала проявляться проблема антибиотикоустойчивости H. pylori[51]. В настоящее время многие штаммы в Европе, США и даже в развивающихся странах уже устойчивы к метронидазолу.
Геликобактер был выделен из кала, слюны и зубного налёта инфицированных пациентов, что объясняет возможные пути передачи инфекции — фекально-оральный или орально-оральный (например, при поцелуях, пользовании общей посудой, общими столовыми приборами, общей зубной щёткой. Возможно (и весьма часто встречается) заражение геликобактером в учреждениях общественного питания. Иногда возможно заражение через инфицированные эндоскопы при проведении диагностической гастроскопии.
Считается, что в отсутствие лечения H. pylori, однажды колонизовав слизистую желудка, может существовать в течение всейжизни человека несмотря на иммунный ответ хозяина[52][53]. Однако у пожилых людей, а также у больных с давно существующим гастритом, геликобактерная инфекция, вероятно, может самостоятельно исчезать, поскольку с возрастом или с давностью заболевания гастритом слизистая желудка становится всё более атрофичной, истончённой и менее благоприятной для обитания этого микроба. Вместе с тем, атрофический гастрит у пожилых или гастрит, перешедший в стадию атрофического гастрита после многих лет болезни, поддаётся лечению гораздо труднее, чем геликобактерные гастриты.
Процент острых геликобактерных инфекций, которые переходят в хроническую персистирующую форму, точно неизвестен, однако в нескольких исследованиях, в которых изучалось естественное течение болезни без лечения в человеческих популяциях, сообщалось о возможности спонтанного самоизлечения (спонтанной элиминации микроба-возбудителя)[54][55].
Лечение Helicobacter pylori-ассоциированных заболеваний[править | править вики-текст]
У пациентов с язвой желудка, язвой двенадцатиперстной кишки, атрофическим гастритом, MALT-омой, состоянием после резекции желудка, близким родством с больными, страдающими раком желудка с доказанной геликобактерной этиологией обязательным является эрадикация Helicobacter pylori, то есть лечебный режим, направленный на полное уничтожение этого микроба в желудке[56]. В то же время, уничтожение доказанной инфекции H. pylori в отсутствие перечисленных выше заболеваний (состояний) не всегда целесообразна, так как возможный вред от приёма антибиотиков может перевесить возможную пользу от эрадикации. Некоторые источники к числу обязательных для эрадикации H. pylori заболеваний (при наличии инфекции H. pylori) относят только язвенную болезнь[3].
Австралийский гастроэнтеролог Томас Бороди в 1987 году ввёл первый известный режим «трёхкомпонентной терапии» (англ. triple therapy)[57].
Возрастающая резистентность H. pylori к «стандартным» антибиотикам, необходимость уменьшить побочные эффекты от приёма антибиотиков, а также понизить стоимость лечения стимулировали создание новых схем эрадикации. За последние десятилетия были разработаны различные варианты эрадикационной терапии, направленные на использование других антимикробных средств, а также более современных ингибиторов протонного насоса[58][59].
Отмечены случаи непродуктивности антибиотикотерапии геликобактерной инфекции, связанные как с антибиотикорезистентностью, так и с наличием зон в желудочно-кишечном тракте, в которых бактерии защищены от действия антибиотиков[60]. Отмечено появление полирезистентных к антибиотикам изолятов H. pylori[61], в том числе и кларитромицин-резистентных штаммов[62]. Также отмечены случаи появления хинолон-резистентных штаммов H. pylori[63].
Также ведутся исследования по поиску и синтезу более эффективных и менее токсичных препаратов, направленных на эрадикацию H. pylori, показана эффективность in vitro препарата TG44[64], препарат NE-2001 в опытах in vitro проявлял высокую селективность по отношению к H. pylori[65]. Показана эффективность пероральной вакцинации клеточным лизатом H. pylori на мышиной модели[66].
Маастрихтские консенсусы[править | править вики-текст]
Для выработки оптимальных подходов к диагностике и лечению Helicobacter pylori-ассоциированных заболеваний в 1987 году была создана Европейская группа по изучению Helicobacter pylori (англ. European Helicobacter Study Group) (EHSG), которая периодически публикует рекомендации, называемые Маастрихтскими консенсусами[67] или «Маастрихтами» (от названия голландского города Маастрихта, в котором были проведена первая согласительная конференция EHSG). Каждый следующий «Маастрихт» является обновлением предыдущего. Были опубликованы следующие «Маастрихты»[19]:
- «Маастрихт-I» — в 1997 году (согласительная конференция состоялась в 1996 году в Маастрихте);
- «Маастрихт-II» — в 2000 году;
- «Маастрихт-III» — в 2005 году (конференция «Маастрихт-III» состоялась в 2005 году во Флоренции);
- «Маастрихт-IV» — в 2012 году (конференция «Маастрихт-IV» состоялась в 2010 году во Флоренции)[4][68].
Однако некоторые гастроэнтерологи считают, что EHSG «монополизировала право определять стратегию и тактику анти-НР-терапии» и допускает при этом ряд просчётов, результатом которых является распространение резистентных к антимикробным средствам штаммов бактерий[67].
Критика теории решающей роли Helicobacter pylori в возникновении и развитии язвенной болезни желудка и двенадцатиперстной кишки[править | править вики-текст]
Скептически настроенные в отношении инфекционной теории язвы желудка и двенадцатиперстной кишки специалисты приводят следующие аргументы[69]:
- Ни сам Барри Маршалл, ни его последователи после самозаражения H. pylori ни разу не заболели язвенной болезнью, а только гастритом.
- Как правило, язвенные дефекты встречаются в виде одиночных образований, хотя инфекция H. pylori может затрагивать значительную часть органа.
- Инфекционная теория не объясняет цикличность заболевания: «рецидив-ремиссия-рецидив».
- Процент заражённых H. pylori при тяжёлых формах язвенной болезни значительно меньше, чем при неосложнённых. Некоторые исследователи называют такие цифры: если при неосложнённой язвенной болезни двенадцатиперстной кишки инфицированные H. pylori составляют около 95 %, инфицированныеH. pylori при неосложнённой язве желудка — 75–80 %, то при осложнённой рубцово-язвенным пилородуоденальным суб- и декомпенсированным стенозомязве, H. pylori имеются только у 50 % больных, осложнённых кровотечением — у 40 %, перфорацией — у 40–70 %.
- Инфекционная теория не объясняет сезонность обострений язвенной болезни.
- Имеются исследования, доказывающие на большом статистическом материале, что полная эрадикация H. pylori почти в два раза увеличивает вероятность развития рефлюкс-эзофагита, пищевода Баррета и кардиоэзофагеальной аденокарциномы, а также то, что наличие H. pylori в теле желудка снижает риск развития онкологических заболеваний кардиального отдела желудка[источник не указан 555 дней].
- Инфекционная теория не объясняет и не учитывает известные факты о нарушении секреции мелатонина у язвенных больных.
Отмечается, что в связи с большим числом носителей H. pylori (в России — до 75 % населения) после эрадикации отсутствуют какие-либо гарантии отсутствия реинфекции, более того, она весьма вероятна. Критики инфекционной теории обычно подходят к язвенной болезни, как к системному гастроэнтерологическому заболеванию, в развитии которого играют важнейшую роль, в том числе, психосоматические и психосоциальные факторы[69].
В последние годы было установлено, что кроме H. pylori в желудке многих здоровых людей обитают другие микроорганизмы, в частности лактобактерии L. gastricus, L. antri, L. kalixensis, L. ultunensis, стрептококки, стафилококки, грибы Candida, бактероиды, коринебактерии и другие[67].
Некоторые исследователи акцентируют внимание на следующем[70]:
- многолетнее применение антигеликобактерной терапии H. pylori-ассоциированных заболеваний не привело к их снижению и стало одной из причин развития дисбактериоза;
- рецидивы язвенной болезни и обострение хронического гастрита сопровождаются дисбиозом гастродуоденальной зоны, усиливающим язвообразование и воспалительные процессы в слизистой оболочке. При этом H. pylori не имеют самостоятельного значения в развитии этих заболеваний.
Высказывается гипотеза, что до начала эры антибиотиков H. pylori сосуществовали с человеком, не причиняя ему никакого вреда и только после начала их тотального уничтожения антибактериальными препаратами часть из них в результате мутаций приобрела резистентность к антибиотикам, а часть — «островки патогенности» содержащие гены цитотоксичности (CagA, VacA, IceA и другие), и стала угрожать здоровью человека[67].
После успешной эрадикации H. pylori через 3 года вновь заражаются этой бактерией около 32 % пациентов, через 5 лет — 82–87 %, а через 7 лет — примерно 90 %[67].
Примечания[править | править вики-текст]
- ↑ 1 2 Фадеев П.А. Язвенная Болезнь. — Первое. — Москва: ООО «Издательство «Мир и Образование», ООО «Издательство Оникс»., 2009. — С. 18-20. — 128 с. —ISBN 978-5-94666-512-4.
- ↑ Ходорковская Б. Б., Чернявский М. Н. Учебник латинского языка. — М.: «Медицина», 1964. — С. 15—18. — 351 с. — 38 000 экз.
- ↑ 1 2 Официальный сайт Британского общества гастроэнтерологов. Patient Information. Helicobacter pylori. (англ.). Перевод: Рекомендации Британского общества гастроэнтерологов пациентам в отношении Helicobacter pylori. (Проверено 12 ноября 2013)
- ↑ 1 2 Исаков В. А. Диагностика и лечение инфекции, вызванной Helicobacter pylori: IV Маастрихтское соглашение / Новые рекомендации по диагностике и лечению инфекции H.Pylori — Маастрихт IV (Флоренция). Best Clinical Practice. Русское издание. 2012. Вып.2. С.4-23. (Проверено 12 ноября 2013)
- ↑ Campylobacter and Helicobacter // Medical Microbiology / edited by Samuel Baron. — 4th edition. — Galveston: The University of Texas Medical Branch, 1996. — 1273 p. — ISBN 0-9631172-1-1.
- ↑ Blaser MJ (2005). «An Endangered Species in the Stomach». Scientific American 292 (2): 38—45. DOI:10.1038/scientificamerican0205-38. PMID 15715390.
- ↑ Konturek JW (December 2003). «Discovery by Jaworski of Helicobacter pylori and its pathogenetic role in peptic ulcer, gastritis and gastric cancer» (PDF). J. Physiol. Pharmacol. 54 (Suppl 3): 23–41. PMID 15075463. Проверено 25 August 2008.
- ↑ Bizzozero, Giulio (1893). «Ueber die schlauchförmigen Drüsen des Magendarmkanals und die Beziehungen ihres Epitheles zu dem Oberflächenepithel der Schleimhaut».Archiv für mikroskopische Anatomie 42: 82—152.
- ↑ Бактерия на миллион долларов: Маленький виновник больших проблем, «Популярная механика», март 2006.
- ↑ Mozorov, Igor A., Helicobacter pylori was discovered in Russia in 1974, in: Barry Marshall. «Helicobacter Pioneers: Firsthand Accounts from the Scientists Who Discovered Helicobacters», Victoria, Australia: Blackwell Science Asia, pp.105—118. ISBN 0-86793-035-7.
- ↑ (англ.). YouTube (01.11.2007). Проверено 4 марта 2009.
- ↑ Marshall B. J. (1983). «Unidentified curved bacilli on gastric epithelium in active chronic gastritis.». Lancet 1 (8336): 1273—1275. PMID 6134060.
- ↑ Marshall B. J., Warren J. R. (1984). «Unidentified curved bacilli in the stomach of patients with gastritis and peptic ulceration.». Lancet 1 (8390): 1311—1315. PMID 6145023.
- ↑ 1 2 3 Barry J. Marshall. Autobiography (англ.). Nobel Foundation (2005). Проверено 7 марта 2009. Архивировано из первоисточника 26 августа 2011.
- ↑ Helicobacter Pylori in Peptic Ulcer Disease (англ.). NIH Consensus Statement Online Jan 7–9;12(1):1-23. Проверено 4 марта 2009. Архивировано из первоисточника 26 августа 2011.
- ↑ Pietroiusti A., Luzzi I., Gomez M. J., Magrini A., Bergamaschi A., Forlini A., Galante A. (April 2005). «Helicobacter pylori duodenal colonization is a strong risk factor for the development of duodenal ulcer.». PMID 15801926.
- ↑ Ohkusa T., Okayasu I., Miwa H., Ohtaka K., Endo S., Sato N. Helicobacter pylori infection induces duodenitis and superficial duodenal ulcer in Mongolian gerbils // International Journal of Gastroenterology and Hepathology. — 2003. — № 52. — С. 797—803.
- ↑ The Nobel Prize in Physiology or Medicine 2005 (англ.). Nobel Foundation (2005). Проверено 5 марта 2009. Архивировано из первоисточника 25 августа 2011.
- ↑ 1 2 Официальный сайт European Helicobacter Study Group. Guidelines. (англ.)
- ↑ Edgie-Mark A. Co, Neal L. Schiller Resistance Mechanisms in an In Vitro-Selected Amoxicillin-Resistant Strain of Helicobacter pylori // Antimicrobial Agents Chemotherapy. — 2006. — Т. 50, № 12. — С. 4174—4176.
- ↑ Баранская Е. К., Ивашкин В. Т., Шептулин А. А. Гл. 4. Париет в лечении язвенной болезни, симптоматических гастродуоденальных язв и функциональной диспепсии. Стр. 75 / В кн. Профилактика и лечение хронических заболеваний верхних отделов желудочно-кишечного тракта. / Под. ред. акад. РАМН В. Т. Ивашкина. 2-е изд. — М.: МЕДпресс-информ, 2013, 152 с. ISBN 978-5-98322-905-1.
- ↑ Starzyñska T., Malfertheiner P. (2006). «Helicobacter and digestive malignancies.». Helicobacter 11 Suppl 1: 32—35. PMID 16925609.
- ↑ J.P. Euzéby. Campylobacter Sebald and Véron 1963. List of Prokaryotic names with Standing in Nomenclature. Проверено 8 марта 2009. Архивировано из первоисточника 26 августа 2011.
- ↑ Vandamme P., Falsen E., Rossau R., Hoste B., Segers P., Tytgat R.,De Ley J. [http://ijs.sgmjournals.org/cgi/reprint/41/1/88 Revision of Campylobacter, Helicobacter, and Wolinella Taxonomy: Emendation of Generic Descriptions and Proposal of Arcobacter gen. nov.] // International Journal of Systematic Bacteriology. — 1991. — Т. 41, № 1. —С. 88—103.
- ↑ 1 2 3 4 5 Volume Two, Part C: The Alpha-, Beta, Delta and Epsilonproteobacteria // Bergey's Manual of Systematic Bacteriology / Editor-in-Chief: George M. Garrity. — 2nd Edition. — New York: Springer, 2005. — Т. The Proteobacteria. — P. 1169—1189. — ISBN 0-387-95040-0.
- ↑ Dubois A. Intracellular Helicobacter pylori and Gastric Carcinogenesis: An «Old» Frontier Worth Revisiting // Gastroenterology. — 2007. — Т. 132, № 3. — С. 1177—1180.
- ↑ Olson J. W., Maier R. J. Molecular hydrogen as an energy source for Helicobacter pylori. // Science. — 2002. — Т. 298, № 5599. — С. 1788—1790.
- ↑ Stark R. M., Gerwig G. J., Pitman R. S., Potts L. F., Williams N. A., Greenman J., Weinzweig I. P., Hirst T. R., Millar M. R. Biofilm formation by Helicobacter pylori. // Letters in applied microbiology. — 1999. — Т. 28, № 2. — С. 121—126.
- ↑ Chan W. Y., Hui P. K., Leung K. M., Chow J., Kwok F., Ng C. S. Coccoid forms of Helicobacter pylori in the human stomach. // American Journal of Clinical Pathology. — 1994. — Т. 102, № 4. — С. 503—507.
- ↑ Chaput C., Ecobichon C., Cayet N., Girardin S. E., Werts C., Guadagnini S., Prévost M.-C., Mengin-Lecreulx D., Labigne A., Boneca I. G. Role of AmiA in the Morphological Transition of Helicobacter pylori and in Immune Escape // PLoS Pathogens. — 2006. — Т. 2, № 9. — С. e97..
- ↑ PyloriGene World-Wide Web Server (англ.). Institut Pasteur. — Геном H.pylori штаммов 26695 и J99. Проверено 4 марта 2009. Архивировано из первоисточника 26 августа 2011.
- ↑ Helicobacter pylori 26695, complete genome (англ.). NCBI. Проверено 4 марта 2009. Архивировано из первоисточника 26 августа 2011.
- ↑ Helicobacter pylori J99, complete genome (англ.). NCBI. Проверено 4 марта 2009. Архивировано из первоисточника 26 августа 2011.
- ↑ Helicobacter pylori HPAG1
- ↑ Couturier M. R., Tasca E., Montecucco C., Stein M. Interaction with CagF Is Required for Translocation of CagA into the Host via the Helicobacter pylori Type IV Secretion System // Infection and Immunity. — 2006. — Т. 74, № 1. — С. 273—281.
- ↑ Reyes-Leon A., Atherton J. C., Argent R. H., Puente J. L., Torres J. Heterogeneity in the Activity of Mexican Helicobacter pylori Strains in Gastric Epithelial Cells and Its Association with Diversity in the cagA Gene // Infection and Immunity. — 2007. — Т. 75, № 7. — С. 3445—3454.
- ↑ Yokoyama K., Higashi H., Ishikawa S., Fujii Y., Kondo S., Kato H., Azuma T., Wada A., Hirayama T., Aburatani H., HatakeyamaM. Functional antagonism between Helicobacter pylori CagA and vacuolating toxin VacA in control of the NFAT signaling pathway in gastric epithelial cells // Proceedings of the National Academy of Sciences of the United States of America. — 2005. — Т. 102, № 27. — С. 9661—9666.
- ↑ Zambon C.-F., Navaglia F., Basso D., Rugge M., Plebani M. Helicobacter pylori babA2, cagA, and s1 vacA genes work synergistically in causing intestinal metaplasia // Journal of Clinical Pathology. — 2003. — Т. 56, № 4. — С. 287—291.
- ↑ Semino-Mora C., Doi S. Q., Marty A., Simko V., Carlstedt I., Dubois A. Intracellular and Interstitial Expression of Helicobacter pylori Virulence Genes in Gastric Precancerous Intestinal Metaplasia and Adenocarcinoma // Journal of Infectious Diseases. — 2003. — Т. 187, № 8. — С. 1165—1177.
- ↑ Baldwin D. N., Shepherd B., Kraemer P., Hall M. K., Sycuro L. K., Pinto-Santini D. M., Salama N. R. Identification of Helicobacter pylori Genes That Contribute to Stomach Colonization // Infection and Immunity. — 2007. — Т. 75, № 2. — С. 1005—1016.
- ↑ Schweinitzer T., Mizote T., Ishikawa N., Dudnik A., Inatsu S., Schreiber S., Suerbaum S., Aizawa S.-I., Josenhans C. Functional Characterization and Mutagenesis of the Proposed Behavioral Sensor TlpD of Helicobacter pylori // Journal of Bacteriology. — 2008. — Т. 190, № 9. — С. 3244—3255.
- ↑ 1 2 Nawfal R. Hussein, Marjan Mohammadi, Yeganeh Talebkhan, Masoumeh Doraghi, Darren P. Letley, Merdan K. Muhammad, Richard H. Argent, John C. Atherton Differences in Virulence Markers between Helicobacter pylori Strains from Iraq and Those from Iran: Potential Importance of Regional Differences in H. pylori-Associated Disease // Journal of Clinical Microbiology. — 2008. — Т. 46, № 5. — С. 1774—1779.
- ↑ Beswick E. J., Pinchuk I. V., Minch K., Suarez G., Sierra J. C., Yamaoka Y., Reyes V. E. The Helicobacter pylori Urease B Subunit Binds to CD74 on Gastric Epithelial Cells and Induces NF-κB Activation and Interleukin-8 Production // Infection and Immunity. — 2006. — Т. 74, № 2. — С. 1148—1155.
- ↑ Andrzejewska J., Lee S. K., Olbermann P., Lotzing N., Katzowitsch E., Linz B., Achtman M., Kado C. I., Suerbaum S., Josenhans C. Characterization of the Pilin Ortholog of the Helicobacter pylori Type IV cag Pathogenicity Apparatus, a Surface-Associated Protein Expressed during Infection // Journal of Bacteriology. — 2006. — Т. 188, № 16. —С. 5865—5877.
- ↑ López-Vidal Y., Ponce-de-León S., Castillo-Rojas G., Barreto-Zúñiga R., Torre-Delgadillo A. High Diversity of vacA and cagA Helicobacter pylori Genotypes in Patients with and without Gastric Cancer // PLoS ONE. — 2008. — Т. 3, № 12. — С. e3849..
- ↑ Yamazaki S., Yamakawa A., Okuda T., Ohtani M., Suto H., Ito Y., Yamazaki Y., Keida Y., Higashi H., Hatakeyama M., Azuma T. Distinct Diversity of vacA, cagA, and cagE Genes of Helicobacter pylori Associated with Peptic Ulcer in Japan // Journal of Clinical Microbiology. — 2005. — Т. 43, № 8. — С. 3906—3916.
- ↑ Ivie S. E., McClain M. S., Torres V. J., Holly M. Scott Algood, Lacy D. B., Yang R., Blanke S. R., Cover T. L. Helicobacter pylori VacA Subdomain Required for Intracellular Toxin Activity and Assembly of Functional Oligomeric Complexes // Infection and Immunity. — 2008. — Т. 76, № 7. — С. 2843—2851.
- ↑ Tsutsumi R., Takahashi A., Azuma T., Higashi H., Hatakeyama M. Focal Adhesion Kinase Is a Substrate and Downstream Effector of SHP-2 Complexed with Helicobacter pylori CagA // Molecular and Cellular Biology. — 2006. — Т. 26, № 1. — С. 261—276.
- ↑ Ding S.-Z., Minohara Y., Fan X. J., Wang J., Reyes V. E., Patel J., Dirden-Kramer B., Boldogh I., Ernst P. B., Crowe S. E. Helicobacter pylori Infection Induces Oxidative Stress and Programmed Cell Death in Human Gastric Epithelial Cells // Infection and Immunity. — 2007. — Т. 75, № 8. — С. 4030—4039.
- ↑ Методы диагностики хеликобактериоза / под ред. Козлова А. В., Новиковой В. П.. — СПб.: «Диалектика», 2008. — С. 34—48. — 88 с. — ISBN 978-5-98230-044-7.
- ↑ Mégraud F. H. pylori antibiotic resistance: prevalence, importance, and advances in testing // International Journal of Gastroenterology and Hepathology. — 2004. — № 53. — С. 1374—1384.
- ↑ Holly M. Scott Algood, Timothy L. Cover Helicobacter pylori Persistence: an Overview of Interactions between H. pylori and Host Immune Defenses // Clinical Microbiology Reviews. — 2006. — Т. 19, № 4. — С. 597—613.
- ↑ Kuipers E. J., Israel D. A., Kusters J. G., Gerrits M. M., Weel J., van Der Ende A., van Der Hulst R. W., Wirth H. P., Höök-Nikanne J., Thompson S. A., Blaser M. J. Quasispecies development of Helicobacter pylori observed in paired isolates obtained years apart from the same host. // Journal of infectious diseases. — 2000. — Т. 181,№ 1. — С. 273—282.
- ↑ Goodman K. J, O'rourke K., Day R. S., Wang C., Nurgalieva Z., Phillips C. V., Aragaki C., Campos A., de la Rosa J. M. Dynamics of Helicobacter pylori infection in a US-Mexico cohort during the first two years of life. // International Journal of Epidemiology. — 2005. — Т. 34, № 6. — С. 1348—1355.
- ↑ Goodman K., Cockburn M. The role of epidemiology in understanding the health effects of Helicobacter pylori. // Epidemiology. — 2001. — Т. 12, № 2. — С. 266—271.
- ↑ Лапина Т. Л. Современное лечение язвенной болезни: новые препараты (рус.). Сателлитный симпозиум в рамках VIII Российского национального конгресса «Человек и лекарство» (5 апреля 2001 г). Проверено 13 марта 2009. Архивировано из первоисточника 26 августа 2011.
- ↑ Borody T. J., Cole P., Noonan S., Morgan A., Lenne J., Hyland L., Brandl S., Borody E. G., George L. L. Recurrence of duodenal ulcer and Campylobacter pylori infection after eradication. // The Medical journal of Australia. — 1989. — Т. 151, № 8. — С. 431—435.
- ↑ European Helicobacter Pylori Study Group. Current Concepts in the Management of Helicobacter pylori Infection (англ.). The Maastricht 2-2000 Consensus Report. Проверено 4 марта 2009. Архивировано из первоисточника 26 августа 2011.
- ↑ Mirbagheri S. A., Hasibi M., Abouzari M., Rashidi A. Triple, standard quadruple and ampicillin-sulbactam-based quadruple therapies for H. pylori eradication: a comparative three-armed randomized clinical trial. // World journal of gastroenterology. — 2006. — Т. 12, № 30. — С. 4888—4891.
- ↑ Sander J. O. Veldhuyzen van Zanten, Kolesnikow T., Leung V., Jani L. O'Rourke, Lee A. Gastric Transitional Zones, Areas where Helicobacter Treatment Fails: Results of a Treatment Trial Using the Sydney Strain Mouse Model // Antimicrobial Agents and Chemotherapy. — 2003. — Т. 47, № 7. — С. 2249—2255.
- ↑ Aboderin O. A., Abdu A. R., Odetoyin B. W., Okeke I. N., Lawal O. O., Ndububa D. A., Agbakwuru A. E., Lamikanra A. Antibiotic resistance of Helicobacter pylori from patients in Ile-Ife, South-west, Nigeria // African Health Sciences. — 2007. — Т. 7, № 3. — С. 143—147.
- ↑ Kato S., Fujimura S., Udagawa H., Shimizu T., Maisawa S., Ozawa K., Iinuma K. Antibiotic Resistance of Helicobacter pylori Strains in Japanese Children // Journal of Clinical Microbiology. — 2008. — Т. 40, № 2. — С. 649—653.
- ↑ Glocker E., Stueger H.-P., Kist M. Quinolone Resistance in Helicobacter pylori Isolates in Germany // Antimicrobial Agents and Chemotherapy. — 2007. — Т. 51, № 1. —С. 346—349.
- ↑ Kamoda O., Anzai K., Mizoguchi J., Shiojiri M., Yanagi T., Nishino T., Kamiya S. In Vitro Activity of a Novel Antimicrobial Agent, TG44, for Treatment of Helicobacter pylori Infection // Antimicrobial Agents and Chemotherapy. — 2006. — Т. 50, № 9. — С. 3062—3069.
- ↑ Dai G., Cheng N., Dong L., Muramatsu M., Xiao S., Wang M.-W., Zhu D.-X. Bactericidal and Morphological Effects of NE-2001, a Novel Synthetic Agent Directed against Helicobacter pylori // Antimicrobial Agents and Chemotherapy. — 2005. — Т. 49, № 8. — С. 3468—3473.
- ↑ Raghavan S., Svennerholm A.-M., Holmgren J. Effects of Oral Vaccination and Immunomodulation by Cholera Toxin on Experimental Helicobacter pylori Infection, Reinfection, and Gastritis // Infection and Immunity. — 2002. — Т. 70, № 8. — С. 4621—4627.
- ↑ 1 2 3 4 5 Циммерман Я. С. Нерешённые и спорные проблемы современной гастроэнтерологии. — М.: МЕДпресс-информ, 2013. — 224 с. ISBN 978-5-98322-942-6. Гл. 7. Проблема растущей резистентности микроорганизмов к антибактериальной терапии и перспективы эрадикации Helicobacter pylori-инфекции.
- ↑ Диагностика и лечение инфекции Helicobacter pylori – отчёт согласительной конференции Маастрихт IV. Флоренция // Вестник практического врача. Спецвыпуск 1. 2012. С. 6-22.
- ↑ 1 2 Крылов Н. Н. Проблемы, которые не могут не волновать: утопии и реалии современного учения о язвенной болезни. Вестник хирургической гастроэнтерологии. — 2007. — № 1. — с. 25—30.
- ↑ Чернин В. В., Бондаренко В. М., Базлов С. Н. Место H. pylori и дисбактериоза гастродуоденальной зоны в этиологии и патогенезе ЯБ и ХГ. Сб. тезисов ХХХIX сессия «Мультидисциплинарный подход к гастроэнтерологическим проблемам». 2013. 5-6 марта. С. 49-50.
Ссылки[править | править вики-текст]
- Mobley, Harry L. T.; Mendz, George L.; Hazell, Stuart L. Helicobacter pylori: Physiology and Genetics. — ASM Press, 2001. — С. 626. — ISBN 1-55581-213-9.
- Helicobacter pylori (англ.). MicrobeWiki. — The student-edited microbiology resource. Проверено 9 марта 2009. Архивировано из первоисточника 26 августа 2011.
4. Гастропанель
Комплексный анализ крови, включающий специфические белки пищеварительного тракта (гастрин-17, пепсиноген I и II) и IgG-антитела к H. pylori, который используется для неинвазивной оценки состояния слизистой оболочки желудка и скрининга атрофического гастрита.
Синонимы русские
Биомаркеры состояния слизистой желудка;
IgG-антитела к H. pylori, гастрин-17, пепсиногены 1 и 2.
Синонимы английские
GastroPanel;
H. pylori IgG, Gastrin-17, Pepsinogen I and II.
Метод исследования
Иммуноферментный анализ (ИФА).
Единицы измерения
Пмоль/л (пикомоль на литр), мкг/л (микрограмм на литр), EIU (иммуноферментная единица).
Какой биоматериал можно использовать для исследования?
Венозную кровь.
Как правильно подготовиться к исследованию?
- Не принимать пищу в течение 12 часов до исследования.
- За неделю до исследования исключить прием препаратов, влияющих на желудочную секрецию (по согласованию с врачом).
- За сутки до исследования исключить прием препаратов, нейтрализующих соляную кислоту.
- Исключить физическое и эмоциональное перенапряжение в течение 12 часов до исследования.
- Не курить в течение 3 часов до исследования.
Общая информация об исследовании
Боль в области желудка (диспепсия) является одной из самых частых причин обращения пациентов к врачу. Следует отметить, что при обследовании у большей части этих пациентов не удается выявить никаких органических заболеваний желудка (в этом случае говорят о функциональной диспепсии). С другой стороны, в некоторых случаях диспепсия может быть признаком серьезных заболеваний, в том числе атрофического гастрита, который, в свою очередь, является фактором рискарака желудка. Можно сказать, что диагностика при диспепсии направлена на то, чтобы исключить эти серьезные заболевания.
На сегодняшний день единственным методом, с помощью которого возможна точная диагностика заболеваний желудка, является гастроскопия с биопсией. Этот метод, однако, инвазивный и достаточно сложный в исполнении и не удобен в качестве скринингового теста при обследовании большого количества пациентов с диспепсией. В качестве такого скринингового теста, позволяющего точно и при этом неинвазивно получить информацию о состоянии слизистой оболочки желудка, был разработан комплексный анализ крови, который получил название «Гастропанель».
В состав «Гастропанели» входят четыре биомаркера: специфические белки пищеварительного тракта пепсиноген I и II, гастрин-17 и антитела класса IgG к H. pylori.
Пепсиноген является неактивным предшественником фермента пепсина и существует в двух биохимически и иммунологически различных вариантах – пепсиноген I и II. Пепсиноген Iсекретируется только клетками желез тела желудка и поэтому является специфическим индикатором состояния слизистой оболочки тела желудка. Секреция пепсиногена II происходит в клетках желез тела, кардиального и пилорического отделов желудка, а также в бруннеровых железах двенадцатиперстной кишки. В норме небольшое количество пепсиногена I и II поступает в кровь и может быть измерено. При атрофическом гастрите тела желудка количество париетальных клеток, секретирующих соляную кислоту, снижается. При этом также уменьшается концентрация пепсиногена Iв крови. Считается, что снижение соотношения пепсиноген I / пепсиноген II более точно отражает степень тяжести и распространения атрофического гастрита тела желудка.
Гастрин – это гормон пищеварительного тракта, необходимый для нормального процесса пищеварения. Он стимулирует выработку соляной кислоты и пепсина специализированными клетками желудка и увеличивает моторику пищеварительного тракта. Гастрин-17 – одна из разновидностей гастрина, синтезируется преимущественно G-клетками антрального отдела желудка и поэтому является специфическим индикатором состояния слизистой оболочки антрального отдела желудка. Некоторое количество гастрина всасывается в кровь и может быть измерено. При атрофическом гастрите антрального отдела желудка снижается количество G-клеток, а также концентрация гастрина-17 в крови.
Примерно у половины пациентов с инфекцией H. pylori на определенном этапе возникает атрофический гастрит, причем у 10 % инфицированных он принимает тяжелое или средней тяжести течение и у 2,5-5 % может возникнуть рак желудка. Поэтому идентификация H. pylori – это неотъемлемая часть скрининга атрофического гастрита и рака желудка. Для идентификации H. pylori в состав «Гастропанели» был включен тест на IgG-антитела к этому микроорганизму, который имеет ряд преимуществ по сравнению с другими методами определения H. pylori. Во-первых, IgG-антитела к H. pylori могут быть обнаружены у 95-100 % пациентов с геликобактериозом, что позволяет считать этот серологический тест одним из самых чувствительных тестов для диагностики этого состояния. Высокая чувствительность теста означает, что отрицательный результат позволяет практически исключить наличие геликобактериоза. Во-вторых, в отличие от уреазного дыхательного теста или определения антигена H. pyloriв кале, на результат серологических тестов не влияет степень колонизации слизистой оболочки микроорганизмом, наличие кровоточащей язвы, атрофического гастрита, ахлоргидрии желудка на фоне приема ингибиторов протонной помпы и применение антибиотиков.
Совместное измерение концентраций этих четырех биомаркеров позволяет произвести косвенную оценку состояния слизистой желудка и выработать дальнейший план действий. На основании результатов «Гастропанели» всех пациентов с диспепсией можно разделить на три группы:
- Пациенты с нормальной слизистой оболочкой желудка: IgG-антитела к H. pylori – отрицательный результат, пепсиноген I и II и гастрин-17 – в пределах нормы. При этом риск серьезных заболеваний желудка (рака желудка и язвы желудка) очень низкий. Гастроскопия не показана. Две трети пациентов с диспепсией относятся именно к этой группе.
- Пациенты с геликобактериозом без атрофического гастрита: IgG-антитела к H. pylori – положительный результат, пепсиноген I и II и гастрин-17 – в пределах нормы. Такой результат исследования свидетельствует о наличии хронического неатрофического (поверхностного, гиперацидного) H.pylori-ассоциированного гастрита. Риск рака желудка низкий, но все же существует. Риск язвы желудка или двенадцатиперстной кишки повышен. Вопрос о гастроскопии решается в индивидуальном порядке. Также может быть рекомендована антибиотикотерапия против H. pylori.
- Пациенты с атрофическим гастритом. Детальный анализ результата теста позволит определить, какой отдел желудка поражен.
- Пепсиноген I и соотношение пепсиноген I / пепсиноген II – снижены, гастрин-17 – повышен, IgG-антитела к H. pylori– отрицательный или положительный результат. Такой результат свидетельствует об атрофическом гастрите тела желудка. Риск рака желудка, а также дефицита витамина B12, кальция и железа существенно повышен. Рекомендуется проведение гастроскопии.
- Пепсиноген Iи соотношение пепсиноген I / пепсиноген II – в пределах нормы, гастрин-17 – снижен, IgG-антитела к H. pylori – положительный результат. Такой результат свидетельствует об атрофическом гастрите антрального отдела желудка. Риск рака желудка повышен. Рекомендуется проведение гастроскопии. Также может быть назначена антибиотикотерапия против H. pylori.
- Пепсиноген I и соотношение пепсиноген I / пепсиноген II– снижены, гастрин-17 – снижен, IgG-антитела к H. pylori – положительный результат. Такой результат свидетельствует об атрофическом пангастрите – состоянии, которое является самым значимым фактором риска рака желудка. Рекомендуется проведение гастроскопии. Также может быть назначена антибиотикотерапия против H. pylori.
В третью группу относится всего лишь 2,5 % пациентов с диспепсией, однако именно эти пациенты как раз и нуждаются в наиболее тщательном обследовании и наблюдении.
«Гастропанель» особенно удобна в условиях оказания медицинской помощи терапевтами или врачами общей практики. Этот комплексный анализ позволяет выявить пациентов с диспепсией с н
Что означают результаты?
Референсные значения
- Гастрин 17: 1 - 10 пмоль/л.
- Пепсиноген I: 30 - 165 мкг/л.
- Пепсиноген II: 3 - 15 мкг/л.
- Антитела (Ig G) к Helicobacter pylori: 0,0 - 29,9 EIU.
Норма | IgG-антитела к H. pylori – отрицательный результат, пепсиноген I и II и гастрин-17 – в пределах нормы |
Хронический неатрофический (поверхностный, гиперацидный) H.pylori-ассоциированный гастрит | IgG-антитела к H. pylori – положительный результат, пепсиноген I и II и гастрин-17 – в пределах нормы |
Атрофический гастрит тела желудка
| Пепсиноген I и соотношение пепсиногенI / пепсиноген II – снижены, гастрин-17 – повышен, IgG-антитела к H. pylori– отрицательный или положительный результат |
Атрофический гастрит антрального отдела желудка
| Пепсиноген I и соотношение пепсиногенI / пепсиноген II – в пределах нормы, гастрин-17 – снижен, IgG-антитела к H. pylori – положительный результат |
Атрофический пангастрит | Пепсиноген I и соотношение пепсиногенI / пепсиноген II – снижены, гастрин-17 – снижен, IgG-антитела к H. pylori – положительный результат |
Что может влиять на результат?
- Применение ингибиторов протонной помпы приводят к увеличению концентрации гастрина-17 в 2-5 раз, при длительном их применении также наблюдается 2-кратное увеличение концентрации пепсиногенов I и II.
Важные замечания
- «Гастропанель» – это косвенный метод оценки состояния слизистой желудка, который не может полностью заменить гастроскопию.
Также рекомендуется
- Гистологическое исследование биоптатов органов и тканей (за исключением печени, почек, предстательной железы, лимфатических узлов)
Helicobacter pylori, антиген - Helicobacter pylori, ДНК [реал-тайм ПЦР]
Кто назначает исследование?
Терапевт, врач общей практики, гастроэнтеролог.
- Iijima K, Abe Y, Kikuchi R, Koike T, Ohara S, Sipponen P, Shimosegawa T. Serum biomarker tests are useful in delineating between patients with gastric atrophy and normal, healthy stomach. World J Gastroenterol. 2009 Feb 21;15(7):853-9.
- Agréus L, Kuipers EJ, Kupcinskas L, Malfertheiner P, Di Mario F, Leja M, Mahachai V, Yaron N, van Oijen M, Perez Perez G, Rugge M, Ronkainen J, Salaspuro M, Sipponen P, Sugano K, Sung J. Rationale in diagnosis and screening of atrophic gastritis with stomach-specific plasma biomarkers. Scand J Gastroenterol. 2012 Feb;47(2):136-47. doi: 10.3109/00365521.2011.645501.
5. Парез желудка
Этиология. Острый парез желудка развивается при различных заболеваниях и метаболических нарушениях (гипокалиемия, гипер- и гипокальциемия, гипергликемия), а также под действием лекарственных средств (трициклические антидепрессанты, наркотические анальгетики, M-холиноблокаторы). Хронический парез желудка встречается как сам по себе, так и при сахарном диабете, после ваготомии, при системной склеродермии и других заболеваниях; лечение его часто безуспешно. Во всех случаях следует исключить обструкцию ЖКТ.Диагностика. Характерны тошнота, рвота, раннее насыщение и чувство распирания в животе. Диагноз можно подтвердить изотопным исследованием: больной съедает стандартный завтрак с 99mTc, за удалением изотопа из желудка следят с помощью гамма-камеры.
Лечение. Следует избегать жирной пищи и продуктов, богатых клетчаткой. В тяжелых случаях назначают высококалорийную жидкую изоосмотическую диету и препараты, улучшающие моторику ЖКТ, — цизаприд (10—20 мг внутрь за 20 мин до еды и на ночь), домперидон (10—20 мг внутрь за 20 мин до еды и на ночь) или метоклопрамид (10 мг каждые 6 ч). Метоклопрамид может вызывать сонливость и экстрапирамидные расстройства. Иногда применяют эритромицин (250 мг внутрь 3 раза в сутки), однако его эффективность не доказана. Эритромицин никогда не назначают совместно с цизапридом.
6. Желудочно-кишечное кровотечение
Первоочередные задачи — стабилизация состояния,
борьба с гиповолемией. Неблагоприятные прогностические факторы: 1) возраст
старше 60 лет, 2) наличие не менее двух сопутствующих
заболеваний, 3) кровопотеря > 2 л, 4) шок,
5) коагулопатия, 6) рвота алой кровью и артериальная гипотония,
7) язва диаметром > 2 см, 8) рецидив кровотечения в
первые 72 ч, 9) экстренная операция.
I. Основные положения. Тактика определяется тяжестью состояния, его оценивают в первую очередь.
1. Диагностика. Признаки критического состояния — спутанность сознания, заторможенность, обильный липкий пот, бледность и мраморность кожи. В таких случаях лечение начинают немедленно, не дожидаясь окончания обследования.
а. Оценка гемодинамики проводится немедленно. Резкое учащение пульса и падение АД могут быть единственными ранними признаками повторного кровотечения. При оценке гемодинамических показателей следует учитывать влияние лекарственных средств и сопутствующих заболеваний. Так, бета-адреноблокаторы уменьшают ЧСС, а для вегетативной нейропатии характерна артериальная гипотония. Ортостатическая гипотония (при переходе из положения лежа в положение стоя систолическое АД снижается более чем на 10 мм рт. ст.) говорит о потере 10—20% ОЦК. Артериальная гипотония в положении лежа — признак кровопотери свыше 20% ОЦК. Дальнейшая кровопотеря ведет к шоку. Признаки продолжающегося кровотечения (рвота кровью или кофейной гущей, мелена или алая кровь в кале, быстрое снижение АД) — показание к срочному восполнению ОЦК.
б. Лабораторная диагностика. Проводят общий и биохимический анализ крови, определяют ПВ, АЧТВ, группу крови и Rh-фактор; кровь, заготовленную для переливания, проверяют на индивидуальную совместимость. На уровень гемоглобина и гематокрит в первые часы ориентироваться нельзя: они снижаются только после начала восстановления ОЦК.
а. Восполнение ОЦК начинают немедленно. В две крупные периферические вены устанавливают катетеры большого диаметра (14—18 G). Катетеризация центральной вены не дает преимуществ, но может задержать начало инфузионной терапии. Вводят физиологический раствор, раствор Рингера с лактатом или гетастарч; при шоке по возможности переливают кровь. Сосудосуживающие средства в большинстве случаев бесполезны. Скорость введения жидкости определяется состоянием больного, объемом и интенсивностью кровотечения. При шоке растворы и кровь иногда вводят под давлением специальным насосом или большим шприцем. Службу переливания крови извещают о необходимости в препаратах крови. Наготове должно быть по меньшей мере 6 доз крови, проверенной на индивидуальную совместимость. В исключительных случаях переливают Rh-отрицательную кровь 0(I) группы, проводят одновременную инфузию в несколько вен, вводят сосудосуживающие средства.
б. Переливание препаратов крови начинают сразу же, как только станет ясно, что кровотечение интенсивное и введение обычных растворов не может обеспечить достаточную оксигенацию тканей. Эритроцитарную массу переливают до стабилизации гемодинамики и повышения гематокрита до 25% (при сердечно-сосудистых и легочных заболеваниях — до 30%). При коагулопатиях переливают свежезамороженную плазму; начинают с 4 доз, в дальнейшем ориентируются по клинической картине. При тромбоцитопении (< 50 000 мкл–1) переливают тромбоцитарную массу;
в. Интубация трахеи для предупреждения аспирации показана при нарушениях сознания (шок, печеночная энцефалопатия), обильной рвоте кровью, сильном кровотечении из варикозных вен пищевода.
г. Консультация гастроэнтеролога, хирурга и специалиста по эндоваскулярным методам лечения показана при сильном кровотечении и отсутствии улучшения состояния.
Б. Удовлетворительное состояние
1. Анамнез позволяет различить кровотечение из верхнего и нижнего отделов ЖКТ. (К верхнему отделу относятся пищевод, желудок и двенадцатиперстная кишка, к нижнему — остальной кишечник.) Рвота кровью почти всегда указывает на кровотечение из верхнего отдела ЖКТ (она возможна также при кровотечении из носоглотки). Боль может указывать на источник кровотечения. Другие важные моменты: 1) кровотечения в прошлом, 2) употребление алкоголя, 3) болезни печени, 4) кровоточивость, 5) болезни ЖКТ, 6) операции на органах брюшной полости, 7) травмы, 8) операции на аорте, 9) прием кортикостероидов и НПВС.
2. Физикальное исследование позволяет выявить признаки портальной гипертензии (спленомегалия, асцит, расширение вен передней брюшной стенки), злокачественной опухоли, сосудистых аномалий. Пальцевое ректальное исследование выявляет опухоли и геморроидальные узлы. Много информации дает осмотр кала. Мелена (черный вязкий кал с характерным запахом) указывает на кровотечение выше слепой кишки. Темно-красный кал — признак кровотечения из дистального отдела тонкой кишки или правой половины ободочной кишки. Алая кровь в кале при стабильной гемодинамике говорит о кровотечении из прямой кишки или левой половины ободочной кишки. Реже алая кровь в кале появляется при интенсивном кровотечении из верхних отделов ЖКТ.
а. Общий анализ крови. Хотя уровень гемоглобина и гематокрит снижаются не сразу, их определяют, чтобы следить за динамикой состояния и эффективностью переливаний крови. При продолжающемся кровотечении необходимы частые (например, каждые 6 ч) повторные определения гематокрита. После переливания одной дозы эритроцитарной массы гематокрит должен возрастать на 3%. При кровотечении снижение числа тромбоцитов < 50 000 мкл–1 — показание к переливанию тромбоцитарной массы (см. гл. 18, п. VI).
б. ПВ и АЧТВ. При кровотечении повышение этих показателей служит показанием к переливанию свежезамороженной плазмы (см. гл. 18, п. IX). Иногда, если кровотечение небольшое, повышение ПВ можно скорректировать витамином K (фитоменадион, 10 мг/сут п/к в течение 3 сут).
в. Исследование желудочного содержимого. Кровь в желудочном содержимом считают обнаруженной только в том случае, если она ясно видна или если получена «кофейная гуща» с резко положительной реакцией на скрытую кровь. Наличие крови указывает на кровотечение из верхнего отдела ЖКТ, но ее отсутствие не исключает кровотечения. При подозрении на массивное кровотечение из верхнего отдела ЖКТ у больного с примесью крови в кале назогастральный зонд оставляют в желудке.
4. Промывание желудка водой или физиологическим раствором комнатной температуры проводят для удаления крови и сгустков перед эндоскопией и для оценки интенсивности кровотечения. Если кишечник проходим и нет сильной тошноты и рвоты, оставлять зонд в желудке нет необходимости: повторное кровотечение можно обнаружить по гематокриту и показателям гемодинамики.
6.1. Кровотечение из верхнего отдела ЖКТ
Кровотечение из верхнего отдела ЖКТ (пищевод, желудок и двенадцатиперстная кишка)
А. Диагностика. Самые частые причины — язвы желудка и двенадцатиперстной кишки, эрозии желудка, варикозное расширение вен пищевода и синдром Меллори—Вейсса. Другие причины — эзофагит, ангиодисплазия, опухоль, аортокишечный свищ. Тактика определяется общим состоянием больного, скоростью кровопотери, оснащенностью клиники и опытом врача. Диагностические процедуры не должны прерывать наблюдение за общим состоянием и лечение.
1. Гастроскопия — лучший метод диагностики. Она проводится у постели больного, позволяет точно определить источник кровотечения, редко дает осложнения и может использоваться как лечебный метод. Гастроскопию проводят как можно раньше (желательно в первые 24 ч): хотя это не снижает летальности, но уменьшает потребность в переливаниях крови и продолжительность госпитализации и зачастую позволяет обойтись без операции (N Engl J Med 325:1142, 1991). Гастроскопия показана для точного определения источника кровотечения перед такими опасными вмешательствами, как, например, баллонная тампонада пищевода.
2. Катетеризация ветвей брюшной аорты позволяет провести селективную артериографию, выявить источник кровотечения (если скорость кровотечения превышает 0,5 мл/мин) и сразу перейти к эндоваскулярным методам лечения.
3. Рентгенография желудка имеет смысл только при невозможности провести гастроскопию. Позволяя выявить участки повреждения слизистой, рентгенография не дает ответа на вопрос, являются ли они источником кровотечения. Кроме того, барий мешает гастроскопии и ангиографии.
Б. Лечение при отдельных заболеваниях. В 85% случаев кровотечение останавливается самостоятельно, однако консультация хирурга показана всем больным: определить заранее, кому именно понадобится операция, невозможно.
1. Язвенная болезнь — самая частая причина кровотечений из верхнего отдела ЖКТ.
а. Эндоскопия позволяет проводить лечение одновременно с диагностикой.
б. Хирургическое лечение применяют при упорном и рецидивирующем кровотечении. Показания: 1) тяжелое кровотечение, требующее постоянных переливаний крови (> 5 доз в сутки), 2) возобновление кровотечения после консервативного лечения, 3) нехватка крови для переливаний. Тяжесть общего состояния и нестабильность гемодинамики играют большую роль, чем число перелитых доз.
в. Эндоваскулярные методы лечения применяют, если кровотечение тяжелое, а операция слишком рискованна. Их может проводить только специалист высокой квалификации.
1) Внутриартериальное введение вазопрессина, 0,15—0,2 ед/мин, часто останавливает кровотечение из язвы или эрозии желудка (при язвенной болезни и стрессовых язвах). Вазопрессин вводят через катетер, установленный в кровоточащей артерии. Дозу подбирают так, чтобы остановить кровотечение, сведя к минимуму побочные эффекты.
2) Эмболизация артерии тоже требует селективной катетеризации. В сосуд вводят желатиновую губку, металлические спирали и другие приспособления. Успех зависит от локализации и характера поражения. Осложнения чаще бывают у больных, перенесших операции на желудке, и при системных васкулитах.
г. Медикаментозное лечение показано, когда лечебная гастроскопия недоступна. Показано, что омепразол (40 мг внутрь 2 раза в сутки) уменьшает вероятность рецидива и иногда позволяет избежать операции (N Engl J Med 336:1054, 1997).
2. Кровотечение из варикозных вен пищевода нередко заканчивается смертью. Показана госпитализация в реанимационное отделение и интубация трахеи для предупреждения аспирации крови. Как только состояние стабилизируется, проводят диагностическую эндоскопию. Если диагноз подтвердился, немедленно переходят к лечению (Semin Liver Dis 13:328, 1993).
а. Эндоскопическое лечение непосредственно продолжает диагностическую эндоскопию.
1) Склеротерапия обычно останавливает кровотечение из варикозных вен пищевода и желудка, однако в половине случаев оно рецидивирует. Нередки и осложнения: язвы, стриктуры и перфорации пищевода, плевральный выпот и РДСВ. Лихорадка в первые 48 ч после процедуры отмечается у 40% больных; если она держится дольше, необходимо исключить сепсис. Склеротерапию используют и профилактически, при некровоточащих варикозных венах пищевода (но не желудка).
2) Перевязка варикозных вен останавливает кровотечение не хуже, чем склеротерапия, а рецидивы и осложнения после нее возникают реже (Ann Intern Med 123:280, 1995). Из осложнений встречаются эрозии и стриктуры пищевода, дисфагия и непродолжительная боль в груди.
б. Медикаментозное лечение. Основное достоинство медикаментозного лечения — простота применения. Результаты его, по сравнению с эндоскопическим лечением, хуже.
1) Октреотид (длительно действующий синтетический аналог соматостатина) способствует остановке кровотечения, снижая давление в воротной системе печени. По эффективности он не уступает вазопрессину, но дает меньше осложнений (Gastroenterology 109:1289, 1995). Вначале вводят 50—100 мкг в/в струйно, затем начинают в/в инфузию со скоростью 25—50 мкг/ч.
2) Вазопрессин до последнего времени использовали наиболее часто. 100 ед растворяют в 250 мл 5% глюкозы и вводят в/в. Начальная доза 0,3 ед/мин; каждые 30 мин дозу повышают на 0,3 ед/мин, максимальная доза — 0,9 ед/мин. После остановки кровотечения дозу постепенно снижают. Осложнения включают инфаркт миокарда, желудочковые аритмии, остановку кровообращения, инфаркт кишечника, ишемический некроз кожи. Вазопрессин вводят в реанимационном отделении под контролем ЭКГ. При появлении аритмии, болей в груди и животе введение замедляют или прекращают. Особая осторожность нужна при ИБС и атеросклеротическом поражении других сосудов. Нитроглицерин снижает риск побочного действия и повышает эффективность вазопрессина (Hepatology 6:410, 1986). Начальная доза — 10 мкг/мин в/в; каждые 10 мин дозу повышают на 10 мкг/мин, пока систолическое АД не снизится до 100 мм рт. ст.; максимальная доза — 400 мкг/мин. При систолическом АД < 100 мм рт. ст. нитроглицерин не применяют.
в. Баллонная тампонада позволяет временно остановить кровотечение сдавлением кровоточащего узла. Метод довольно опасен и может применяться только опытным специалистом. Зонд для баллонной тампонады может иметь желудочный и пищеводный (зонд Сенгстейкена—Блейкмора) или только желудочный (зонд Линтона) баллон. Поскольку выбор зонда зависит от места кровотечения, предварительно проводят гастроскопию. При кровотечении из варикозных вен желудка предпочтение отдают зонду Линтона.
Установка зонда проводится в реанимационном отделении. Для предупреждения асфиксии интубируют трахею. Если зонд Сенгстейкена—Блейкмора не имеет канала для отсасывания из пищевода, к нему присоединяют назогастральный зонд; его конец должен располагаться над пищеводным баллоном. Этот зонд четко помечают, чтобы случайно не использовать для промывания желудка. Перед раздуванием желудочного баллона проводят рентгенографию, чтобы убедиться, что он находится в желудке: раздувание желудочного баллона в пищеводе может привести к разрыву пищевода. К наружному концу зонда подвешивают груз. Слишком тяжелый груз и сильно раздутый баллон могут вызвать язвы и некроз слизистой. Давление в баллоне время от времени ненадолго снижают. После остановки кровотечения зонд оставляют в желудке еще на 24 ч. Рядом с кроватью должны быть ножницы для рассечения и экстренного удаления зонда в случае необходимости.
г. Портокавальное шунтирование останавливает кровотечение в 95% случаев, однако из-за высокой послеоперационной летальности и частого развития печеночной энцефалопатии оно применяется только при неэффективности других методов. Риск операции оправдан только при достаточно сохранной функции печени (класс A по Чайлду, см. гл. 17, п. XXX), в этой группе больных шунтирование проводят по следующим показаниям: 1) неэффективность эндоскопического и медикаментозного лечения, 2) невозможность наблюдать больного после выписки, 3) высокий риск смерти от повторного кровотечения (болезни сердца, нехватка препаратов крови). При тяжелом поражении печени (класс C по Чайлду) больной вряд ли сможет пережить шунтирование, кроме того, оно затрудняет трансплантацию печени в дальнейшем. У таких больных применяют другие методы, например резекцию кровоточащего участка пищевода.
д. Трансюгулярное внутрипеченочное портокавальное шунтирование — эндоваскулярный метод наложения шунта между воротной и полой веной. Операция достаточно эффективна, хорошо переносится и не мешает трансплантации печени. Печеночная энцефалопатия развивается в 25% случаев, но выражена умеренно и поддается медикаментозному лечению. За проходимостью шунта следят с помощью дуплексного УЗИ.
е. Медикаментозное лечение портальной гипертензии. Показано, что бета-адреноблокаторы уменьшают портальную гипертензию. Пропранолол и надолол в дозе, уменьшающей ЧСС на 25%, предупреждают первичные и повторные кровотечения, хотя и не влияют на выживаемость (Ann Intern Med 117:59, 1992). Сочетание надолола с изосорбида мононитратом предупреждает повторное кровотечение лучше, чем склеротерапия (N Engl J Med 334:1624, 1996).
ж. Трансплантация печени в случае успеха устраняет портальную гипертензию и кровотечения из варикозных вен пищевода и желудка.
3. Синдром Меллори—Вейсса — это разрыв слизистой в месте перехода пищевода в желудок при тяжелой, многократной рвоте, позывах на рвоту или сильном кашле. В большинстве случаев кровотечение останавливается самостоятельно и редко возобновляется. Иногда требуется эндоскопическое и эндоваскулярное вмешательство.
4. Аортокишечный свищ — редкое, но крайне опасное состояние. Как правило, это позднее осложнение протезирования аорты. Свищ (обычно аортодуоденальный) возникает через несколько лет, реже месяцев, после операции. Смертельному кровотечению может предшествовать небольшое «сигнальное» кровотечение, распознать которое чрезвычайно важно: вмешательство на этом этапе позволяет спасти жизнь. Любое желудочно-кишечное кровотечение у больного, перенесшего протезирование аорты, считают проявлением аортокишечного свища, пока не доказано обратное. Немедленно проводят эндоскопическое исследование, включающее осмотр восходящей части двенадцатиперстной кишки. Если кровотечение массивное, процедуру выполняют в операционной. Аортография и КТ позволяют уточнить диагноз, но не должны задерживать операции.
5. Стрессовые язвы — частая причина желудочно-кишечного кровотечения в реанимационном отделении, особенно у больных с коагулопатиями и находящихся на ИВЛ более 48 ч (N Engl J Med 330:377, 1994). Таким больным профилактически назначают сукральфат, H2-блокаторы или антациды. Эффективность их примерно одинакова, но сукральфат в меньшей степени предрасполагает к развитию пневмонии.
6. Ангиодисплазия желудка и тонкой кишки вызывает рецидивирующие кровотечения разной интенсивности, нередко из нескольких источников. Встречается преимущественно при почечной недостаточности. Эндоскопия — наиболее эффективный метод диагностики и лечения. Комбинированная терапия эстрогенами и прогестероном уменьшает частоту кровотечений (Lancet 335:953, 1990).
7. Другие причины кровотечения из верхнего отдела ЖКТ: гастрит, эзофагит, опухоли. Кровотечение из желчных путей встречается редко, обычно оно сопровождается желтухой и желчной коликой.
6.2. Кровотечение из нижнего отдела ЖКТ
Кровотечение из нижнего отдела ЖКТ чаще всего вызвано дивертикулезом, ангиодисплазией, опухолью, хроническими воспалительными заболеваниями кишечника, ишемическим и инфекционным колитом, лучевым проктитом и болезнями аноректальной области. Иногда за кровотечение из нижнего отдела ЖКТ принимают интенсивное кровотечение из верхнего отдела. Кровотечения из нижнего отдела ЖКТ часто останавливаются самостоятельно.
А. Диагностика проводится одновременно с поддерживающим лечением.
1. Аноскопия, ректоскопия и ректороманоскопия позволяют обнаружить источник кровотечения в прямой и сигмовидной кишке.
2. Катетеризация ветвей брюшной аорты позволяет провести селективную артериографию, выявить источник кровотечения (если скорость кровотечения превышает 0,5 мл/мин) и сразу перейти к эндоваскулярным методам лечения.
3. Сцинтиграфия с мечеными эритроцитами. Собственные эритроциты больного, меченные 99mTc, вводят в/в и следят за их распределением с помощью гамма-камеры. Метод выявляет даже минимальное кровотечение (0,1 мл/мин), но не позволяет точно определить его источник. При положительном результате можно провести как селективную артериографию, так и колоноскопию. При отрицательном результате имеет смысл только колоноскопия: артериография заведомо не выявит источник кровотечения.
4. Артериография выявляет кровотечение со скоростью не менее 0,5 мл/мин. При сильном кровотечении, угрожающем нарушениями гемодинамики, это лучший метод диагностики, позволяющий сразу перейти к лечению.
5. Колоноскопия применяется всегда, когда больного можно подготовить к процедуре с помощью клизм (при стабильной гемодинамике) или хотя бы слабительных, — особенно, если артериография не выявила кровотечения. Колоноскопия позволяет не только найти кровоточащий участок, но и провести биопсию, термо- или лазерную коагуляцию.
6. Дальнейшее обследование. Если кровоточащий участок после сцинтиграфии, артериографии и колоноскопии не найден, а кровотечение не прекратилось, обследование продолжают. В таких случаях следует предположить, что источник находится в верхнем отделе ЖКТ или в тонкой кишке. Если кровотечение прекратилось, больного можно выписать с тем, чтобы в случае рецидива он немедленно явился для повторного обследования.
7. Анализ кала на скрытую кровь может давать ложноположительный результат, особенно если больной ел бифштексы с кровью, репу, брокколи и редис. У людей старше 40 лет положительный результат служит показанием для исследования толстой кишки (колоноскопия либо ректороманоскопия плюс ирригоскопия с двойным контрастированием).
8. Железодефицитная анемия — частое осложнение желудочно-кишечного кровотечения. План обследования определяется клинической картиной.
Б. Лечение при отдельных заболеваниях
1. Кровотечение из дивертикула встречается часто, хотя развивается менее чем у 5% больных с дивертикулезом. В 20% случаев кровотечение не останавливается самостоятельно; в таких случаях вводят вазопрессин внутриартериально. При интенсивном кровотечении и неэффективности вазопрессина показано хирургическое лечение.
2. Ангиодисплазия толстой кишки — частая причина кровотечения у пожилых. Применяют внутриартериальное введение вазопрессина, термокоагуляцию, лазерную коагуляцию и резекцию кишки.
7. Синдром нарушенного всасывания
Диагностика. Синдром
нарушенного всасывания развивается в результате нарушения расщепления
питательных веществ (нарушение пищеварения) или собственно их всасывания.
Основные проявления — понос и истощение, возможны также гипопротеинемия,
дефицит железа, кальция, магния и многих витаминов (прежде всего
жирорастворимых и B12). Как правило, имеется стеаторея, которую
можно выявить качественным (проба с судановым черным) или, лучше,
количественным определением жира в кале. Отличить нарушения всасывания от
нарушения пищеварения позволяет проба на всасывание ксилозы. Низкий уровень ксилозы в крови после
приема стандартной дозы говорит о нарушении всасывания, характерного для
диффузного поражения слизистой тонкой кишки. Проба с бентиромидом выявляет нарушение пищеварения
из-за недостаточности экзокринной функции поджелудочной железы. Независимо от
этиологии синдрома дефицит железа, кальция, магния и витаминов должен быть
своевременно выявлен и восполнен.
XIX. Отдельные заболевания. Причины синдрома нарушенного всасывания многообразны. Определить этиологию позволяют анамнез, приведенные выше пробы и данные рентгенологического исследования тонкой кишки, достаточно характерные при таких заболеваниях, как целиакия, болезнь Крона, амилоидоз и дивертикулез тощей кишки. При ряде диффузных поражений слизистой тонкой кишки (целиакия, лямблиоз, болезнь Уиппла, лимфангиэктазия) диагноз устанавливают на основании биопсии.
А. Целиакия обусловлена непереносимостью глиадина — белка, который содержится во многих злаках (пшенице, ржи, овсе, ячмене). Хотя присутствие в сыворотке антител к глиадину и особенно к эндомизию достаточно специфично, диагноз требует морфологического подтверждения и провокационной пробы: отмена безглютеновой диеты должна вызывать рецидив, также подтвержденный морфологически. После установления диагноза безглютеновую диету (Gourmet Food on a Wheat-Free Diet. Springfield, IL: Thomas, 1972) назначают пожизненно, в большинстве случаев этого достаточно для стойкой ремиссии. В упорных случаях можно назначить преднизон (10—20 мг/сут внутрь), нужно, однако, иметь в виду, что самая частая причина неэффективности диеты — это ее несоблюдение. Следует также провести рентгенологическое исследование и КТ для исключения лимфомы тонкой кишки: по клинической картине она может быть сходна с целиакией, кроме того, целиакия предрасполагает к ее развитию.
Б. Непереносимость лактозы может быть первичной (врожденная недостаточность лактазы) и вторичной (при болезни Крона, вирусном и бактериальном энтерите, целиакии). Не расщепленная и не всосавшаяся в тонкой кишке лактоза попадает в толстую кишку, где расщепляется бактериями с выделением лактата и водорода, что и обусловливает основные клинические проявления — понос, боли в животе и метеоризм после приема молока. При исключении молочных продуктов все клинические проявления немедленно проходят — это служит одновременно средством диагностики и лечения. В сомнительных случаях проводят экспираторную пробу с лактозой: повышенное содержание водорода в выдыхаемом воздухе после ее приема подтверждает диагноз. Заместительная терапия тилактазой позволяет смягчить диетические ограничения.
В. Избыточный рост бактерий в тонкой кишке возникает вследствие застоя кишечного содержимого при дивертикулезе тощей кишки, склеродермии, синдроме приводящей петли после резекции желудка по Бильрот II, частичной тонкокишечной непроходимости и других заболеваниях. Бактерии вызывают деконъюгацию желчных кислот, тем самым препятствуя всасыванию жиров, повреждают стенку толстой кишки и поглощают витамин B12, что приводит к его дефициту. Диагноз основывается на данных анамнеза и рентгенологического исследования. Если причину застоя нельзя устранить хирургически, назначают антибиотики широкого спектра действия — тетрациклин, 250 мг внутрь каждые 6 ч, или амоксициллин/клавуланат, 250—500 мг внутрь каждые 8 ч (Adv Intern Med 38:387, 1993). При длительном лечении антибиотики принимают прерывисто, например по 2 нед ежемесячно.
Г. Резекция дистального отдела подвздошной кишки ведет к нарушению всасывания желчных кислот и витамина B12, которые могут всасываться только на этом участке. Попадая в толстую кишку, желчные кислоты вызывают секреторный понос; в дальнейшем развивается их дефицит, ведущий к нарушению всасывания жиров. К таким последствиям приводит не только резекция, но и, например, поражение дистального отдела подвздошной кишки при болезни Крона.
1. Холестирамин (4 г внутрь каждые 6 ч) связывает желчные кислоты и тем самым уменьшает понос, хотя всасывание жиров при этом еще более ухудшается. При обширном (более 100 см) поражении кишки это обычно приводит к выраженной стеаторее и усилению поноса. В таких случаях показана диета с ограничением жира.2. Диета с низким содержанием жира (50—75 г/сут) уменьшает стеаторею и понос, оставаясь приемлемой на вкус. При более строгом ограничении жиров (менее 40 г/сут) больные перестают получать удовольствие от еды, кроме того, требуется дополнительный источник калорий. Таким источником служат триглицериды со среднецепочечными жирными кислотами. Для их всасывания не требуется желчных кислот; хотя они не очень вкусны, ряд кулинарных рецептов позволяет отчасти преодолеть этот недостаток. Обычная доза — 3—4 столовых ложки в день, более высокие дозы вызывают понос.
3. Жирорастворимые витамины и кальций
Д. Лямблиоз — редкая причина синдрома нарушенного всасывания у лиц с нормальным иммунитетом, однако при недостаточности гуморального иммунитета он выходит на первое место8. Синдром раздраженной кишки
Это самое частое
заболевание ЖКТ, с которым приходится сталкиваться терапевту. В течение
многих лет больных беспокоят схваткообразные боли в животе, чувство распирания,
метеоризм, запор, понос или их чередование. Хотя диагноз ставят методом
исключения (прежде всего исключают недостаточность лактазы),
ряд признаков — длительное течение заболевания, отсутствие похудания и
настораживающих данных физикального исследования — часто позволяет
обойтись без дополнительного обследования. Лечение начинают с диеты с высоким
содержанием клетчатки. Довольно
широко применяют M-холиноблокаторы (настойка белладонны, 5—10 капель внутрь 3 раза в
сутки перед едой; гиосциамин, 0,125 мг под язык по мере
необходимости или таблетки длительного действия 0,375 мг внутрь
2 раза в сутки; дицикловерин, 20 мг внутрь 4 раза в
сутки), хотя эффективность их не доказана. Если лечение не дает результата,
используют трициклические антидепрессанты в низких дозах (Dig Dis Sci 39:2352,
1994): амитриптилин (10—50 мг
внутрь на ночь), доксепин (10—50 мг
внутрь на ночь) или дезипрамин (50 мг внутрь на ночь).
9.1. Острый панкреатит
Острый панкреатит.
Острый панкреатит (лат. pancreatitis, от др.-греч. πάγκρεας — поджелудочная железа + -itis — воспаление) — остро протекающее асептическое воспаление поджелудочной железы демаркационного типа, в основе которого лежат некробиоз панкреатоцитов и ферментная аутоагрессия с последующим некрозом и дистрофией железы и присоединением вторичной гнойной инфекции.
Летальность, несмотря на применение современных методик консервативного и оперативного лечения, высокая: общая 7—15 %, при деструктивных формах — 40—70 %.
Основные причины острого панкреатита
— алкоголизм и желчнокаменная болезнь. Другие причины: травма живота, гиперкальциемия, гипертриглицеридемия, лекарственные средства.
Патогенез
Острый панкреатит представляет собой токсическую энзимопатию. Пусковым механизмом развития является высвобождение из ацинарных клеток поджелудочной железы активированных панкреатических ферментов, обычно присутствующих в виде неактивных проферментов. Это происходит вследствие гиперстимуляции экзокринной функции железы, частичной обтурации ампулы большого дуоденального сосочка, повышения давления в вирсунговом протоке, рефлюксе желчи в вирсунгов проток. Внутрипротоковая гипертензия вызывает повышение проницаемости стенок терминальных протоков, создаются условия для активизации энзимов.
Развитие панкреатита ведёт к самоперевариванию железы. Его осуществляют липолитические ферменты — фосфолипаза А и липаза, которые выделяются железой в активном состоянии.
Липаза поджелудочной железы не повреждает только здоровые клетки железы. Фосфолипаза А разрушает клеточные мембраны и способствует проникновению в клетку липазы. Освобождение тканевой липазы, которая усиливает расщепление липидов (в том числе липидов клеточной мембраны), ускоряет деструктивные процессы. Из накапливающихся в очаге воспаления ферментов в особенности выраженным деструктивным действием обладает эластаза гранулоцитов.
В результате возникают очаги жирового панкреонекробиоза. Вокруг них в результате воспалительного процесса формируется демаркационный вал, отграничивающий их от неповреждённой ткани. Если патобиохимический процесс ограничивается этим, то формируется жировой панкреонекроз. Если в результате накопления в повреждённых липазой панкреатоцитах свободных жирных кислот рН сдвигается до 3,5—4,5, то внутриклеточный трипсиноген трансформируется в трипсин.
Трипсин активирует лизосомные ферменты и протеиназы, что ведёт к протеолитическому некробиозу панкреатоцитов. Эластаза лизирует стенки сосудов, междольковые соединительно-тканные перемычки. Это способствует быстрому распространению ферментного аутолиза (самопереваривания) в поджелудочной железе и за её пределами.
В конечном счёте главным механизмом развития острого панкреатита служит преждевременная активация панкреатических ферментов. Под действием трипсина активизируются все зимогены ферментов поджелудочной железы (эластазы, карбоксипептидазы, химотрипсина, фосфолипазы, колипазы), калликреин-кининовая система, изменяется фибринолиз и свёртываемость крови, что приводит к местным и общим патобиохимическим расстройствам. Кроме местных нарушений, связанных с патологическим процессом в самой железе, наблюдается общий интоксикационный процесс, приводящий к поражению почек, лёгких, печени, сердца.
Прием алкоголя усиливает тонус сфинктера Одди, что может послужить причиной затруднения оттока экзокринного секрета поджелудочной железы и повышения давления в мелких протоках; алкоголь усиливает секрецию желудочного сока и продукцию соляной кислоты, которая стимулирует продукцию секретина, вызывающего экзокринную гиперсекрецию поджелудочной железы; энзимы проникают в паренхиму, происходит активация протеолитических ферментов и аутолиза клеток поджелудочной железы.
Симптомы, течение, осложнения
Чёткой клинической картины нет. В связи с этим для точной диагностики острого панкреатита необходим целый ряд дополнительных исследований.
Жалобы на острую боль в животе, тошноту, рвоту дуоденальным содержимым, не приносящую облегчения, вздутие живота. Как правило, из-за интоксикации и рвоты наступает нарушение водно-электролитного баланса, обезвоживание, которое играет важную роль в патогенезе заболевания. Могут появляться геморрагические синюшные пятна на левой боковой стенке живота, иногда с желтоватым оттенком (симптом Грея Тернера). Возможно возникновение пятен у пупка (симптом Куллена).
Возникновение острого панкреатита возможно на фоне хронического панкреатита. Острый панкреатит отличается от понятия «обострение хронического панкреатита».
Часто после перенесённого острого панкреатита образуются псевдокисты поджелудочной железы. Увеличиваясь в размерах и накапливая патологическую жидкость, псевдокиста за счёт сдавления окружающих органов может вызывать боли, нарушение движения пищи в желудке и двенадцатиперстной кишке. Возможно нагноение псевдокисты.
Иногда отёк или склероз в области головки поджелудочной железы приводят к клинической картине, напоминающей сдавление протоков жёлчных путей и протока поджелудочной железы (Вирсунгова протока). Подобная картина наблюдается при опухолях головки поджелудочной железы, поэтому такую форму панкреатита называют псевдотуморозной. Нарушение оттока жёлчи в таких случаях может вызывать механическую желтуху.
Наиболее частой причиной гибели больных острым панкреатитом в первые дни заболевания является эндогенная интоксикация, сопровождающаяся развитием циркуляторного гиповолемического шока, отёка головного мозга, острой почечной недостаточностью.
Диагностика
Помимо стандартных методов физикального обследования, безусловно необходимых для постановки предварительного диагноза, для диагностики используются лабораторные и инструментальные методики.
- Лабораторная и инструментальная диагностика
- Биохимические тесты
Для диагностики определяют индикаторные (амилаза) и патогенетические (липаза, трипсин) биохимические тесты.
- Активность амилазы в моче и крови при остром панкреатите резко повышается.
На основании активности фосфолипазы А2 в сыворотке крови оценивают степень заболевания, в частности, нарушения в лёгких. По уровню сывороточной рибонуклеазы (РНАзы) оценивают фазу острого деструктивного панкреатита. Повышение алкалинфосфата, трансаминазы и билирубина являются диагностическими критериями непроходимости билиарного дерева.
УЗИ При ультразвуковом исследовании обнаруживают снижение эхогенности паренхимы железы и появление отсутствующего в норме просвета сальниковой сумки за счёт скопления в ней выпота в виде эхопрозрачной полосы между задней стенкой желудка и передней поверхностью железы.
Рентгенография Рентгеновское исследование брюшной полости обычно малоинформативно, однако иногда позволяет выявить как косвенные признаки воспалительного процесса в поджелудочной железе (симптом «сторожевой петли»), так и возможную сочетанную патологию (тени конкрементов в желчном пузыре и т. д.).
Компьютерная томография (КТ) КТ имеет преимущество перед ультразвуковым исследованием, так как обеспечивает лучшую специфическую визуализацию ткани поджелудочной железы и ретроперитонеальных образований.
Магнитно-резонансная томография (МРТ, MRI) МРТ позволяет оценить уровень тканевого метаболизма, наличие ишемии, некроз панкреатоцитов. Это важно при оценке течения заболевания до развития тяжёлых состояний и осложнений.
Лапароскопия Лапароскопия позволяет уточнить форму и вид заболевания, диагностировать панкреатогенный перитонит, парапанкреатический инфильтрат, деструктивный холецистит (как сопутствующее заболевание) и найти показания к лапаротомии. При лапароскопии могут быть выявлены достоверные и косвенные признаки острого панкреатита.
К косвенным признакам отёчного панкреатита относятся: отёк малого сальника и печёночно-двенадцатиперстной связки, выбухание желудка кпереди, умеренная гиперемия висцеральной брюшины верхних отделов брюшной полости, небольшой серозный выпот в правом подпечёночном пространстве. Достоверным признаком жирового панкреонекроза являются очаги жирового некроза на париетальной и висцеральной брюшине, малом и большом сальнике.
Основным эндоскопическим симптомом геморрагического панкреонекроза является геморрагическая имбибиция большого сальника и брыжейки поперечной ободочной кишки, и наличие в брюшной полости выпота с геморрагическим оттенком.
Ангиография Ангиография позволяет установить нарушения кровообращения в поджелудочной железе и окружающих тканях и органах. Эти данные позволяют определиться с прогнозом и тактикой хирургического вмешательства. Однако в настоящее время в связи с появлением и усовершенствованием таких неинвазивных методик, как УЗИ, КТ и ЯМР, значимость ангиографии для диагностики острого панкреатита и других поражений поджелудочной железы в значительной мере утрачивается.
Эндоскопия верхних отделов желудочно-кишечного тракта (ЭГДС) ЭГДС относится к дополнительным методам инструментального исследования острого панкреатита.
Для оценки тяжести острого панкреатита используют критерии Ренсона.
| ПРИ ПОСТУПЛЕНИИ | ЧЕРЕЗ 48 ЧАСОВ |
|---|---|
| возраст > 55 лет | снижение гематокрита > 10% к исходу |
| лейкоцитоз > 16 000 мкл–1 | повышение АМК > 5 мг% (1,8 ммоль/л) |
| глюкоза плазмы > 200 мг% (11,1 ммоль/л) | paO2 < 60 мм рт. ст. |
| активность ЛДГ > 350 ед/л | дефицит оснований > 4 мэкв/л |
| активность АсАТ > 250 ед/л | уровень кальция < 8 мг% (2,0 ммоль/л) |
| секвестрация жидкости > 6 л |
Наличие трех и более критериев означает неблагоприятный прогноз.
Лечение острого панкреатита заключается в поддержании жизненно важных функций и борьбе с осложнениями.
А. Поддерживающее лечение. Боль обычно требует применения наркотических анальгетиков, чаще всего используют петидин, не вызывающий спазма сфинктера Одди. Прием пищи и жидкости полностью запрещают, начинают в/в введение жидкости и отсасывание содержимого желудка через назогастральный зонд. При оценке водного баланса следует учитывать возможность накопления жидкости в полостях. Регулярно определяют и при необходимости корректируют гематокрит, уровни кальция, магния и глюкозы. Антибиотики назначают только при инфекционных осложнениях. Хотя способность H2-блокаторов предотвращать стрессовые язвы не доказана, в тяжелых случаях их все же назначают.
Б. Эндоскопическая ретроградная холангиопанкреатография при остром панкреатите противопоказана, за исключением случаев обтурации фатеровой ампулы желчным камнем, когда эта процедура позволяет провести папиллотомию и удаление камня, что ведет к значительному улучшению (Lancet 2:979, 1988).
1. Панкреонекроз. При КТ с контрастированием панкреонекроз отчетливо виден как область, не содержащая контраста. Усиление болей, высокая лихорадка и лейкоцитоз указывают на инфицирование некротического очага и необходимость хирургического лечения. Для выявления возбудителя выполняют чрескожную аспирационную биопсию под контролем КТ.
2. Ложная киста — это ограниченное скопление жидкости в поджелудочной железе или рядом с ней. Обычно кисты формируются в течение 4 нед после острого панкреатита. Основные симптомы — постоянная боль в животе и повышение активности амилазы крови. Кисты диаметром меньше 5 см со временем обычно уменьшаются и исчезают. При более крупных и не уменьшающихся кистах показано хирургическое лечение. Осложнения ложных кист — нагноение, разрыв, кровотечение и сдавление соседних органов.
3. Инфекция. Лихорадка при остром панкреатите может быть вызвана панкреонекрозом, абсцессом, инфицированной ложной кистой, холангитом и аспирационной пневмонией (для абсцесса характерно появление лихорадки не менее чем через 2 нед от начала заболевания). Одновременно с посевом крови назначают антибиотики широкого спектра действия, подавляющие кишечную микрофлору.
4. Легочные осложнения. Возможны ателектаз, плеврит, пневмония и РДСВ.
5. ОПН развивается вследствие гиповолемии и острого канальцевого некроза.
9.2. Хронический панкреатит
Калькулезный панкреатит — самая частая форма хронического панкреатита — как правило, развивается при алкоголизме. Диагноз подтверждают выявлением камней в поджелудочной железе на обзорных рентгенограммах брюшной полости.
А. Боль, нередко длительная и чрезвычайно мучительная, — основной симптом на ранних стадиях заболевания. Вынужденные постоянно прибегать к наркотическим анальгетикам, больные часто становятся наркоманами. Некоторое облегчение приносит заместительная терапия панкрелипазой. При обструкции протока поджелудочной железы (например, камнем) показана эндоскопическая ретроградная холангиопанкреатография или операция.
Б. Синдром нарушенного всасывания при хроническом панкреатите обусловлен недостаточностью экзокринной функции поджелудочной железы; основные проявления — понос и истощение — связаны с нарушением переваривания жиров и белков.
1. Диагностика основана на пробе с бентиромидом (Gastroenterology 89:685, 1985). При приеме внутрь бентиромид попадает в двенадцатиперстную кишку, где под действием химотрипсина от него отщепляется парааминобензойная кислота. Низкая экскреция парааминобензойной кислоты с мочой говорит о недостаточности экзокринной функции поджелудочной железы. Реже прибегают к прямому измерению секреции после введения секретина. Можно использовать и пробное лечение ферментами поджелудочной железы.
2. Лечение. В большинстве случаев достаточно ферментов поджелудочной железы (панкрелипаза) и диеты с низким содержанием жиров (не более 50 г/сут). Панкрелипазу принимают за 20—30 мин до еды. Препараты без оболочки (Виоказа, Котазим) принимают с H2-блокаторами — в противном случае ферменты инактивируются в кислом желудочном содержимом. Напротив, кишечно-растворимые препараты (Панкреаза, Креон) не следует сочетать с H2-блокаторами — оболочка таких препаратов рассчитана на растворение в щелочной среде кишечника и при снижении кислотности желудочного содержимого растворение произойдет преждевременно. При необходимости назначают жирорастворимые витамины.
В. Эндокринная недостаточность обусловлена разрушением островковых клеток поджелудочной железы. При развитии сахарного диабета назначают инсулинотерапию.
10. Желчнокаменная болезнь
Желчнокаменная болезнь распространена
очень широко и в половине случаев течет бессимптомно. Самое частое клиническое
проявление — желчная колика. Тяжелые осложнения — острый холецистит,
панкреатит, холангит, рак желчного пузыря — встречаются реже.
А. Холецистэктомия — лучший метод лечения желчнокаменной болезни с клиническими проявлениями. Сейчас выполняют главным образом лапароскопическую холецистэктомию, имеющую ряд преимуществ перед открытой (меньше срок госпитализации, лучше косметический результат).
Б. Желчные кислоты (хенодезоксихолевая кислота, 13—16 мг/кг/сут, урсодезоксихолевая кислота, 8—10 мг/кг/сут) способствуют растворению холестериновых камней, снижая относительное содержание холестерина в желчи. Они показаны при некрупных (менее 2 см) необызвествленных холестериновых камнях (при экскреторной холецистографии выглядят как плавающие рентгенонегативные образования) после эпизода неосложненной желчной колики, особенно у больных с противопоказаниями к холецистэктомии. После двухлетнего курса лечения камни растворяются в 25—50% случаев. Основное побочное действие — понос; урсодезоксихолевая кислота переносится лучше хенодезоксихолевой.
В. Другие методы. Желчные камни можно растворить третичным метил-бутиловым эфиром, введенным в желчный пузырь чрескожно или через пузырный проток, или раздробить при дистанционной ударноволновой литотрипсии (то и другое с последующим приемом желчных кислот). Опыт применения этих методов ограничен, показания не разработаны.
Холецистит чаще всего вызван обструкцией пузырного протока желчным камнем (калькулезный холецистит). Некалькулезный холецистит встречается редко, главным образом у тяжелых больных. Холецистит может осложниться эмпиемой и перфорацией. Основной метод лечения — холецистэктомия. Если из-за тяжести состояния эта операция невозможна, проводят холецистостомию. Необходимо в/в введение жидкости и антибиотиков широкого спектра действия.
Холедохолитиаз. Обычно камни попадают в общий желчный проток из желчного пузыря, реже образуются в самом протоке. Обтурация общего желчного протока приводит к желчной колике, желтухе, панкреатиту и холангиту (проявляется болями в правом подреберье, лихорадкой и желтухой). При холедохолитиазе показано удаление камня — с помощью эндоскопической ретроградной холангиопанкреатографии, холедохотомии или через Т-образный дренаж (если он был установлен). При холангите, кроме того, назначают антибиотики широкого спектра действия в/в11. Хронические воспалительные заболевания кишечника
Неспецифический язвенный колит характеризуется
воспалением и изъязвлением слизистой толстой кишки. Кишка поражается единым
участком, захватывающим прямую и — на том или ином протяжении —
ободочную кишку. Заболевание течет хронически, с обострениями и ремиссиями.
Этиология неизвестна. Основные симптомы — понос с кровью, в тяжелых
случаях — лихорадка и похудание. Возможны внекишечные проявления
(поражение кожи, суставов, глаз). Наиболее надежный метод диагностики и оценки
эффективности лечения — ректоскопия с биопсией слизистой. Для исключения
инфекции необходимо бактериологическое исследование. Распространенность
поражения определяют с помощью ирригоскопии, однако ее нельзя проводить при
обострении — это грозит токсическим мегаколоном (см. гл. 16, п. XX.В).
Удаление пораженного участка кишки (обычно колопроктэктомия) приводит к
излечению. При длительном течении нередко развивается рак толстой кишки.
А. Медикаментозное лечение (N Engl J Med 334:841, 1996; табл. 16.4)
1. 5-аминосалициловая кислота и ее производные применяются при нетяжелых обострениях и для профилактики рецидивов.
а. Сульфасалазин при приеме внутрь достигает толстой кишки в неизмененном виде и там расщепляется на действующее вещество — 5-аминосалициловую кислоту и сульфапиридин, ответственный за побочные эффекты.
1) Дозы. Начальная доза при обострении — 0,5 г внутрь 2 раза в сутки. При хорошей переносимости дозу медленно повышают до 0,5—1,5 г внутрь 4 раза в сутки. Во время ремиссии дозу снижают до 1 г внутрь 2 раза в сутки.
2) Побочное действие. Чаще всего сульфасалазин вызывает головную боль, тошноту, рвоту и боль в животе, которые обычно проходят при снижении дозы. Реже встречаются сыпь, лихорадка, гепатит, агранулоцитоз и апластическая анемия; эти реакции требуют отмены препарата. Сульфасалазин может вызывать парадоксальное обострение неспецифического язвенного колита и преходящую олигозооспермию. Одновременно с сульфасалазином назначают фолиевую кислоту (сульфасалазин уменьшает ее всасывание).
б. Месалазин (5-аминосалициловая кислота) благодаря отсутствию в его составе сульфапиридина переносится лучше сульфасалазина. Чтобы препарат достиг толстой кишки, его применяют в виде клизм, ректальных свечей и таблеток в специальной оболочке. Побочные эффекты (пневмонит, гепатит, нефрит и панкреатит) редки.
в. Олсалазин (димер 5-аминосалициловой кислоты) подобно сульфасалазину достигает толстой кишки в неизмененном виде и там расщепляется с выделением активного вещества. Основное побочное действие — понос.
2. Кортикостероиды применяют при обострениях — тяжелых и средней тяжести, во время ремиссии их не назначают. Кортикостероиды эффективны в отношении как кишечных, так и внекишечных проявлений неспецифического язвенного колита, их можно сочетать с производными 5-аминосалициловой кислоты. При изолированном поражении прямой кишки применяют клизмы с кортикостероидами. При более обширном поражении назначают преднизон, 20—40 мг/сут внутрь. Улучшение обычно наступает через 1—2 нед; тогда, назначив сульфасалазин или другое производное 5-аминосалициловой кислоты, дозу преднизона медленно (в течение 2—3 мес) снижают до полной отмены. Если улучшения не наступает, переходят на в/в введение кортикостероидов (гидрокортизон, 50—100 мг в/в каждые 6 ч, или метилпреднизолон, 20—40 мг в/в каждые 12 ч). При снижении дозы кортикостероидов часто развивается обострение, поэтому полностью отменить их удается не всегда. Необходимость в течение многих месяцев принимать более 15 мг/сут преднизона ставит вопрос об операции.
3. Цитостатики — азатиоприн (1,5—2 мг/кг/сут внутрь) и меркаптопурин (до 1,5 мг/кг/сут внутрь) не играют самостоятельной роли в лечении неспецифического язвенного колита. При тяжелых обострениях и нестойких ремиссиях их применение позволяет снизить дозу кортикостероидов, что особенно важно при невозможности провести операцию. В тяжелых случаях, при неэффективности кортикостероидов, применяют циклоспорин, 4 мг/кг/сут в/в (N Engl J Med 330:1841, 1994). Препарат нефротоксичен. При беременности цитостатики не назначают.
4. Антидиарейные средства. В легких случаях, чтобы уменьшить боль в животе и понос, можно использовать настойку белладонны, опия, дифеноксилат и кодеин. При тяжелых и среднетяжелых обострениях эти средства противопоказаны — они могут спровоцировать развитие токсического мегаколона.
Б. Диета. Во время ремиссии диета необходима только при вторичной недостаточности лактазы. При обострении назначают щадящую диету, в тяжелых случаях — питание элементными смесями или парентеральное питание.
В. Молниеносное течение и токсический мегаколон. Молниеносное течение встречается в 5—10% случаев. Характерны профузный понос с кровью, боль в животе, гипоальбуминемия, лихорадка, электролитные нарушения, дегидратация, возможен перитонит. Токсический мегаколон — атония и дилатация толстой кишки — развивается в 1—2% случаев. Это крайне тяжелое осложнение; его диагностический признак — расширение просвета толстой кишки до 6 см и более (измеряется в середине поперечной ободочной кишки) на обзорной рентгенограмме в положении лежа.
1. Аспирация содержимого желудка через назогастральный зонд, полный голод («ничего внутрь»), при необходимости — парентеральное питание.
2. Коррекция водно-электролитных нарушений.
3. Антибиотики широкого спектра действия в/в.
4. Кортикостероиды в/в, например гидрокортизон, 100 мг в/в каждые 6 ч.
5. Тотальная колэктомия показана, если через 48 ч не наступило улучшения (больной с самого начала должен находиться под наблюдением хирурга).
6. M-холиноблокаторы и наркотические анальгетики противопоказаны: они ухудшают течение токсического мегаколона.
Г. Рак толстой кишки. При тотальном поражении толстой кишки через 10—20 лет болезни рак толстой кишки развивается в 10% случаев, в дальнейшем риск возрастает еще более. Если поражена только левая половина толстой кишки, риск ниже. После 8—10 лет болезни всем больным регулярно проводят колоноскопию с множественной биопсией слизистой.
XXI. Болезнь Крона по течению сходна с неспецифическим язвенным колитом, но отличается от него локализацией и характером поражения. Болезнь Крона может поражать любые отделы ЖКТ (наиболее типично воспаление дистальной части подвздошной кишки — терминальный илеит), причем не обязательно единым участком. В процесс вовлечены все слои кишечной стенки, отсюда склонность к образованию кишечных стриктур и свищей. Типичные симптомы — понос (обычно без крови), боли в животе и похудание. Хирургическое лечение не приводит к полному излечению.
А. Лечение неосложненной болезни Крона (см. также табл. 16.4)
1. Антидиарейные средства в качестве основной терапии применяют при легких обострениях и после хирургического лечения.
2. Сульфасалазин применяют при обострениях средней тяжести, если поражение ограничено толстой кишкой; при поражении тонкой кишки он неэффективен. Способность препарата предотвращать обострения не доказана.
3. Месалазин эффективен при поражении как толстой, так и тонкой кишки; он дает меньше побочных эффектов, чем сульфасалазин, и на сегодня считается лучшим препаратом для лечения болезни Крона.
4. Кортикостероиды (преднизон, 20—40 мг внутрь 1 раз в сутки) применяют при выраженном обострении. В наиболее тяжелых случаях их вводят в/в (метилпреднизолон, 20—40 мг в/в каждые 6 ч, или другой препарат в эквивалентной дозе, см. табл. 16.4). Для профилактики рецидивов кортикостероиды не используют. Внекишечные проявления болезни Крона, которые, как и при неспецифическом язвенном колите, часто сопровождают обострения, также поддаются кортикостероидной терапии.
5. Цитостатики. Меркаптопурин и азатиоприн применяют при неэффективности кортикостероидов, при необходимости снизить дозу кортикостероидов и для профилактики рецидивов. Основное побочное действие — угнетение кроветворения и панкреатит. Для снижения дозы кортикостероидов применяют также метотрексат, 25 мг в/м 1 раз в неделю (N Engl J Med 332:292, 1995). Препарат гепатотоксичен и угнетает кроветворение. Применение иммунодепрессантов требует большого опыта и тщательного наблюдения для своевременного выявления осложнений.
6. Метронидазол (250 мг внутрь 3 раза в сутки) по эффективности не уступает сульфасалазину и может быть использован при непереносимости или безуспешности другого лечения. Оказывает тератогенное и — при длительном применении — нейротоксическое действие.
7. Диета. Внутрь назначают препараты кальция, магния, железа, фолиевой кислоты, витамина D. При поражении тонкой кишки необходимо парентеральное введение витамина B12. При обширном поражении тонкой кишки и после резекции подвздошной кишки развивается оксалурия, в таких случаях для предупреждения образования камней в почках назначают диету с низким содержанием жира и оксалатов и повышенным содержанием кальция.
8. Парентеральное питание используют, чтобы дать отдых кишечнику, его применяют как самостоятельный метод лечения и при подготовке к операции.
Б. Лечение осложнений болезни Крона (свищи, кишечная непроходимость, абсцессы, перфорация, кровотечение) главным образом хирургическое. По возможности применяют щадящие методы, такие, как чрескожное дренирование абсцессов и эндоскопическая дилатация кишки. Повторные резекции приводят к синдрому короткой кишки, их желательно избегать.
1. Парапроктит. Абсцесс вскрывают, назначают метронидазол и ципрофлоксацин.
2. Свищи (наружные, кишечно-пузырные, кишечно-влагалищные). Лечение хирургическое; назначают парентеральное питание и иногда — меркаптопурин или метронидазол.
3. Кишечная непроходимость возникает при рубцовом сужении кишки. Существенную роль могут играть также спазм и отек кишки — в этих случаях ее декомпрессия отсасыванием через кишечный зонд, введение жидкости и кортикостероиды иногда позволяют избежать операции. Больному следует отказаться от трудноперевариваемых продуктов (орехи, кукуруза, фрукты с жесткой кожурой).
12. Дивертикулез кишечника
Дивертикулез — очень
распространенное заболевание; как правило, оно течет бессимптомно и не требует
лечения.
Кровотечение из дивертикула чаще всего прекращается самостоятельно. Вмешательство требуется при длительном или повторном кровотечении.
Дивертикулит — воспаление дивертикула, часто с микроперфорацией, проявляется болью слева внизу живота, лихорадкой и запором; характерен лейкоцитоз. Пальпация живота болезненна, иногда определяется инфильтрат, возможны симптомы раздражения брюшины. Для выявления кишечной непроходимости и перфорации делают обзорную рентгенограмму брюшной полости; абсцесс можно выявить при КТ. Изредка формируются наружные, кишечно-пузырные или кишечно-влагалищные свищи. При амбулаторном лечении назначают жидкую диету и антибиотики внутрь (метронидазол с ТМП/СМК или ципрофлоксацином либо комбинацию ампициллина, цефалоспорина и тетрациклина). В тяжелых случаях показана госпитализация. Запрещают прием жидкости и пищи, начинают в/в введение жидкости, при кишечной непроходимости — отсасывание желудочного содержимого. Антибиотики вводят в/в, их комбинация должна обеспечивать подавление кишечной микрофлоры. Хотя обычно удается ограничиться консервативным лечением, ряд осложнений, таких, как перитонит и свищ, требуют операции, поэтому необходимо наблюдение хирурга. На будущее больному рекомендуют есть больше клетчатки — это способствует предупреждению рецидивов.
13. Болезни аноректальной области
Геморрой
А. Тромбоз наружных геморроидальных узлов проявляется внезапной болью. При осмотре выявляют напряженные, синюшные подкожные узлы. Если боль умеренная, назначают анальгетики внутрь, сидячие теплые ванночки, размягчающие слабительные и свечи с анестетиками. При выраженной боли узел иссекают под местной анестезией.
Б. Внутренний геморрой обычно проявляется кровотечением и выпадением внутренних геморроидальных узлов; боль нехарактерна. Выпавшие узлы красные, покрыты слизистой, разделены глубокими складками, уходящими в задний проход.
1. Диета с высоким содержанием клетчатки устраняет запор и натуживание при дефекации.
2. Сидячие ванночки оказывают очищающее и успокаивающее действие, их принимают 2 раза в сутки по 15 мин. Можно использовать также тампоны с настойкой гамамелиса.
3. Мази и свечи с анальгетиками, смягчающими и вяжущими веществами и гидрокортизоном широко используют при геморрое. Свечи с кортикостероидами не следует применять дольше 2 нед.
4. Хирургическое лечение показано при безуспешности консервативной терапии.
Анальные трещины проявляются острой болью в заднем проходе, усиливающейся при дефекации, особенно плотным калом. Трещины обычно видны при осмотре, как правило, они располагаются по средней линии спереди или сзади. Лечение — как при геморрое. Незаживающие трещины требуют хирургического лечения.
Парапроктит часто развивается при сахарном диабете, иммунодефиците и хронических воспалительных заболеваниях кишечника. В промежности или в заднепроходном канале пальпируется уплотненный или флюктуирующий участок. Парапроктит угрожает тяжелыми осложнениями и требует немедленного дренирования. При флегмоне, тяжелой интоксикации, а также больным с сахарным диабетом и иммунодефицитом назначают антибиотики, активные в отношении кишечной микрофлоры.
14. Рвота
Причины рвоты многообразны — инфаркт миокарда,
беременность, лихорадка, различные метаболические нарушения и лекарственные
средства. Особенно характерна рвота для заболеваний ЦНС и ЖКТ.
Среди заболеваний ЖКТ рвоту наиболее часто вызывает вирусный
гастроэнтерит. Рвота в сочетании с болью в животе, задержкой стула и газов
указывает на кишечную непроходимость. В большинстве случаев рвота проходит при
устранении ее причины. Особую проблему представляет рвота при противоопухолевой
химиотерапии, когда отмена препарата невозможна или нежелательна.
Общие мероприятия. Обычно достаточно кратковременного голодания, в тяжелых случаях проводят отсасывание желудочного содержимого через назогастральный зонд. При гиповолемии показано в/в введение жидкости.
Медикаментозное лечение. В качестве противорвотных средств применяют блокаторы дофаминовых D2- и серотониновых 5-HT3-рецепторов. При тяжелой рвоте, вызванной химиотерапией, их комбинируют друг с другом и кортикостероидами.
А. Производные фенотиазина оказывают выраженное противорвотное действие, блокируя D2-рецепторы. Они эффективны при среднетяжелой рвоте, вызванной химиотерапией.
1. Прохлорперазин, 5—10 мг внутрь 3—4 раза в сутки; 10 мг в/м или в/в каждые 6 ч; 25 мг ректально 2 раза в сутки.
2. Прометазин, 12,5—25 мг внутрь, в/м или ректально каждые 4—6 ч.
3. Тиэтилперазин, 10 мг внутрь, в/м или ректально 1—3 раза в сутки.
4. Триметобензамид, 250 мг внутрь 3—4 раза в сутки; 200 мг в/м или ректально 3—4 раза в сутки.
Эти препараты вызывают сонливость и иногда — экстрапирамидные нарушения.
1. Метоклопрамид (10 мг внутрь за 30 мин до еды и перед сном) — блокатор D2- и 5-HT3-рецепторов. Благодаря хорошей переносимости в высоких дозах препарат применяют при тяжелой рвоте, вызванной химиотерапией (см. табл. 20.2). Метоклопрамид улучшает моторику ЖКТ и хорошо помогает при рвоте, обусловленной парезом желудка. Побочное действие — сонливость, экстрапирамидные нарушения и гиперпролактинемия (галакторея, аменорея) — обусловлено блокадой D2-рецепторов.
2. Цизаприд (10—20 мг внутрь перед едой и перед сном) по действию на моторику ЖКТ сходен с метоклопрамидом и столь же эффективен при рвоте, связанной с парезом желудка. Проявления побочного действия (см. гл. 16, п. IV.Б.5) встречаются редко. Цизаприд не действует на дофаминовые рецепторы и не дает соответствующих побочных эффектов.
3. Домперидон (10—20 мг внутрь за 30 мин до еды и перед сном) — блокатор D2-рецепторов, помогает при рвоте, вызванной как химиотерапией, так и парезом желудка. Домперидон почти не проникает в ЦНС и не вызывает экстрапирамидных нарушений, однако может вызвать гиперпролактинемию и связанные с ней галакторею и нарушения менструального цикла.
4. Ондансетрон — блокатор 5-HT3-рецепторов — наиболее мощное средство против рвоты, вызванной химиотерапией. Вводят в/в 32 мг в течение 15 мин за 30 мин до введения цитостатика или 0,15 мг/кг в/в троекратно с интервалом 4 ч. Препарат может вызвать головную боль, головокружение и запор.
15. Понос
Лечение поноса заключается в устранении его причины,
коррекции водно-электролитных нарушений и иногда —
назначении антидиарейных средств. Понос длительностью до 1—2 нед считается
острым, более продолжительный — хроническим (N Engl J Med 332:725, 1995).
Хронический понос требует обследования во всех случаях. Острый понос при
удовлетворительном общем состоянии требует дополнительного обследования, только
если он сопровождается выделением крови, тенезмами и лихорадкой и при
настораживающем эпидемиологическом анамнезе. План обследования определяется
данными анамнеза. Вспышка гастроэнтерита в замкнутом коллективе требует прежде
всего бактериологического исследования кала. Если понос возник после поездки в
слаборазвитую страну, необходимо исследование на амебиаз. При поносе на фоне
антибиотикотерапии необходимо определение токсина Clostridium difficile в кале
(возможен псевдомембранозный колит). Присутствие в кале лейкоцитов и
лактоферрина указывает на воспалительное поражение слизистой кишечника.
15.1. Острый понос
Острый понос вызывают пищевые отравления (микробные и немикробные), инфекции (вирусные, бактериальные и протозойные) и лекарственные средства. В больничных условиях на первый план выходят недостаточность лактазы, проявившаяся от смены диеты, антибиотики (вызывают дисбактериоз и псевдомембранозный колит) и каловый завал.
А. Вирусные и бактериальные инфекции. В США самые частые причины острого поноса — вирусный энтерит и бактериальная инфекция, вызванная Escherichia coli, Shigella, Salmonella, Campylobacter и Yersinia spp. В отсутствие лихорадки, крови в кале и тенезмов обследования и антибактериальной терапии не требуется, в противном случае проводят бактериологическое исследование, анализ кала и колоноскопию; антибактериальную терапию начинают, не дожидаясь результатов посева. Используют фторхинолоны: ципрофлоксацин (500 мг внутрь 2 раза в сутки в течение 3 сут) или норфлоксацин (400 мг внутрь 2 раза в сутки в течение 3 сут). Применяют также ТМП/СМК (160/800 мг внутрь 2 раза в сутки в течение 5 сут), хотя устойчивость к этому препарату распространена довольно широко.
1. Амебиаз. Кишечный амебиаз обычно сопровождается поносом. Факторы риска — гомосексуализм, антисанитарные условия жизни и поездки в слаборазвитые страны. Диагноз основан на обнаружении цист или трофозоитов Entamoeba histolytica в кале или биоптате толстой кишки. При носительстве применяют паромомицин (500 мг внутрь 3 раза в сутки в течение 7 сут) или дийодгидроксихинолин (650 мг внутрь 3 раза в сутки в течение 20 сут). При кишечном амебиазе проводят курс метронидазола (750 мг внутрь 3 раза в сутки в течение 10 сут), затем назначают паромомицин (500 мг внутрь 3 раза в сутки на 7 сут) или дийодгидроксихинолин (650 мг внутрь 3 раза в сутки на 20 сут).
2. Лямблиоз. Понос — типичное проявление этой инфекции. Диагноз подтверждают выявлением цист и трофозоитов Giardia lamblia в кале, содержимом двенадцатиперстной кишки или биоптате тонкой кишки. Семидневный курс мепакрина (100 мг внутрь 3 раза в сутки) или метронидазола (250 мг внутрь 3 раза в сутки или 2 г внутрь 1 раз в сутки) обычно приводит к излечению. При недостаточности гуморального иммунитета необходим более длительный курс.
В. Лекарственные средства, в том числе слабительные, антациды, сердечные гликозиды, хинидин, колхицин и антибиотики, — частая причина поноса; обычно он не требует лечения и проходит после отмены препарата. Антибиотики угнетают нормальную микрофлору кишечника, что приводит к дисбактериозу, наиболее тяжелая форма которого — псевдомембранозный колит — развивается под действием токсина Clostridium difficile. При обнаружении токсина в кале назначают метронидазол (500 мг внутрь или в/в 3 раза в сутки на 7—14 сут). За улучшением нередко следует рецидив, который лечат тем же препаратом, но более длительно. Ванкомицин (125 мг внутрь 4 раза в сутки) применяют только при неэффективности метронидазола. По данным одного исследования (JAMA 271:1913, 1994), добавление к антибиотикотерапии культуры дрожжевого гриба Saccharomyces boulardii (500 мг 2 раза в сутки в течение 4 нед) снижает риск рецидивов.
15.2. Хронический понос
Хронический понос может быть проявлением тяжелого заболевания и требует обязательного выяснения причины. Диагностике помогает анамнез и определение патогенетического механизма поноса.
А. Анамнез. Частый жидкий стул малыми порциями, императивные позывы и тенезмы указывают на поражение дистального отдела толстой кишки. Обильный стул — признак поражения тонкой кишки. Стеаторея свидетельствует о патологии тонкой кишки или поджелудочной железы. Иногда под поносом больной понимает недержание кала.
Б. Патогенетический механизм поноса можно определить по клинической картине и реакции на голодание.
1. Осмотический понос вызывают осмотически активные вещества (например, осмотические слабительные или лактоза при недостаточности лактазы); в отличие от остальных видов поноса он всегда проходит при голодании.
2. Секреторный понос вызывают вещества, стимулирующие секрецию воды в просвет кишки — бактериальные токсины (например, холерный), гормоны (гастрин, вазоактивный интестинальный полипептид), раздражающие слабительные, жирные и желчные кислоты.
3. Воспалительный понос возникает при кишечных инфекциях, хронических воспалительных заболеваниях кишечника, целиакии, лимфоме или ишемии кишечника. В его развитии участвуют как секреторный, так и осмотический механизмы.
4. Гипермоторный понос возникает при синдроме раздраженной кишки.
Понос у гомосексуалистов — нередкое явление, что обусловлено заражением при половых контактах. Особенно часто он встречается при СПИДе, иногда являясь его первым проявлением. Понос при СПИДе могут вызвать различные инфекции (сифилис, гонорея, хламидийная инфекция, герпес), в том числе оппортунистические (Cryptosporidium и Isospora spp., Mycobacterium avium-intracellulare, цитомегаловирус), саркома Капоши и лимфома.
Антидиарейные средства при остром поносе не нужны, а при хроническом — малоэффективны до устранения его причины. Более того, иногда они могут замедлить выздоровление (например, при сальмонеллезе и дизентерии).
А. Препараты, увеличивающие объем содержимого кишечника,
Б. Адсорбенты. Аттапулгит, 1,2—1,5 г после каждого жидкого стула.
В. Опиоиды используются при поносе из-за способности тормозить перистальтику кишечника; при тяжелых поражениях кишечника (токсический мегаколон, псевдомембранозный колит) применять их нельзя. Они противопоказаны при аденоме предстательной железы, бронхиальной астме и ХОЗЛ. Следует учитывать и опасность развития наркомании.
1. Лоперамид, 2—4 мг внутрь после каждой дефекации (не более 8 мг/сут).
2. Дифеноксилат/атропин, 5 мг внутрь 4 раза в сутки до прекращения поноса, затем дозу снижают до минимально эффективной. Противопоказан при заболеваниях печени. При передозировке угнетает дыхание, особенно в сочетании с фенотиазинами, трициклическими антидепрессантами и барбитуратами.
3. Парегорик (камфорная настойка опия), 5—8 мл внутрь 4 раза в сутки или 5—10 мл после каждой дефекации, но не более 32 мл/сут.
4. Кодеин, 30—60 мг внутрь 2—4 раза в сутки.
5. Дезодорированная настойка опия, 0,3—1 мл внутрь 4 раза в сутки (максимальная доза — 6 мл/сут).
Г. Октреотид (100—600 мг/сут п/к в 2—4 приема) — синтетический аналог соматостатина, применяется при неоперабельных карциноидном синдроме и ВИПоме.
16. Запор
Причины запора многочисленны.
Его вызывают многие лекарственные средства, в том числе наркотические
анальгетики, алюминийсодержащие антациды, холиноблокаторы и некоторые
гипотензивные средства, препараты железа и даже слабительные при длительном
использовании. Недостаток клетчатки в рационе, малоподвижный образ жизни, боль
при дефекации (геморрой, анальные трещины) — частые причины запора у
практически здоровых лиц. Запор — характерное проявление многих
заболеваний, например сахарного диабета, гипотиреоза и гиперпаратиреоза.
У госпитализированных больных запор встречается особенно часто — к
перечисленным причинам тут добавляются изменение привычной обстановки и такие
факторы, как, например, сульфат бария, применяемый при рентгенографии
желудка. Запор у пожилых требует исключения рака толстой кишки.
Лечение обычно сводится к устранению причины запора. В отдельных случаях могут потребоваться дополнительные меры.
А. Клетчатка (20—30 г/сут) хорошо помогает при хроническом запоре, однако действует только через несколько недель и может вызывать вздутие живота. Можно использовать пшеничные отруби (их добавляют в пищу) или семя подорожника — его размешивают с водой и пьют 2—4 раза в сутки.
Б. Слабительные назначают при неэффективности клетчатки. Длительное использование их нежелательно. При болях в животе неясного происхождения и кишечной непроходимости слабительные противопоказаны.
1. Размягчающие слабительные: докузат натрия, 50—200 мг внутрь 1 раз в сутки, и докузат кальция, 240 мг внутрь 1 раз в сутки. Эти препараты не следует применять вместе с вазелиновым маслом — они усиливают его всасывание в тонкой кишке.
2. Средства, стимулирующие перистальтику кишечника. Длительное применение этих средств не рекомендовано.
а. Касторовое масло (15 мл внутрь) вызывает быстрое опорожнение толстой кишки.
б. Бисакодил принимают вечером — внутрь (10—15 мг) или ректально (свечи по 10 мг); дефекация происходит через 15—60 мин.
в. Экстракты крушины и сенны вызывают однократную дефекацию через 10—16 ч после приема; при длительном применении возможна атония толстой кишки. Обычная доза экстракта крушины — 5 мл внутрь 1 раз в сутки; экстракт сенны принимают по 1 таблетке внутрь 1—2 раза в сутки.
3. Осмотические слабительные представляют собой невсасывающиеся соли и углеводы, задерживающие жидкость в просвете толстой кишки.
а. Гидроксид магния — 15—30 мл водной суспензии внутрь.
б. Цитрат магния — 200 мл стандартного раствора внутрь.
в. Лактулоза — 15—30 мл стандартного сиропа внутрь.
г. Раствор полиэтиленгликоля с сульфатами и другими солями (GoLYTELY, Colyte) применяют для быстрого очищения толстой кишки при подготовке к эндоскопии или операции. Раствор принимают внутрь, 4—6 л в течение 3—4 ч.
17. Лабораторные исследования кала

Анализ кала (АК) относится к методам неинвазивной диагностики. То есть собрал какашки (хочешь свои, хочешь чужие), отнёс в лабораторию и получил результат. Не надо залезать внутрь организма, вызывать дискомфорт и причинять боль.
АК бывают разные: есть полезные, есть не очень, а есть дорогие, но бессмысленные. Разбираемся.
1. Анализ кала на скрытую кровь: придуман для того, чтобы скринировать колоректальный рак. Вдруг в кишке уже растёт полип, который подкравливает, а мы об этом не знаем. Скрытую кровь в кале во всём мире рекомендовано определять иммунохимическим методом (даже в отечественном приказе о диспансеризации населения указан именно этот анализ). Увы, до сих пор продолжает по всей стране использоваться дешёвый анализ, в котором кровь определяется бензидиновой (реакция Гегерсена) или гваяковой пробами. Они требуют специальных диет, и часто врут в обе стороны, потому и не рекомендованы.
2. Посев кала на дисбиоз – малополезный анализ. Приставка «мало» здесь только потому, что в данном анализе могут быть оценены патогенные кишечные бактерии. В остальном тестирование нескольких грамм кала из толстой кишки следует признать бесполезным. А вы сможете сделать заключение о составе кишечной микробиоты по 20 из более 1500 видов бактерий, особенно если принять во внимание, что используемые в анализе жесткие нормы не имеют ничего общего с реальным количеством бактерий в толстой кишке. Я вот не смогу.
3. Посев кала на условно-патогенную микрофлору – полезен мало, но в ряде случаев может выявить условно-патогенных возбудителей, токсины которых могут быть ответственны за острую диарею (Klebsiella oxytoca как яркий пример).
4. Копрограмма – малополезный анализ, сильно зависящий от исполнителя (лаборанта) при отсутствии количественной оценки найденных изменений. Найдены жиры – а сколько их? Непереваренная клетчатка? Так она там в норме. Кровь в кале оценивается бензидиновой пробой (см.выше). Этот анализ часто вводит в тревогу пациентов ввиду слишком жестких норм и большого количества якобы отклонений от нормы. Данный тест не используется в странах, где развита современная гастроэнтерология.
5. Фекальный кальпротектин (ФК). Отличный скрининг воспалительных процессов в кишечнике, служит для отбора пациентов, которым может понадобиться колоноскопия. Увы, в некоторых лабораториях ФК ошибочно обозначается как маркер воспалительных или аутоиммунных заболеваний кишечника. Это не так. ФК – белок, который повышен в кале при нейтрофильном воспалении в кишке любого происхождения. Фекальный лактоферрин – по сути дублирует ФК, менее доступен в лабораториях. Зачем он нужен при наличии ФК? Не знаю.
6. Эластаза кала – анализ, позволяющий выявить внешнесекреторную недостаточность поджелудочной железы. Эластза может быть вторично снижена при некоторых патологиях тонкой кишки. Отлично объясняет причину жирного жидкого стула у пациента. Альтернативный метод тестирования ферментативной недостаточности поджелудочной железы – оценка химотрипсина в кале – используется редко ввиду меньшей стабильности белка и меньшей чувствительности теста.
7. Анализ кала на жёлчные кислоты используется для тестирования одной из причин хронической диареи – хологенной диареи.
8. Стеатокрит стула позволяет провести количественную оценку потери жиров в ходе пищеварения и сделать заключение о наличии стеатореи.
9. Альфа-1-антитрипсин в стуле. Этот белок теряется при нарушении всасывания в тонкой кишке (энтеропатия любого происхождения). Ввиду стабильности он может быть оценен в образце кала. Высокое содержание альфа-1-антитрипсина в стуле может свидетельствовать о нарушении кишечного всасывания или белка.
10. Остаточная осмолярность кала – данный метод позволяет разделить два типа диареи: секреторную и осмотическую. Обычно используется в качестве резервного метода диагностики диарей, когда лежащие на поверхности причины нарушений стула исключены, и требуется определить, в каком диагностическом направлении двигаться. Осмотический тип диареи встречается при нарушении переваривания и всасывания, секреторный – при повышенной секреции или нарушении всасывания воды и электролитов в просвет кишечника.
11. Зонулин в кале – как пишут лаборатории, «служит маркером нарушения проницаемости кишечного барьера». Ввиду того, что повышенная кишечная проницаемость – не заболевание, а один из многих механизмов различных кишечных заболеваний, в настоящее время определение зонулина возможно разве что с научной точки зрения. До получения новых данных этот метод бесполезен в рутинной практике.
12. Содержание углеводов в кале – анализ, целью которого является определение в кале невсосавшихся углеводов, таких как глюкоза, галактоза, лактоза, фруктоза, мальтоза. Следует помнить, что всасывание углеводов часто зависит от употребленного количества и активности ферментов, скорости кишечной моторики. Повышенное содержание углеводов в кале не всегда свидетельствует о патологии, в том числе проявляющейся симптомами. Ценность применения данного теста в клинической практике ограничена.
В данном посте я не рассматривал анализы кала для диагностики бактериальной, вирусной инфекции и паразитарной инвазии.
https://telegra.ph/Analizy-kala-v-gastroehnterologii-07-20








