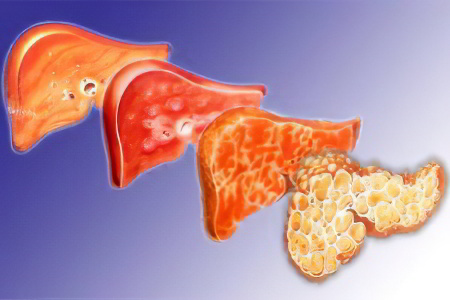
Болезни печени
| Сайт: | Электронный информационно- образовательный портал ВолгГМУ |
| Курс: | Дисциплина Медицинская биохимия. Принципы измерительных технологий в биохимии. Патохимия, диагностика. Биохимия злокачественного роста». Часть 3 |
| Книга: | Болезни печени |
| Напечатано:: | Гость |
| Дата: | Пятница, 17 Май 2024, 19:22 |
Оглавление
- 1. Клиническая морфология печени
- 2. функциональная морфология гепатоцита
- 3. Механизм секреции желчи
- 4. Основные клинико-лабораторные синдромы при болезнях печени
- 5. Объем исследования
- 6. Сроки выполнения исследований
- 7. Печеночные ферменты в сыворотке
- 8. Индикаторы цитолитического синдрома
- 9. Индикаторы гепатодепрессивного (гепатопривного) синдрома, или малой недостаточности печени
- 9.1. ПОКАЗАТЕЛИ ВЫДЕЛИТЕЛЬНОЙ (ПОГЛОТИТЕЛЬНО-ВЫДЕЛИТЕЛЬНОЙ) ФУНКЦИИ ПЕЧЕНИ
- 9.2. Бромсульфалеиновая проба
- 9.3. Индоциановая проба
- 9.4. ТЕСТЫ, ХАРАКТЕРИЗУЮЩИЕ ОБЕЗВРЕЖИВАЮЩУЮ ФУНКЦИЮ ПЕЧЕНИ
- 9.5. ТЕСТЫ, СВЯЗАННЫЕ С СИНТЕЗОМ ПРОКОАГУЛЯНТОВ И АНТИСВЕРТЫВАЮЩИХ КОМПОНЕНТОВ СИСТЕМЫ КРОВИ
- 9.6. ИНДИКАТОРЫ ГЕПАТОДЕПРЕССИИ, СВЯЗАННЫЕ С СИНТЕЗОМ БЕЛКА
- 9.7. ИНДИКАТОРЫ ГЕПАТОДЕПРЕССИВНОГО СИНДРОМА, СВЯЗАННЫЕ С УГЛЕВОДНЫМ ОБМЕНОМ
- 10. Индикаторы синдрома повышенной активности мезенхимы, или мезенхимально-воспалительного синдрома
- 11. Холестатический синдром
- 11.1. Щелочная фосфатаза (фосфомоноэстераза 1-3.1.3.1)
- 11.2. Кислая фосфатаза (3.1.3.2)
- 11.3. 5-Нуклеотидаза (3.1.3.5)
- 11.4. Лейцинаминопептидаза (аминокислотная ариламидаза, нафтиламидаза, 3.4.11.1)
- 11.5. Желчные кислоты и холеглицин
- 11.6. Билиарный гликопротеин 1
- 11.7. Билирубин общий и конъюгированный
- 11.8. γ-Глутамилтрансфераза (ГГТ; синоним — гамма-глютамилтранспептидаза, ГГТП) сыворотки крови
- 11.9. Другие индикаторы холестаза
- 12. Индикаторы шунтирования печени
- 13. Индикаторы регенерации и опухолевого роста печени
- 14. Гепатозы
- 15. Фиброз печени
- 16. Вирусные гепатиты
- 17. Цирро́з пе́чени
1. Клиническая морфология печени
Печень - непарный орган массой 1300-1800 г. Она расположена под диафрагмой в правом верхнем квадранте живота. На нижней, висцеральной ее поверхности определяется короткая поперечная глубокая бороздка - ворота печени. В области ворот находятся печеночная артерия, воротная вена, желчный и лимфатический протоки.
Наиболее распространено деление органа на правую и левую доли, которые в свою очередь состоят из сегментов. Всего насчитывается 8 сегментов. К каждому из них подходят ветви воротной вены, печеночной артерии, а выходят желчный проток и печеночная вена.
На нижней поверхности печени, примыкающей к воротам, расположена небольшая хвостатая доля (спигелиева). Она соответствует первому сегменту.
Более 60% печени составляют гепатоциты. Около 15-20% клеточного состава - эндотелиальные клетки. Остальное падает на протоковые, соединительнотканные и иные клетки.
В эксперименте удаление части печени ведет к быстрой регенерации этого участка. Так, например, удаление 2/3 печени крысы ведет к восстановлению ее прежних размеров всего за несколько дней. Однако полное восстановление печени ad integrum, по-видимому, возможно при удалении не более 10% массы органа (Bucher N. et al„ 1979).
В последние годы резко увеличилось число резекций печени. Установлено, что если хвостатая доля остается неповрежденной, то регенерация печени протекает быстрее
В последние годы накопились материалы, существенно углубляющие представление о структуре печени
Основу структуры печени составляет долька, которая формируется из клеток, в первую очередь гепатоцитов. Центр печеночной дольки - печеночная вена; радиально от нее располагаются гепатоциты, образуя балки. На периферии дольки, примыкая к ней, находится портальное поле с разветвлениями воротной вены, печеночной артерии и мельчайшим желчным протоком.
Распределение ферментов в различных отделах печени неодинаково. Так, по данным Е. Schmidt и F. Schmidt (1982), при преимущественном поражении центральных отделов дольки (острый алкогольный гепатит и особенно острый венозный застой) в сыворотке крови нарастает активность глутаматдегидрогеназы, при преимущественном поражении портальных трактов и прилегающих отделов печеночной дольки (острый вирусный гепатит и хронический активный гепатит) в первую очередь повышается активность аминотрансфераз
2. функциональная морфология гепатоцита
В гепатоците различают васкулярный полюс, в котором при помощи микроворсин осуществляется эндоцитоз (захват веществ извне и введение их в клетку) и экзоцитоз, и билиарный полюс, где при помощи микроворсин происходит выделение веществ из клетки.
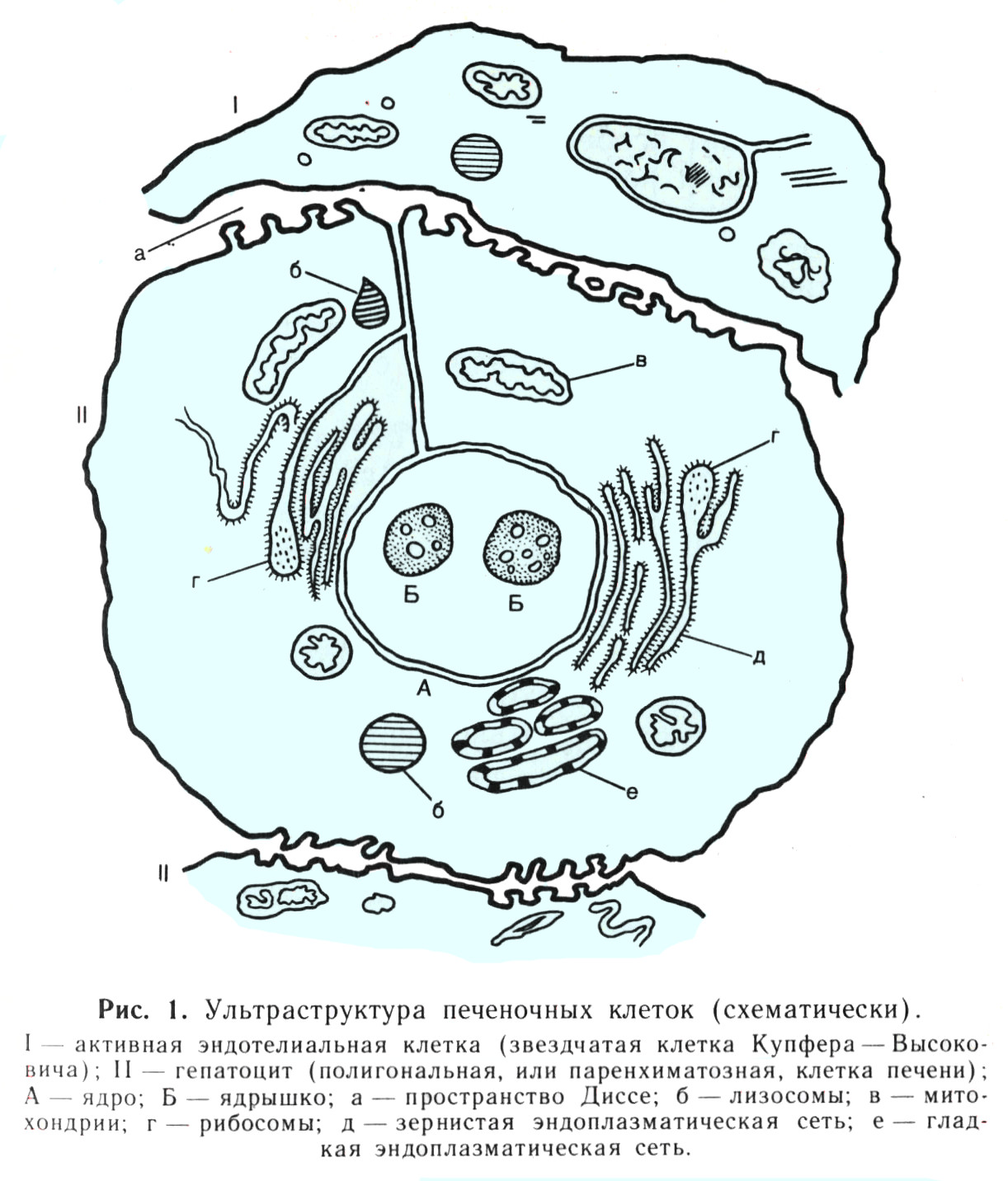
Клетка состоит из оболочки, цитоплазмы и внутриклеточных структур - органоидов. Обычно в центральной части клетки расположено ядро (рис. 1).
- Оболочка клетки (цитоплазматическая мембрана)
- Цитоплазма (цитозоль, гиалоплазма)
- Митохондрии
- Эндоплазматический ретикулум, или цитоплазматическая (эндоплазматическая) сеть
- "микросомы" или "микросомная фракция"
- Гранулярный (зернистый) эндоплазматический ретикулум, или зернистая цитоплазматическая сеть. Рибосомы
- Гладкий эндоплазматический ретикулум, или гладкая цитоплазматическая сеть
- Пластинчатый комплекс (аппарат Гольджи)
- Лизосомы
- Микроворсинки билиарного полюса гепатоцита
Взаимоотношения желчных капилляров (канальцев) и микроворсинок играют важную роль в нормальной секреции желчи. Стенки желчного капилляра образованы канальцевыми отделами мембран гепатоцитов. От места появления эпителия желчного хода и формирования таким путем самостоятельной стенки желчного канала этот отрезок желчевыводящих путей называется мельчайшим желчным протоком.
3. Механизм секреции желчи
Конъюгированный билирубин секретируется гепатоцитом в желчный капилляр (каналец). Секреция осуществляется в зоне микроворсинок, к мембранам которых очень близко прилегают лизосомы и аппарат Гольджи. По современным воззрениям, желчные канальцы, микроворсинки, прилегающие к ним лизосомы и пластинчатый комплекс составляют желчьсекретирующий аппарат. Этот аппарат секретирует билирубин, холестерин, желчные кислоты, электролиты, воду и другие компоненты желчи. Характерной особенностью желчного канальца является его полная изоляция от кровеносных капилляров.
Тонкий механизм секреции желчи предусматривает выделение холестерина, желчных кислот и пигментов, а также фосфолипидов (в основном лецитина) в виде специфического макромолекулярного комплекса, или желчной мицеллы. Соотношение этих четырех основных компонентов, составляющих мицеллу, в нормальных условиях достаточно постоянно и обеспечивает растворимость компонентов. Ведь холестерин почти нерастворим в воде, плохо растворим в растворе желчных солей, но сочетание желчных кислот и лецитина резко повышает растворимость холестерина. Желчные кислоты, а также хлорид натрия в значительной мере определяют осмотическое давление желчи, а следовательно, и экскрецию воды из гепатоцита. За сутки выделяется около 600 мл желчи. Строгие соотношения, необходимые для растворимости компонентов желчной мицеллы, объясняют уязвимость процессов желчной секреции и последующей желчединамики. Секреция желчи, а значит, и формирование мицеллы часто нарушаются: в результате патологических сдвигов в гормональной регуляции холестерино- и фосфолипидогенеза: при беременности (особенно в III триместре), реже - в менопаузе, а также при приеме гормональных препаратов (тестостерон, пероральные противозачаточные средства и др.). Воспалительно-дистрофические изменения гепатоцитов, в частности гладкого эндоплазматического ретикулума, лизосом и канальцевых мембран, при многих острых, а нередко и при хронических заболеваниях печени приводят к грубым нарушениям секреции желчи, что усугубляется поражением мельчайших желчных ходов. Как и при упомянутых выше гормональных нарушениях, может развиться желтуха (см. ниже).
Знание ультраструктуры гепатоцита и, в том числе, размещения в нем ферментов становится необходимым в клинической практике, в частности в диагностике синдромов и заболеваний печени, в объяснении патогенеза ряда болезней печени (синдром Рея, болезнь Гоше и др.) и в оценке эффективности лечения.
4. Основные клинико-лабораторные синдромы при болезнях печени
Функциональные пробы печени основаны на лабораторных и частично на радионуклидных методах исследования; они отражают состояние органа в целом, характеризуют отдельные его функции или целостность структурных элементов.
Понятие "функциональные пробы печени" в последние годы расширилось и углубилось. Наряду с традиционными лабораторными тестами в настоящее время они включают ферменты сыворотки крови, а также (с некоторыми оговорками) маркеры вирусов гепатита А и В и иммуноглобулины.
Предложено несколько классификаций функциональных проб печени, в частности деление проб по чувствительности: высокочувствительные, умеренно чувствительные, малочувствительные.
Функциональные пробы классифицируются в связи с определенным видом обмена. Выделяются тесты, характеризующие - белковый, пигментный, липидный, углеводный и другие виды обмена. Ранее это деление было наиболее распространено.
В настоящее время представляется более целесообразным классифицировать пробы по синдромному принципу, т. е. по сущности нарушений гепатобилиарной системы, которые эти пробы отражают. Выделяют следующие синдромы:
- цитолитический синдром;
- синдром малой недостаточности печени, гепатодепрессивный синдром, гепатопривный синдром;
- мезенхимально-воспалительный синдром, синдром повышенной активности мезенхимы, иммуновоспалительный синдром;
- холестатический синдром, синдром нарушения секреции и циркуляции желчи;
- синдром портокавального шунтирования печени, синдром "отключения" печени;
- синдром регенерации и опухолевого роста печени.
Кроме индикаторов основных синдромов, выделяется специальная группа лабораторных тестов, куда входят маркеры вирусов гепатита.
Эту классификацию мы использовали еще в 1968 г. Постепенно она вытесняет все остальные. Главное ее достоинство в том, что она помогает определить полноценный набор тестов для обследования больного. Желательно у каждого больного определять индикаторы всех классов, а дальше проводить детализацию отдельных синдромов. Так, например, если у больного подозревается обтурация общего желчного протока, то необходимо особенно тщательно определять индикаторы холестатического синдрома. Если подозревается острый гепатит, то в первую очередь прибегают к индикаторам цитолитического и мезенхимального синдромов, а также исследуют маркеры вирусов гепатита. Наконец, при подозрении на хронический активный гепатит выполняется программа, указанная для острого гепатита, в дополнение к ним исследуются иммуноглобулины и более детально - индикаторы гепатодепрессивного синдрома.
Такой диагностический подход позволяет сразу установить наличие определенных синдромов или, наоборот, исключить их. В этом его основная клиническая ценность.
Этой классификации мы придерживались при изложении наиболее распространенных функциональных проб печени.
При функциональном исследовании печени учитывается (насколько возможно) масса функционирующего органа или масса его функционирующей паренхимы. В несколько упрощенном виде клиническая практика использует постулат: чем меньше печень, тем ниже ее функциональные возможности. Сразу упоминаем о двух исключениях из этого правила: абсолютном - увеличение печени за счет опухолевой ткани неблагоприятно и относительном - резко выраженная алкогольная гепатомегалия совершенно неполноценна в функциональном отношении. Масса печени зависит от возраста.
5. Объем исследования
Функциональное обследование, призванное ответить на основной вопрос - здоров человек или болен (в частности, в отношении гепатобилиарной системы), выполняется по заранее намеченной программе. Наиболее часто в эту программу включают исследования следующих компонентов сыворотки крови: билирубин, АсАТ, АлАТ, щелочная фосфатаза (или γ-глутамилтрансфераза), холестерин, общий белок, калий, натрий, глюкоза, креатинин. Не все из этих исследований, естественно, относятся к функциональным пробам печени. Просто этот набор тестов представляет собой наиболее распространенную программу отсеивающего, или скринингового, исследования. По этому принципу сформулирован набор тестов в лабораторных автоматах типа "Техникон".
При подозрении на конкретное заболевание или синдром за основу берется та же стандартная программа, но лечащий врач должен обязательно сделать индивидуализированные дополнения. Дополнения, соотнесенные с конкретной клинической ситуацией, изложены ниже.
6. Сроки выполнения исследований
Полноценное биохимическое обследование больного с желтухой неясного происхождения в конце 3-й недели заболевания дает в 3 раза менее точный ответ, чем эти же исследования на 3-й день болезни. При желтухе второе исследование желательно произвести через 2-3 дня, третье - спустя 4-5 дней после второго. При таких темпах динамического обследования ряд диагностических трудностей удается разрешить.
Многие острые нарушения проходимости желчных путей, а также острые интоксикации алкоголем сопровождаются подъемом концентрации билирубина и особенно резким повышением активности ряда ферментов сыворотки крови (глутаматдегидрогеназа, аспартатаминотрансфераза и др.), часто только в течение первых 1-3 сут. Например, у больного с неполной обтурацией камнем желчного протока и рецидивирующим холангитом резкий подъем билирубина, а также активности глутаматдегидрогеназы и аминотрансфераз сыворотки крови продолжается нередко всего 24-36 ч. Если исследовать кровь через день после приступа, т. е. через 48 ч, то билирубин и активность ферментов будут близки к норме. Исследование в этом случае не помогает клиницисту, а дезориентирует его.
Исследования стеркобилина в кале дают некоторую диагностическую информацию лишь в период нарастания или стабильно высокой (136,8-171,0 ммоль/л) гипербилирубинемии. При снижающейся или невысокой гипербилирубинемии это исследование даст нормальный результат, который также может привести к ошибочным толкованиям природы желтухи.
Таким образом, сроки выполнения функциональных проб печени, этапы болезни, на которых они произведены, нередко играют важную, а иногда и решающую роль в получении диагностической информации.
7. Печеночные ферменты в сыворотке
ФЕРМЕНТЫ СЫВОРОТКИ КРОВИ |
Среди функциональных проб печени все большее значение приобретает определение активности ферментов сыворотки крови. В отдельных клинических лабораториях крупных стационаров выполнение этих тестов составляет половину работы биохимического сектора. Нам представляется необходимым знакомство с некоторыми данными, касающимися этих веществ, включая систематизацию ферментов сыворотки крови.
Под изоферментами подразумевают ферменты, которые катализируют распад одинаковых субстратов, но существенно различаются по физико-химическим свойствам. Изоферменты могут вырабатываться разными органами, например изоферменты щелочной фосфатазы и до известной степени лактатдегидрогеназы. Часть изоферментов аспартатаминотрансферазы размещается в цитоплазме, а часть - в митохондриях клетки.
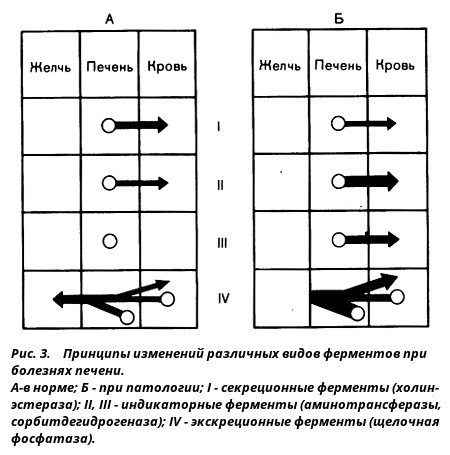
Наиболее распространено следующее деление [Richterich R., 1963] ферментов, используемых в диагностических целях (рис. 3).
- Секреционные, или плазмаспецифические, ферменты синтезируются органоидами гепатоцита (в основном рибосомами) и в нормальных условиях сецернируются в плазму крови, где они играют определенную физиологическую роль. К этим ферментам относятся холинэстераза (псевдохолинэстераза), большая часть прокоагулянтов и церулоплазмин. При повреждении печени и, в частности, ее рибосомального аппарата активность секреционных ферментов отчетливо снижается. Эта закономерность прослеживается при циррозах, "шоковой печени" и других заболеваниях.
- Индикаторные (так называемые клеточные) ферменты. К ферментам этой группы относят аминотрансферазы (трансаминазы), глутамат-, сорбит-, лактатдегидрогеназы, орнитин-карбамоилтрансферазы и ряд других ферментов. Большинство из них в нормальных условиях находится в плазме крови в относительно небольших количествах. При патологических процессах, сопровождающихся распадом клеток, активность этих ферментов возрастает во много раз. Индикаторные ферменты - главные и наиболее надежные показатели цитолитического синдрома в печени (см. ниже).
- Экскреционные ферменты производятся в печени (лейцинаминопептидаза) либо как в печени, так и в других органах (щелочная фосфатаза). В нормальных условиях эти ферменты выделяются в сыворотку крови и в желчь. Механизм выделения этих веществ изучен не полностью. При патологических условиях, особенно при затрудненном оттоке желчи, возрастает продукция этих ферментов и их активность в сыворотке крови увеличивается. Если прежде главная роль в повышении активности экскреционных ферментов отводилась затрудненной экскреции их в желчь (например, при механической желтухе), то в последние годы все большее значение отводится увеличению продукции этих ферментов гепатоцитами и эпителием мельчайших желчных протоков. При таком подходе суть самого термина "экскреционные ферменты" становится уязвимой.
Такие вещества, как билирубинглюкуронид, холестерин, желчные кислоты, β-липопротеиды, ведут себя в патологических условиях, в первую очередь при холестазе, подобно экскреционным ферментам.
В последние годы предпринимается попытка разделения ферментов по их преимущественной локализации в гепатоците. Выделяются: 1) цитоплазматические, 2) митохондриальные, 3) лизосомальные, 4) рибосомальные ферменты.
Это разделение ферментов представлено выше в разделе клинической морфологии печени. Большинство ферментов расположено не в одном, а в нескольких отделах гепатоцита, и обычно указывается лишь преимущественная локализация одного из изоферментов.
Деление ферментов на органоспецифические и органонеспецифические весьма условно. Из ферментов, широко применяемых в клинической практике, к органоспецифическим относят глутаматдегидрогеназу, сорбит(идитол) дегидрогеназу и др. Было бы ошибочным предполагать, что эти ферменты представлены только в клетках печени, в небольших количествах они встречаются и в других органах и тканях. Как уже указывалось, "органоспецифичность" фермента имеет относительное диагностическое значение. Главное диагностическое качество фермента - это его чувствительность как индикатора соответствующего синдрома.
В последние годы открыты [Nagamine М., Bieweng J., 1980, и др.] новые формы ферментов - макромолекулярные комплексы (макроферменты). Пока известны комплексы лишь отдельных ферментов - щелочной фосфатазы, лактатдегидрогеназы, креатининфосфокиназы и амилазы. Они представляют собой своеобразное соединение фермента с иммуноглобулином или липопротеином.
Макроферментам присущи две особенности:
- из-за более медленной деградации фермента его активность может оставаться повышенной существенно дольше обычного (иногда много месяцев);
- при электрофоретическом и хроматографическом определении изоферментов выявляется атипичная полоса активности.
Макроферменты выявляются редко. A. Wilhelm, U. Gerlach с сотр. (1982) на 4000 определений щелочной фосфатазы обнаружили макроферменты в 20 случаях.
Название фермента обычно складывается из названия субстрата (т. е. вещества или части молекулы, которые преобразует данный фермент) с прибавлением суффикса "аза". Так, фосфатаза гидролизирует фосфорные эфиры, аргиназа катализирует гидролиз аргинина и т. д.
В других случаях название фермента указывает на его функцию. Так, дегидрогеназы катализируют отрыв водорода, трансферазы способствуют переносу химических групп с одной молекулы на другую либо с одного отдела молекулы на другой. Часть ферментов сохранила свои традиционные названия: трипсин, катепсин и др.
В августе 1961 г. была принята классификация, согласно которой ферменты делятся на 6 основных классов. Однако в окончательном виде с принятой теперь нумерацией это деление получило права гражданства в 1972 г., когда Комиссия по номенклатуре биохимической и прикладной химии (УИРАС) предложила "Правила номенклатуры ферментов", выделив при этом:
| Таблица Период полураспада ферментов в плазме крови | ||
| Фермент | Фермент (полное название) | Период полураспада |
| - | Амилаза | 3-6 ч |
| АлАТ (ГПТ) | аланинаминотрансфераза | 47 ± 10 ч |
| АсАТ (ГОТ) | аспартатаминотрансфераза | 17 ± 5 ч |
| ГГТФ (ГГТП) | γ-Глутамилтрансфераза | 3-7 сут |
| ГЛДГ | глутаматдегидрогеназа | 18 ± 1 ч |
| ЛДГ1 (ГБДГ) | лактатдегидрогеназа (1) | 113 ± 60 ч |
| ЛДГ5 | лактатдегидрогеназа (5) | 10 ± 2 ч |
| ХЭ | холинэстераза | Около 10 сут |
| ЩФ | щелочная фосфатаза | 3-7 сут |
- Оксиредуктазы. Активируют или выполняют гидрогенизацию и дегидрогенизацию, т. е. переносят водород и электроны и катализируют биологическое окисление.
- Трансферазы. Осуществляют перенос функциональных групп (амино-, сульфа- и др.).
- Гидролазы. Осуществляют гидролитические реакции, катализируют гидролитическое расщепление. Ферменты этой группы называются в соответствии с типом разрываемой связи (например, эстеразы).
- Лиазы. Осуществляют присоединение по двойной связи (например, декарбоксилаза).
- Изомеразы. Выполняют изомеризацию.
- Лигазы (синтетазы, или синтазы). Синтезируют связи с помощью макроэргических фосфоангидридных соединений.
Согласно этой классификации, каждый фермент имеет свой шифр: первое число обозначает главный класс; второе число указывает на подкласс; третье число характеризует подподкласс; четвертое число - порядковый номер фермента.
Сравнительно мало распространенные ферменты обозначаются очень различно, и иногда трудно понять, идет речь об одном и том же ферменте или о разных. Приведенный порядковый номер устраняет подобные сомнения.
При оценке активности патологического процесса в печени, особенно при острых заболеваниях, необходимо учитывать скорость падения активности фермента в плазме крови (табл. 12).
Важно отметить, что при повреждении печени синтез одних ферментов нарушается значительно (АлАТ и др.), других (АсАТ, ЛДГ и др.) - существенно меньше.
8. Индикаторы цитолитического синдрома
Цитолиз - один из основных показателей активности патологического процесса в печени. Представление об остром гепатите будет неполноценным без данных о состоянии цитолитического компонента. То же можно сказать и об активной стадии хронического воспалительного процесса в печени. Значение выявления цитолиза при заболеваниях печени нельзя переоценить, так как активность патологического процесса в печени - важнейшая характеристика большинства заболеваний этого органа. В связи с этим функциональным пробам, относящимся к цитолитическому синдрому, отведено в изложении первое место.
Установление причин цитолиза, как правило, играет важную роль в понимании существа патологического процесса в печени. Мы веделяем ряд механизмов цитолитического синдрома.
- Преимущественно токсический (цитотоксический) цитолиз (прямое повреждающее действие этиологического агента):
- вирусный;
- алкогольный;
- лекарственный.
- Иммуноцитолиз (действие этиологического агента опосредуется иммунопатологическими реакциями):
- вирусное, алкогольное и лекарственное поражение;
- аутоиммунный (наследственно обусловленный?).
- Гидростатический цитолиз:
- при развитии желчной гипертензии;
- при развитии гипертензии в системе печеночных вен.
- Гипоксический цитолиз (синдром "шоковой печени" и др.).
- Опухолевый цитолиз.
- Нутритивный цитолиз:
- при резком дефиците энергетической ценности пищи (общее голодание);
- при выраженном дефиците отдельных компонентов питания (например, недостаток цистина и токоферола - парциальное голодание).
При оценке цитолиза учитываются некоторые биологические и химические особенности самих ферментов.
L-идитолдегидрогеназа содержится в гепатоцитах в относительно небольших количествах, остальные ферменты (АлАТ, глутаматдегидрогеназа) - в больших количествах. Ферменты, расположенные в цитоплазме, обычно сравнительно легко проникают через клеточную мембрану (АлАТ, ЛДГ, изоцитратдегидрогеназа и др.). Ферменты, сосредоточенные как в цитоплазме, так и в органоидах, проникают через клеточную мембрану с разной скоростью. Сравнительно легко попадают в кровоток, например, АсАТ и малатдегидрогеназы, расположенные как в цитоплазме, так и в митохондриях. Аналогично попадает в кровоток изоцитратдегидрогеназа, представленная цитоплазматическим и митохондриальными компонентами, но активность этого фермента в сыворотке крови определяет в основном цитоплазматический изофермент. Чисто митохондриальным ферментом является глутаматдегидрогеназа. Несмотря на очень большую молекулярную массу, этот фермент проходит через клеточную мембрану относительно легко, свидетельством чему являются резкие подъемы активности фермента в первые же часы обтурации общего желчного протока. Несколько медленнее проникают через клеточную мембрану ферменты, сосредоточенные на мембранах клетки и клеточных органоидов. К ним относятся γ-глтамилтрансфераза (γ-глутамилтранспептидаза), а также ферменты другого класса - щелочная фосфатаза, 5-нуклеотидаза.
Ряд лекарств влияет на гиперферментемию. Так, кортикостероидные гормоны, в частности преднизолон, обычно отчетливо снижают активность индикаторных ферментов, в первую очередь аминотрансфераз. Эндогенное ингибирование одних ферментов (γ-глутамилтрансфераза) и индукция других (β-глюкуронидаза) наблюдаются при беременности.
8.1. ОСНОВНЫЕ ФЕРМЕНТЫ - ИНДИКАТОРЫ ЦИТОЛИТИЧЕСКОГО СИНДРОМА
| Таблица 1. Нормы основных ферментов - индикаторов цитолитического синдрома | ||||
| Название и код фермента | Метод определения | Традиционные единицы | Единицы СИ | |
| первона- чальный вариант, мкмоль/ (ч·л) | оконча- тельный вариант, нмоль/ (с·л) | |||
| Аланинамино-трансфераза (2.6.1.2) | Реакция с 2,4-ди-нитрофенилгид-разином (Райтмана - Френкеля, Пасхиной) | 7-40 | 0,1-0,68 | 28-190 |
| По оптическому тесту Варбурга | 7-40 | 2-25 | 30-420 | |
| Аспартатамино- трансфераза (2.6.1.1) | Реакция с 2,4-ди-нитрофенилгид-разином (Райтмана - Френкеля, Пасхиной) | 7-40 | 0,1-0,45 | 28-125 |
| По оптическому тесту Варбурга | 7-40 | 2-20 | 30-330 | |
| γ-Глутамил- трансфераза (2.3.2.2) | С субстратом γ- глутамил II-нитроанилидом | Мужчины 15-106 Женщины 10-66 | М 15-106 Ж 10-66 | 250-1770 167-1100 |
| Биотест "Лахема" | 0,9-6,5 | |||
| Глутаматдегидрогеназа (1.4.1.2) | По оптическому тесту Варбурга | 0-0,9 | 0-0,9 | 0-15 |
| L-идитолдегидро- геназа (1.1.1.14) | Реакция с резорцином (Севела, Товарека) | 0-0,02 | 0-5,6 | |
| По оптическому тесту Варбурга | до 0,9 | 0-0,9 | 0-15 | |
| Лактатдегидрогеназа (1.1.1.27) | Реакция с 2,4-динитрофенил гидра- зином (Севела Товарека) | 100-340 | 0,8-4,0 | 220-1100 |
Изложение начинаем с наиболее распространенных в клинической практике ферментов (табл. 1).
Эти 6 ферментов достаточно широко применяются в клинической практике. Другие ферменты (о них сообщается ниже в более краткой форме) какой-либо новой существенной диагностической информации не несут и применяются обычно только для решения частных задач.
- Аминотрансферазы (2.6.1.2, 2.6.1.1)
- γ-Глутамилтрансфераза (2.3.2.2)
- Глутаматдегидрогеназа (1.4.1.2)
- Идитолдегидрогеназа (сорбитдегидрогеназа) (1.1.1.14)
- Лактатдегидрогеназа (1.1.1.27)
РЕДКО ОПРЕДЕЛЯЕМЫЕ ФЕРМЕНТЫ - ИНДИКАТОРЫ |
- Орнитин-карбамоилтрансфераза (2.1.3.3)
- Альдолаза (фруктозо-1,6-фосфатальдолаза, фруктозодифосфаталь-долаза, 4.1.2.13)
- Монофосфофруктоальдолаза (фруктозо-1-фосфатальдолаза)
- Малатдегидрогеназа (1.1.1.37)
Изоцитратдегидрогеназа (1.1.1.42)
Алкогольдегидрогеназа (1.1.1.1)
- Аргиназа (3.5.3.1)
- β-Глюкуронидаза (3.2.1.31)
- Гуаниндеэаминаза, гуаназа (3.5.4.3)
- Аргининосукцинатлиаза (4.3.2.1)
- Катепсин D, кислая эндогенная протеаза (3.4.23.5)
Ниже кратко представлены принципы дополнительного обследования в зависимости от предполагаемой причины цитолиза.
| Методы распознавания патогенеза цитолитического синдрома | |
| Предполагаемое происхождение цитолитического синдрома | Дополнительные методы исследования, необходимые для уточнения причины цитолиза |
| 1. В основном токсическое: | |
| вирусное | Антитела к вирусу гепатита А класса иммуноглобулина М Маркеры гепатита В. Индикаторы мезенхимально-воспалительного синдрома (тимоловая проба и др.) |
| алкогольное | Определение ГГТФ, ГЛДГ, мочевой кислоты |
| лекарственное | Определение ГГТФ, ГЛДГ, ЩФ |
| 2. В основном иммунные нарушения | Определение иммуноглобулинов сыворотки крови, Т- и В-лимфоцитов периферической крови |
| 3. Гидростатические нарушения: | |
| при желчной гипертензии | Определение ГГТФ, ГЛДГ, ЩФ, 5-НТ Проведение ретроградной холангиографии |
| при гипертензии в системе печеночных вен | Определение центрального венозного давления, эхокардиография, веногепатикография |
| 4. Гипоксический цитолиз (синдром "шоковой печени") | Повторное определение холестерина, холинэстеразы сыворотки, сулемовой пробы, а также альдостерона и кортизола |
| 5. Опухолевый цитолиз | Определение ГГТП, ГЛДГ, ЩФ, ЛДГ. Определение α-фетопротеина, карцино-эмбрионального антигена. Поиски первичного очага опухоли |
| 6. Нутритивный цитолиз: | |
| в результате общего голодания | Контроль за массой тела, определение общего белка, альбуминов, азота аминокислот |
| в результате парциального голодания | То же, включая определение цистина |
9. Индикаторы гепатодепрессивного (гепатопривного) синдрома, или малой недостаточности печени
Тесты этой группы являются родоначальниками всех функциональных проб печени. Они сохраняют свое значение в полной мере и поныне. В клинической практике временами (конечно, ошибочно!) пробы этого класса относят к второразрядным. Дело в том, что многие лечебные учреждения используют, с одной стороны, сравнительно малоинформативные индикаторы гепатодепрессивного синдрома (протромбиновый индекс и др.), с другой - одновременно применяют вполне современные индикаторы других классов. Естественно, современные пробы оказываются в диагностическом плане существенно полезнее, что рождает ошибочное мнение об убывающем значении индикаторов гепатодепрессивного синдрома. Между тем в большинстве случаев определить истинную тяжесть состояния печеночного больного, верно прогнозировать реакцию печени на оперативное вмешательство или токсичную химиотерапию, предвидеть надвигающуюся большую печеночно-клеточную недостаточность можно исключительно или главным образом при помощи проб этого класса.
Под синдромом малой печеночной недостаточности мы подразумеваем любые нарушения функции печени без энцефалопатии, а под большой печеночной недостаточностью - такие нарушения функции печени, которые приводят к энцефалопатии. Кроме того, при большой печеночной недостаточности индикаторы гепатодепрессивного синдрома изменены существенно грубее, чем при малой. В первую очередь это заметно по содержанию прокоагулянтов, а в клиническом плане - по выраженности геморрагического синдрома.
Предложенный нами совместно с И. В. Мартыновым термин "гепатодепрессивный синдром", или "гепатодепрессия" для обозначения малой печеночной недостаточности дает возможность четко выделить две основные фазы печеночной недостаточности: малая печеночная недостаточность - гепатодепрессия; большая печеночная недостаточность - гепатаргия.
Возвращаясь к гепатодепрессивному синдрому, необходимо подчеркнуть, что собственно функциональные пробы обычно связаны не с одной, а с несколькими функциями этого органа, хотя с одной из них наиболее тесно. Эти взгляды послужили основанием для обозначения этого класса лабораторных тестов как "интегральные пробы". Их называют также собственно функциональными пробами печени, индикаторами синтетической и метаболической функции печени.
Пробы этой группы мы будем излагать в традиционном плане.
Индикаторы гепатодепрессивного синдрома делятся на нагрузочные пробы и на пробы, в основе которых лежит установление концентраций (активности) различных компонентов сыворотки крови.
При выполнении нагрузочных тестов ценную информацию нередко дает исследование печеночного клиренса. Это понятие ввел А. Е. Lewis в 1948 г. Под печеночным клиренсом обычно подразумевают объем плазмы крови, которую печень может очистить в течение 1 мин. Различают абсолютный клиренс (количество миллилитров плазмы, очищенных за 1 мин) и относительный, или фракционный, клиренс (процент объема плазмы, очищенной за 1 мин). При определении клиренса необходимо знать объем плазмы. Обычно при вычислении подразумевают, что исследуемое вещество целиком выделяется печенью.
9.1. ПОКАЗАТЕЛИ ВЫДЕЛИТЕЛЬНОЙ (ПОГЛОТИТЕЛЬНО-ВЫДЕЛИТЕЛЬНОЙ) ФУНКЦИИ ПЕЧЕНИ
Пробы, входящие в эту группу, относятся к нагрузочным тестам. В них используются главным образом красящие вещества. Большинство проб (бромсульфалеиновая, индоциановая) - высокочувствительны.
В последние годы предложено много новых методик этих проб и математической обработки полученных результатов.
| Таблица. Проба с индоцианом зеленым при различных болезнях печени (в процентах) | ||||
| Заболевание | 3,56 мин и менее | 3,57- 4,5 мин | 4,5- 6,5 мин | более 6,5 мин |
| Ферментопатические гипербилирубинемии (n = 11) | 90,9 | 9,1 | ||
| Жировая дистрофия печени (n = 49) | 28,6 | 34,6 | 22,4 | 14,3 |
| Хронический персистирующий гепатит (n = 16) | 37,5 | 37,5 | 18,8 | 6,2 |
| Хронический активный гепатит (n = 19) | 15,8 | 10,5 | 42,1 | 31,5 |
| Цирроз печени (n = 92) | 6,5 | 13,0 | 26,0 | 54,4 |
| Рак печени (n = 15) | 13,3 | 13,3 | 33,3 | 40,0 |
Связано это с желанием четко разделить фазы поглощения и выделения краски из организма. Однако для повседневной клинической практики необходимы простые формы выражения результатов исследования. Большинство предлагаемых новых методик этому требованию не отвечает, а дополнительная информация, получаемая в результате значительного усложнения формы проб, не находит существенного клинического использования, т. е. не Влияет заметно на выбор метода лечения и прогноз. В связи с этим большинство новых усложненных методов выполнения этих проб, которые нужны главным образом для научно-исследовательских целей, в книге не приводятся. Традиционное выполнение большинства проб, связанных с поглотительно-выделительной функцией печени, дает достаточно ценную диагностическую информацию.
- Бромсульфалеиновая проба [показать]
- Индоциановая (вофавердиновая, уевердиновая проба) [показать]
Бромсульфалеиновая и индоциановая пробы зарекомендовали себя как надежные индикаторы гепатодепрессивного синдрома. Во всех случаях, когда можно выполнить пробу с нагрузкой и нужно определить функцию печени, мы отдавали предпочтение одной из этих проб (табл.).
При склонности больного к аллергическим реакциям предпочтение отдавалось индоциану зеленому. При плохом состоянии кубитальных вен и несколько беспокойном поведении больного мы предпочитали выполнять бром-сульфалеиновую пробу, так как в подобной ситуации нельзя исключить небольшое запаздывание с очередным взятием крови. Такая ошибка не скажется существенно на результатах бромсульфалеиновой пробы, но отчетливо исказит итог пробы с индоцианом зеленым. Наконец, при некоторых врожденных нарушениях обмена билирубина (синдром Дубина - Джонсона и др.) важную диагностическую информацию дает только бромсульфалеиновая проба.
9.2. Бромсульфалеиновая проба
Проба Розенталя - Уайта, проба с нагрузкой тетра-бромфенолфталеином (БСФ-проба) предложена в 1925 г. A. Rosenthal, Е. White.
Связи бромсульфалеина (БСФ) с белком, транспортировка этого комплекса и выделение в желчь напоминают биотрансформацию низкомолекулярных веществ (билирубин и др.). БСФ значительно изменяется, проходя печень. Около половины его выделяется из печени в виде соединений с цистеином и глутатионом. Очень небольшое количество краски, не более 10%, непостоянно выделяется через почки. При заболеваниях печени, нарушенном поглощении краски печенью и замедленном поступлении в желчь количество краски, выделяемой через почки, может резко возрастать.
Принцип пробы. Краска выделяется печенью в желчь. При заболевании печени очищение крови от краски замедляется.
Методика. Утром натощак медленно и равномерно вводят внутривенно 5% стерильный раствор бромсульфалеина (дисульфонат натрия тетрабромфенолфталеина - Bromthalein фирмы "Merck", Bromsulfan фирмы "Berlin Chemie") из расчета 5 мг/кг. В качестве растворителя можно использовать стерильную дистиллированную воду. Через 3 мин после окончания вливания из локтевой вены другой руки берут 10 мл крови. Через 45 мин после окончания вливания берут еще 10 мл крови (негемолизированной!)
Для определения бромсульфалеина [Hoffman Н. et al., 1959, и др]. используют микрометод. Здоровая печень экстрагирует из плазмы 10-16 мг краски в минуту. После внутривенного введения краска появляется в дуоденальном содержимом через 15 мин, достигая там максимальной концентрации между 45-й и 76-й минутой. В течение 2 ч в желчь выделяется 75% введенной краски. В крови в норме через 15 мин остается максимум 25%, а через 45 мин - около 5% краски (по Н. Popper и F. Schafner, 6%).
Проба считается отрицательной (т. е. ее результат относится к нормальным), если через 45 мин в крови остается не более 5% краски. Задержка более 6% краски - положительный (патологический) результат пробы.
По данным Н. Andree, Н. Brendt (1984), изредка у здоровых людей наблюдается задержка краски до 8%. Наши наблюдения показывают, что задержка выделения краски в небольших пределах (6-8%) может встречаться и у здоровых и эти небольшие отклонения от нормы должны оцениваться с известной осторожностью.
| Таблица 16. Бромсульфалеиновая проба при различных болезнях печени (в процентах) | ||||||
| Заболевания | 5,0 и ниже | 5,1- 10,0 | 10,1- 20,0 | 20,1- 30,0 | 30,1- 40,0 | 40,1 и выше |
| Ферментопатические гипербилирубинемии Жильбера (n = 11) | 100 | |||||
| Дубина-Джонсона (n = 1) | 100 | |||||
| Жировая дистрофия печени (n = 111) | 41,4 | 35,1 | 18,9 | 2,7 | 1,8 | |
| Хронический персистирующий гепатит (n = 29) | 44,8 | 5,2 | 3,4 | |||
| Хронический активный гепатит (n = 39) | 10,3 | 38,5 | 33,3 | 15,4 | 2,6 | |
| Хронический холангиогепатит (n = 30) | 20,0 | 23,3 | 36,7 | 10,0 | 6,7 | 3,3 |
| Цирроз печени (n = 164) | 3,7 | 9,1 | 22,6 | 25,0 | 14,6 | 25,0 |
| Рак печени (n = 32) | 12,5 | 12,5 | 15,6 | 12,5 | 18,7 | 28,1 |
По другим методикам кровь из вены берут через 30 мин после нагрузки и результаты получают приблизительно те же.
Осложнения при проведении пробы. Тромбофлебиты и флеботромбозы в месте введения краски наблюдаются приблизительно в 0,4-0,6% всех введений. Для предотвращения этих осложнений рекомендуется хранить ампулы с краской в теплом месте (предупреждение кристаллизации), пользоваться тонкими иглами и, наконец, после вливания не сгибать руку в локте. Гемолитические реакции на введение краски встречаются редко.
В сводной статистике, охватывающей 8 работ, общетоксические осложнения наблюдались в 7 случаях, в том числе в одном - тяжелые.
Клиническое значение нарушений выделительной функции печени. При поражении печени процесс выделения БСФ удлиняется на 10-100% пропорционально тяжести поражения печени.
Результаты наших совместных с Ю. Н. Сурниным, И. К. Ряпосовой и С. Н. Гуриным исследований бромсульфалеиновой пробы представлены в табл. 16.
К хроническому холангиогепатиту мы относили хронические воспалительные заболевания печени, развившиеся в связи с задержкой эвакуации желчи по внепеченочным желчным путям.
Бромсульфалеиновая проба применяется главным образом при безжелтушных заболеваниях; поскольку замедленное выделение краски наблюдается при самых небольших поражениях печени, она долго остается патологической после окончания желтушного периода острого вирусного гепатита, положительна при большинстве форм хронических гепатитов, а также при циррозе печени. Важное значение имеют результаты бромсульфалеиновой пробы при жировой дистрофии печени: при прогрессирующей достаточно интенсивной жировой дистрофии проба указывает на патологию, при выраженной, стабильной жировой дистрофии она нормальна.
Патологический результат пробы может зависеть от уменьшения печеночного минутного объема (застойные явления). Как и другие пробы, связанные с выделительной функцией, бромсульфалеиновая проба изменена при механической желтухе. Это связано с нарушением оттока желчи, поэтому задержку выделения до 12% у больных с желтухой не следует рассматривать как проявление недостаточности функции печени. На скорость выведения бромсульфалеина могут влиять также диспротеинемии внепеченочного происхождения. При неосложненных гемолитических желтухах бромсульфалеиновая проба нормальна.
Как уже упоминалось, эта проба относится к наиболее ценным функциональным пробам печени.
Наиболее существенным недостатком метода считалась невозможность применить его для дифференциальной диагностики паренхиматозных и механических желтух, так как при гипербилирубинемии выше 44,2 мкмоль/л (2,5 мг%) проведение пробы технически сложно.
Определение печеночного клиренса при помощи бромсульфалеина. Даже при нормальном состоянии печени небольшая часть краски может выделяться через почки, а при патологии печени почки экскретируют значительное количество краски. В связи с этим Н. Popper и F. Schaffner считают не всегда обоснованным применение термина "клиренс" к бромсульфалеиновому методу определения скорости поглощения краски печенью. Определение печеночного клиренса при помощи бромсульфалеина разработали. R. Goodman, G. Kingsley (1953). Метод приводится в изложении Ю. Минку, Н. Гурбан.
Больных, голодавших 12 ч, взвешивают утром, а затем берут у них 5 мл крови из правой локтевой вены. Тем же способом и при помощи той же иглы им вводят 5% раствор тетрабромсульфонфталеина в количестве 5 мг/кг. Вливание продолжается 30 с. Вслед за этим берут кровь из левой локтевой вены с промежутками в 5, 15, 25, 45 и 75 мин. Взятую кровь центрифугируют и определяют концентрацию краски и клиренс при помощи математических таблиц. В норме средний фракционный клиренс составляет 13,8 ± 1,32%, т. е. за 1 мин очищается 13,8% плазмы. Очищение у половины обследованных заканчивалось через 40-50 мин. Средний фракционный клиренс: для цирроза печени - 3,46 ± 0,37%, для хронического гепатита - 6,0 ± 0,44%.
По аналогичной методике определяют так называемую массу функционирующей паренхимы печени [Anderson Е. et al., 1963, и др.].
Проба Товея - Сондоре дает возможность ориентироваться в скорости поглощения и скорости выделения краски. Вводят внутривенно 0,3 мл 5% раствора краски. Спустя минуту при отсутствии аллергических реакций вводят основное количество краски из расчета 10 мг/кг. Далее из вены извлекают кровь для исследования через 3, 7, 12, 20 и 60 мин.
Первая фаза кривой именуется быстрой и отражает резкое падение концентрации краски в сыворотке крови, вторая фаза, медленная, соответствует отрезку плавного снижения кривой.
Исследуются полупериоды элиминации краски в обеих фазах. Т1/2 быстрой фазы равен в норме 6,6-6,8 мин. Этот показатель отражает скорость захвата краски печенью, т. е. в общем близок к показателю печеночного клиренса.
Т1/2 медленной фазы в норме равен 14,5-27,1 мин. Этот показатель отражает скорость конъюгации краски в гепатоците и темпы ее транспорта в желчь.
Методика Товея-Сондоре существенно сложнее пробы Уайта-Розенталя. Пока она широкого распространения не получила. Чаще для раздельного определения поглотительной и выделительной функции печени в клинической практике используются радионуклидные методы (гепатография - см. гл. 11).
В связи со сравнительно нередкими аллергическими реакциями при введении значительных доз бромсульфалеина все шире используется краска, меченная йодом-131. При этом вводится 2-20 мг препарата вместо обычных 400-700 мг.
9.3. Индоциановая проба
Индоциан зеленый (вофавердин, уевердин) - синтетическая краска, близкая по механизму выделения к бромсульфалеину, но имеющая ряд особенностей. Индоциан зеленый (ИЦЗ) не поглощается внепеченочными клеточными мембранами, и потому его внепеченочные потери практически равны нулю. Он проходит через печень, не подвергаясь конъюгации (связыванию). Максимальная выделительная способность почечных канальцев в отношении ИЦЗ существенно ниже, чем в отношении бромсульфалеина. Элиминация ИЦЗ происходит быстрее, чем бромсульфалеина. Наконец, гемолиз не влияет на определение концентрации краски в сыворотке крови. Все эти преимущества дополняются еще одним, очень существенным - практически не наблюдается побочных эффектов внутривенного введения раствора индоциана.
Методика. Свежеприготовленный водный раствор зеленого индоциана в дозе 0,25-0,5 мг/кг вводят в вену. Через 3 мин и через 20 мин определяют концентрацию краски. Предложен расчет доз по площади поверхности тела-10 мг/м2, что приблизительно соответствует 0,25 мг/кг.
Ко времени второго исследования в норме в сыворотке крови должно оставаться не более 4% краски.
Другой вариант методики. В локтевую вену ставят постоянную канюлю. ИЦЗ вводится из расчета 0,3 мг/кг. Для определения исходного показателя берут 4 мл крови, далее в течение 30 с вводят краситель и после окончания введения извлекают из вены по 5 мл крови через 3, 4, 7 мин. После каждого взятия крови следует промыть канюлю изотоническим раствором хлорида натрия. Норма периода полувыведения 3,56 мин.
Предложены различные методики. Так, I. Gemore и сотр. (1982) при проведении индоциановой пробы предлагают определять клиренс, периоды полувыведения, скорость фракционного выделения, объем распределения.
Однако введение дополнительных показателей пока не принесло существенной дополнительной информации в клиническом плане, и потому их внедрение в широкую практику осуществляется медленно.
9.4. ТЕСТЫ, ХАРАКТЕРИЗУЮЩИЕ ОБЕЗВРЕЖИВАЮЩУЮ ФУНКЦИЮ ПЕЧЕНИ
- Aнтипириновая проба
Успехи в индикации функции микросомальной фракции гепатоцита и стремление оценивать систему цитохрома Р-450 и других его соединений породили большое количество новых, далеко не равноценных по клинической значимости проб, построенных на этом же принципе. В частности, в 1983 г. предложена кофеиновая проба, один из вариантов которой приводится ниже.
- Кофеиновая проба
- Проба Квика (проба на синтез гиппуровой кислоты)
отражает состояние важнейшей метаболической, или биотрансформационной, функции микросом гепатоцитов (в частности, цитохрома Р-450) и в последние годы получает все большее распространение. Проба выполнима у больных как гипербилирубинемией, так и с нормальными концентрациями билирубина сыворотки крови. Антипириновая проба в модификации Л. И. Геллера и сотр. (1982). Методика. Антипирин в дозе 10 мг/кг обследуемые принимают внутрь в 100 мл воды утром натощак. Эта доза антипирина меньше высшей разовой пероральной дозы (1 г), разрешенной ГФ для взрослых. До введения препарата и через 2, 4, 6 и 24 ч после него из локтевой вены берут по 5 мл крови. Концентрацию антипирина в сыворотке определяют спектрофотометрическим методом [Brodie В., Axelrod J., 1950). Учитывая начальные концентрации (С0) и зная использованную дозу, вычисляют сначала объем распределения препарата (Vd) по формуле Нормальный клиренс антипирина 36,8 ± 1,4 мл/мин. Имеется много модификаций в выполнении и регистрации результатов этой пробы. Период полувыведения антипирина в норме по S. Holomon и соавт. (1984) 12,7 ± 4,6 ч. Сопоставимые результаты получила группа польских исследователей [Adamska-Dyniewska S.et al., 1984] - Т1/2 = 13,5 ± 2,4 ч. Упрощает пробу при более сложной технике определения антипирина новый метод, предложенный М. Dosing и сотр. (1982). Внутривенно вводят раствор, содержащий 1 г антипирина, и однократно берут кровь через 24 ч. Концентрация антипирина определяется газохроматографическим методом. Расчет осуществляется с помощью микрокалькулятора по формуле: где D - доза антипирина в миллиграммах; C1 - концентрация антипирина в миллиграммах на литр; t1 - время в минутах, т. е. 1440 мин (сутки); Vd - объем распределения. Vd рассчитывается как 0,2363 X BW (масса в килограммах) + 0,1962 X ВН (рост в сантиметрах) - 0,272 X возраст (в годах) - 10,26. Этот расчет предназначен для женщин. Для мужчин расчет таков: Vd = 0,3625 X BW + 0,2239 X ВН - 0,1387 X возраст - 14,47. Нормальный клиренс антипирина по этому методу 58,7 ± 4,8 мл/мин. Авторы метода [A. Dosing и сотр., 1982] определили средние показатели клиренса. Он оказался равным при циррозе печени 11,8 мл/мин; при жировом гепатозе - 43,3 мл/мин. Используя определение антипирина в слюне, А. С. Логинов, Э. А. Бендиков, А. В. Петраков и соавт. (1983) обнаружили у больных неактивными формами цирроза печени снижение клиренса до 10,47 ± 0,92 мл/(ч·кг) при норме 43,9 ± 2,38 мл (ч·кг). Антипириновая проба - очень чувствительный и клинически надежный тест. Кофеин метаболизируется в печени при помощи цитоxpома Р-448 [Klinker Н., Soeres R. et al., 1984]. Клиренс кофеина отражает одну из оксидативных функций печени, связанных с цитохромами Р-448. Преобразование кофеина снижается при заболеваниях печени. По мнению авторов пробы, ее ценность заключается в том, что она расширяет возможности исследования цитохромной системы печени, которая пока ограничена исследованиями цитохрома Р-450. Методика. В течение 12 ч обследуемый не принимает кофеин и не употребляет продукты, богатые кофеином. Далее он принимает 400 мг кофеина моногидрата (в оригинальном изложении - 2 таблетки Cascan). Кровь берут перед приемом лекарства и спустя 1/2, 1, 2, 4, 6, 8, 12, 24 ч. Концентрация кофеина в сыворотке крови определяется газохроматографически. Результаты. Принятый внутрь кофеин всасывается практически полностью. Норма - 60-160 мл/мин. У больных острым гепатитом, холестазом и особенно циррозом печени наблюдается отчетливое снижение клиренса, достигающее 80%. Пока широкого клинического испытания эта проба, как и другие такого же класса, например проба с гексобарбиталом [Soeres R., Klinker Н., 1984], не прошли. В кофеиновой пробе настораживают большие дозы препарата, способные вызвать побочные явления. Доза ,
Vd = ------,
Сo а затем - клиренс антипирина (в миллилитрах в минуту) по обычно используемой формуле [Branch R.et al., 1976, Harman A.et al.; 1979]: 0,693
клиренс = Vd X ------
T1/2 In(D/Vd) - InC1
Клиренс = ------------------X Vd,
t1
При соединении гиппуровой кислоты с глицином образуется бензойная кислота. При пероральной нагрузке 4 г бензоата натрия нормальным считается выделение 3-3,5 г гиппуровой кислоты или более 60-65% максимально возможного.
Ряд обстоятельств - синтез части гиппуровой кислоты в почках, синтез части глицина в кишечнике, различное всасывание бензоата натрия в тонком кишечнике - делают эту пробу в диагностическом отношении очень ненадежной, почему она и не выполняется в гепатологических отделениях.
9.5. ТЕСТЫ, СВЯЗАННЫЕ С СИНТЕЗОМ ПРОКОАГУЛЯНТОВ И АНТИСВЕРТЫВАЮЩИХ КОМПОНЕНТОВ СИСТЕМЫ КРОВИ
С давних пор известна повышенная кровоточивость при заболеваниях печени. Большинство факторов, участвующих в свертывании крови, - фибриноген; протромбин, акцелерин, проконвертин, антигемофилические факторы - в основном производятся в печени, хотя следует допустить их частичное образование вне печени. Большинство коагулирующих агентов (прокоагулянтов) принадлежит к глобулинам или к гликопротеидам с электрофоретическими качествами, близкими к α1- и α2-фракциям глобулинов, в синтезе которых велика роль печени. Антикоагулирующие факторы в основном относятся к альбуминам и также синтезируются большей частью в печени. При экспериментальной гепатэктомии довольно быстро снижается протромбиновая активность. Особенно быстро кровоточивость повышается при эвисцерации (удаление всех органов брюшной полости). Основными лабораторными показателями являются:
- Протромбиновое время по Квику
- Фибриноген по Клаусу
- Проба Коллера
Проба Коллера. В ответ на введение витамина К при паренхиматозной желтухе незначительно и непостоянно повышается протромбиновая активность, а при механической отчетливо повышается протромбин по Квику. Проба выполнима только при достаточно низком исходном уровне протромбиновой активности (70% и ниже).
Методика. Определяют протромбиновую активность, затем внутривенно или внутримышечно вводят 10 мг витамина К. Через 24- 36 ч снова определяют протромбиновую активность. Ее повышение на 20-50% характерно для механической желтухи. Отсутствие отчетливого повышения говорит о паренхиматозной желтухе. В этом случае P. Wappler (1963) рекомендует вводить еще 10-40 мг витамина К. Если через 24 ч подъема протромбина не наблюдается, то есть тяжелые паренхматозные повреждения.
Определение протромбиновой активности по Квику, использованное первоначально Коллером, часто заменяют определением изолированного протромбина и особенно проконвертина.
Как уже указывалось, решающее значение в выявлении подпеченочной (обтурационной) желтухи придается инструментальным методам исследования, поэтому проба Коллера теряет свое значение.
9.6. ИНДИКАТОРЫ ГЕПАТОДЕПРЕССИИ, СВЯЗАННЫЕ С СИНТЕЗОМ БЕЛКА
- Альбумины сыворотки крови
При легком и среднетяжелом остром вирусном гепатите уровень альбуминов снижается редко и незначительно, при тяжелом и затяжном - существенно чаще. Для оценки особенностей течения этого заболевания данный показатель играет малую роль. При ферментопатических гипербилирубинемиях, хроническом персистирующем гепатите и жировых дистрофиях концентрация альбумина обычно оказывается нормальной. Исключение составляет немногочисленная группа больных алкоголиков с острой жировой печенью (состояние, близкое острому алкогольному гепатиту), у которых концентрация альбумина значительно снижается.
Известно, что альбумин снижается как при первичных заболеваниях печени, так и при вторичных поражениях, в частности при голодании, сепсисе, новообразованиях, а также при синдроме нарушенного всасывания различного генеза. Обычно гипоальбуминемия при заболеваниях печени (за исключением случаев, когда многократно выпускали асцитическую жидкость) развивается постепенно. Быстрое (в течение 1-2 мес) и значительное снижение концентрации альбумина, особенно в сочетании с нарастающей гипопротеинемией (т.е. без одновременного роста γ-глобулинов), более характерно для быстропрогрессируюшей злокачественной опухоли (например, злокачественной лимфоме), чем для заболевания печени. Таким образом, учитывая сравнительно большой период полураспада альбумина, не следует ожидать резких изменений теста при острых поражениях печени, особенно в начальной фазе заболевания. Как функциональная проба - индикатор гепатодепрессии тест достаточно надежен, но недостаточно чувствителен. В связи с относительно малой чувствительностью теста его патологические результаты имеют в определенной мере прогностически неблагоприятное значение. Это исследование необходимо выполнять перед большими плановыми операциями и химиотерапией. В последние годы появились предложения модифицировать альбуминный тест, чтобы учитывать структурную изменчивость белка [Троицкий Г. В. и др., 1981; Рыбалко А. И. и др., 1982, и др.] В частности, Г. Ю. Ажицкий, Г. В. Троицкий, Т. К. Шараева и др. (1984) выделили фракции сывороточного альбумина необычной щелочной реакции. В норме щелочная фракция не превышает 3-4% общей концентрации альбумина. При циррозе печени в некоторых случаях эта фракция возрастает до 50%. Пока модификации альбуминового теста в клиническую практику не внедрены.
- Фибринонектин
Фибронектин - гликопротеид (или комплекс гликопротеидов), синтизируемый в основном печенью. В этом процессе участвуют купферовские клетки, поэтому фибронектин с известными оговорками рассматривается как индикатор функции системы купферовских клеток. Фибронектин - компонент соединительной ткани, выполняющий структурные функции. Определяется иммуноферментным методом.
Норма 323 ± 76,5 мг/л [Титов В. Н. и др., 1985], 332,9 ± ± 8,6 мкг/мл [Scully М. et al., 1982].
Колебания концентрации фибронектина пытаются использовать для определения темпов регенерации. Пока конструктивных результатов в этом направлении не получено. Этот белок резко снижается при шоке, при диссеминированном внутрисосудистом свертывании. Содержание фибронектина снижается при тяжелых заболеваниях печени. Особенно значительное снижение наблюдали М. Gonzales-Calvin и соавт. (1982) - в среднем до 117,9 ± 19,4 мкг/мл при молниеносной печеночной недостаточности у больных вирусными и лекарственными острыми гепатитами. По данным этих исследователей, не удалось обнаружить корреляции между результатами исследования фибронектина и повышением активности аспартатаминотрансферазы, но обнаружена корреляция с гипербилирубинемией. Т. Gluid и соавт. (1983) не обнаружили изменения содержания фибронектина в сыворотке больных острым алкогольным гепатитом и жировой дистрофией печени.
- Комплемент
К комплементам относится группа белков, вырабатываемых печенью; они играют важную роль в реакциях гуморального иммунитета.
Обычно различают общий комплемент, т. е. суммарное содержание белков этой группы, и отдельные фракции, обозначаемые номерами. Наиболее четкая прямая связь с функцией печени прослеживается у третьей (С3 и особенно четвертой (С3) фракций. Последняя синтезируется в печени и легких.
Общий комплемент и отдельные его фракции определяются иммунологическими методами.
Норма: общий комплемент (по Е. Kabat и соавт.) - 75-160 мИЕ/мл, фракция С'' 70 ± 2,2 уcл. ед. [Пясик М. В., Джалалова В. А., 1985], фракция С (радиоиммунодиффузионный способ) 141,2 ± 14,9 мг%. Набор "Boehringer" 15-45 мг %.
Значительные нарушения общего комплемента наблюдаются при наследственных заболеваниях, а также при синдромах, относимых к иммунной патологии.
Снижение уровня общего комплемента, фракции С3 и особенно С4 наблюдается при тяжелых формах острых вирусного, алкогольного и лекарственного гепатитов, хроническом активном гепатите и циррозе печени. В частности, при исследовании С3 мы совместно с В. А. Джалаловой, М. В. Пясик и А. С. Ивлевым получили следующие результаты: при хроническом персистирующем гепатите -63,4 ± 4,4 уcл. ед., при хроническом активном гепатите - 59,4 ± 4,4, и при циррозе печени - 53,0 ± 3,8. Хотя синтез большей части С4 происходит в печени, понять причину снижения С сыворотки крови не всегда легко. Пока расход комплемента трудно поддается учету. Системность его потребления в первую очередь зависит от особенностей иммунных процессов, а также от своеобразия гемокоагуляционных явлений.
В частности, при остром вирусном гепатите и хроническом активном гепатите в связи с энергичным образованием комплексов антиген - антитело в части случаев однозначно оценивать результаты этих тестов затруднительно [Duphuy С., Duphuy S., 1977].
Снижение уровня общего комплемента и особенно его фракции С4 рассматривается специалистами ряда стран (Франция и др.) как ценный диагностический признак, особенно при хронических заболеваниях печени [Алажвиль Д., Одьевр М., 1982, и др.].
- α1-Антитрипсин
α1-Антитрипсин - гликопротеид, относимый к α1-глобулинам. Белковая часть составляет 84-88%, углеводная - 12-16% и включает в себя галактозу, маннозу, ацетилглюкозамин и др.
В среднем, по данным Е. Jones и соавт. (1978), печень производит антитропсин в количестве 38,6 ± 6,3 мкг/(кг·сут). Период полураспада 3,8-7,2 дня. Этот гликопротеид тормозит действие трипсина, хемотрипсина, эластазы, калликреина, катепсинов и других ферментов и тканевых протеаз.
Антитриптическая активность сыворотки крови на 90% связана с α1-антитрипсином [Kahn М. et al., 1977, и др.].
Норма α1-антитрипсина (по Ф. И. Комарову, Б. Ф. Коровкину, В. В. Меньшикову) 37,04-74,08 мкмоль/л (200-400 мг/100 мл).
Клиническое значение. Содержание антитрипсина в сыворотке крови повышается при воспалительных и необластических процессах, а также при беременности [Callea F. et al., 1984, и др.]. Особый интерес представляют случаи снижения содержания α1-антитрипсина. Оказалось, что не очень редки стертые формы врожденной антитрипсиновой недостаточности. У детей обнаруживаются различные формы поражения печени, включая ранние холестазы. У 1-2% больных развивается цирроз [Soeger Т., 1976, и др.].
Встречаются также поражения других органов, в первую очередь легких (ранняя эмфизема и др.). Значительно менее определенные данные получены в отношении приобретеннной антитрипсиновой недостаточности при заболеваниях печени, но постепенно накапливаются и такие факты. Как известно, достаточно широкое распространение получила реинфузия извлеченной из брюшной полости асцитической жидкости у больных с большим резистентным к мочегонной терапии асцитом. Описаны также нередкие осложнения этих процедур. Наиболее частым и наиболее грозным из них является коагулопатия потребления, нередко с повышенной кровоточивостью. Установлено [Tilsner К. Reuter Н., 1981, и др.], что уменьшение содержания α1-антитрипсина в сыворотке крови и особенно в асцитической жидкости одна из основных причин этих коагулопатий.
- Церулоплазмин
Церулоплазмин - гликопротеид, относящийся к α2-глобулинам.
Норма по Ф. И. Комарову, Б. Ф. Коровкину, В. В. Меньшикову (1981) 1,52 ± 3,31 мкмоль/л (23-50 мг %).
Закономерное снижение содержания церулоплазмина, связанное с врожденным дефектам обмена меди, наблюдается при гепатоцеребральной дистрофии (болезнь Вильсона - Коновалова). Реже такая же картина наблюдается при тяжелых формах острого гепатита, цирроза и опухолей печени.
Применение теста пока ограничивается заболеваниями, подозрительными в отношении болезни Вильсона - Коновалова.
- Холинэстераза (ложная, или неспецифическая, холинэстераза, 3.1.1.8)
Принятые сокращения: ХЭ, БХЭ, ChE, SChE.
Этот фермент активирует реакцию: ацетилхолин <---> уксусная кислота + холин.
Два фермента расщепляют ацетилхолин на холин и уксусную кислоту. Один из них был назван истинной холинэстеразой, или ацетилхолинэстеразой, другой - ложной холинэстеразой, или бутирилхолинэстеразой. При заболеваниях печени, как впервые в 1938 г. обнаружили W. Antopol и сотр., диагностическое значение имеет в основном определение бутирилхолинэстеразы. В последние годы обычно для обозначения бутирилхолинэстеразы пользуются термином "холинэстераза", а для обозначения истинной холинэстеразы - "ацетилхолинэстераза". Такими обозначениями мы и будем пользоваться в дальнейшем. Холинэстераза по сравнению с ацетилхолинэстеразой расщепляет большое число субстратов, т. е. в химическом отношении она менее специфична. Ацетилхолинэстераза определяется обычно в эритроцитах.
Холинэстераза встречается почти во всех тканях, но особенно много ее в плазме крови, поджелудочной железе и печени. Период полураспада холинэстеразы большой - около 10 дней. Фермент относится к α2-глобулинам, синтезируется в основном в рибосомах шероховатой эндоплазматической сети гепатоцитов. Уменьшение холинэстеразной активности, таким образом, отражает угнетение протеосинтетической функции печени.
Норма активности холинэстеразы сыворотки крови: по A. Dietz и соавт. 4,9- 11,9 мИЕ/мл, по Westgard и соавт. 7-19 мИЕ/мл, по Vincet, Segonsac 45-65 уcл. ед., по Herzfeld, Stumpf 44-100 уcл. ед., по Ammon 140-200 уcл. ед., по О. А. Пономаревой - 0,350-0,500 мг ацетилхолина или по Т. В. Правдич-Неминской (модификационный метод) 35-50 уcл. ед. Венсана и Сегонзака.
Активность холинэстеразы наиболее резко изменяется (снижается) при тяжелых хронических заболеваниях печени, особенно при циррозе.
Значительное снижение активности холинэстеразы наблюдается при распространенных бластоматозных поражениях печени. В начальных стадиях обтурационной желтухи снижение активности холинэстеразы встречается очень редко. При инфаркте миокарда резкое падение активности холинэстеразы отмечается к концу первых суток заболевания. А. А. Покровский предполагает возможность образования продуктов некроза участка миокарда с выраженным антихолинэстеразным действием. По нашему мнению, гипохолинэстераземия, наблюдаемая при коронарной катастрофе, обусловлена шоком, который приводит к тяжелому повреждению печени (центридольковые некрозы).
Отравления фосфорорганическими соединениями (инсектициды, ОВ) сопровождаются выраженным снижением холинэстеразы. Курареподобные вещества (дитилин, сукцинилхолин и др.), применяемые в хирургии для расслабления мышц, обычно быстро разрушаются, преимущественно холинэстеразой сыворотки. Тяжелые последствия применения этих средств возможны как при приобретенном недостатке холинэстеразы (чаще при хронических заболеваниях печени), так и при врожденном ферментном дефекте.
При нефротическом синдроме наблюдается повышение активности холинэстеразы. Это явление связано, возможно, с повышением синтеза альбуминов печенью из-за быстрой потери мелкодисперсной фракции белков. Повышение холинэстеразы наблюдается также иногда при ожирении и экссудативной энтеропатии. Если твердо придерживаться мнения о печеночном происхождении холинэстеразы, то повышенное содержание этого фермента при ряде заболеваний указывает на возможность гиперфункции (перераздражения?) печени приблизительно так же, как наблюдается гиперфункция (перераздражение) гастродуоденальной системы при язвенной болезни. В последние годы другие методы исследования (радионуклидная гепатография, антипириновый тест и др.) также констатируют признаки гиперфункции печени при ряде патологических состояний. В таких случаях можно пользоваться термином "раздраженная печень". Речь, по-видимому, идет об индукции (повышении активности) ферментов гладкой и шероховатой эндоплазматической сети в связи с постоянным раздражением этих систем избыточным количеством поступающего субстрата. Этим субстратом могут быть продукты жирового и белкового обмена, нередко им оказывается алкоголь. По мере внедрения чувствительных индикаторов гепатодепрессии врач все чаще сталкивается с синдромом раздраженной печени.
В последнее время исследование этого фермента широко внедряется для определения функции печени и контроля за применением релаксантов в хирургической практике.
Большой период полураспада и относительно невысокая чувствительность фермента к ряду повреждений печени несколько снижают его диагностическое значение, особенно- для выявления начальных симптомов острой печеночно-клеточной недостаточности. Однако среди индикаторов гепатодепрессивного синдрома средней тяжести исследование холинэстеразы наиболее доступно в техническом отношении.
9.7. ИНДИКАТОРЫ ГЕПАТОДЕПРЕССИВНОГО СИНДРОМА, СВЯЗАННЫЕ С УГЛЕВОДНЫМ ОБМЕНОМ
Сахарные кривые после нагрузки глюкозой не имеют практического значения и к функциональным пробам печени не относятся. Также не производится нагрузка левулезой (фруктозой). Иное положение сложилось с галактозными нагрузками.
Галактозная проба
Методика. 40 г галактозы, растворенной в 200 мл теплой воды, выпивают натощак; затем трижды с 2-часовыми интервалами определяется галактозурия. По В. Е. Предтеченскому норма 2,5 г; Holler и сотр. снижают ее до 2 г, a Fissenger - до 1,5 г. Даже такое снижение не делает эту пробу достаточно чувствительной [Мясников А. Л., 1956; Предтеченский В. Е., 1960]. Мы считали нормой 2,5 г.
По нашим наблюдениям, эта проба редко бывает положительной у больных хроническим персистирующим гепатитом и малоактивным циррозом печени. Несколько чаще (у 55%) она оказывается положительной при острых вирусных гепатитах и острых гепатитах другой этиологии. Из-за низкой чувствительности эту пробу в последние годы практически не используют, хотя специфичность теста привлекала внимание исследователей и изучение превращений галактозы продолжается.
В последние годы установлено [Tygstrup N. et al., 1983, и др.], что печень ассимилирует галактозу со скоростью в среднем 0,7 ммоль/мин.
Проба с внутривенной нагрузкой галактозой по В. Tengstrom (1966). Внутривенно вводят 25-40% раствор галактозы из расчета 350 мг/кг (введение продолжается не более 3 мин). Исследуют сыворотку крови до введения галактозы, а также через 3, 6, 12, 18, 24 мин после введения.
Полупериод поглощения поступившей галактозы из сыворотки крови в норме равен 13,0 ± 2,5 мин.
Проба оказывается патологической у большинства больных острыми гепатитами и опухолями печени и особенно при выраженных формах цирроза печени. В первые недели подпеченочной (обтурационной) желтухи обычно регистрируются нормальные результаты. Так, A. Wassel с сотр. (1984) при обследовании 16 больных с доказанной подпеченочной (обтурационной) желтухой у 15 (94%) определили нормальную длительность поглощения галактозы из крови. Лишь у одного, страдавшего активным холангитом, поглощение галактозы было замедленно. Несмотря на высокую оценку ряда исследователей, проба пока широкого распространения не получила, главным образом из-за технических трудностей выполнения.
10. Индикаторы синдрома повышенной активности мезенхимы, или мезенхимально-воспалительного синдрома
Большинство острых, а также активных хронических заболеваний печени протекает с повреждением гепато-цитов, и следовательно, с цитолитическим синдромом, а также с повреждением мезенхимы и стромы печени, что и составляет суть мезенхимально-воспалительного синдрома. В развитии последнего большая роль принадлежит взаимодействию мезенхимальной системы с поступающими вредоносными веществами и микроорганизмами из кишечника. Часть из них является антигенами. Антигенная стимуляция кишечного происхождения наблюдается и в нормальных условиях, но особо значительных размеров она достигает при патологических состояниях.
| Таблица. Индикаторы мезенхимально-воспалительного синдрома | ||
| Тест | Метод | Нормы |
| γ-Глобулин сыворотки крови | Электрофорез на бумаге | 14,0-22,5% или 0,8-1,7 г % в системе СИ 8-18 г/л |
| Осадочные реакции: | ||
| тимол-вероналовая (тимоловая) | По Маклагану | 0-7,0 уcл. ед. и ниже |
| По Венсану - Сегонзаку | 3-30,0 уcл. ед. и ниже | |
| По Коларову - Тодорову | 3-40 уcл. ед. и ниже | |
| сулемовая | По Гринстеду | 1,9 уcл. ед. и выше |
| Иммуноглобулины сыворотки крови: | ||
| IgA | По Манчини | В среднем 155(97- 213) мИЕ/мл |
| Радиоиммунодиффу- зионный | 90-450 мг/100 мл | |
| IgG | По Манчини | В среднем 156(78- 236) мИЕ/мл |
| Радиоиммунодиффу- зионный | 565-1765 мг/100 мл | |
| IgM | По Манчини | В среднем 157(105- 207) мИЕ/мл |
| Радиоиммунодиффу- зионный | Муж. 60-250 мг /100мл Жен. 70-280 мг/100мл | |
| IgD | По Манчини | В среднем 17-100 мИЕ/мл |
| Радиоиммунодиффу- зионный | 0-15 мг/100 мл | |
| Оксипролин белковый плазмы крови | По Leroy | 8,3 ± 0,3 мкг/мл |
| Оксипролин свободный в моче | По Stadler | 1,30 ± 0,17 мг/сут |
| Оксипролин, пептидносвязанный в моче | По А. А. Крелю | 23,8 ± 1,60 мг/сут |
| Проколлаген-III-пептид | Радиоиммунологический | 6,4 ± 0,6 нг/мл |
Антигенная стимуляция, естественно, касается не только элементов печени, более того, в нормальных условиях ее внепеченочный компонент намного превосходит печеночный. Однако при многих заболеваниях печени резко возрастает роль печеночного компонента. Наряду с "традиционными" участниками (купферовские клетки и пр.) антигенного ответа активная роль в его возникновении принадлежит лимфоиднo-плазматическим и макрофагальным элементам, входящим в инфильтраты, прежде всего портальных трактов.
В результате реакции мезенхимальных элементов, а также компонентов мощных инфильтратов, локализованных в портальных трактах и самих дольках, возникают различные нарушения гуморального и клеточного иммунитета.
Сложные нарушения клеточного иммунитета у больных с заболеваниями печени в книге излагаться не будут. Эти данные можно получить в других источниках [Джалалова В. А., 1986, и др.]. Индикаторы повреждения мезенхимально-стромальных элементов печени в сочетании с некоторыми показателями гуморального иммунитета с давних пор рассматривались как тесты повышенной активности мезенхимы [Markoff W., 1962; Emmrich R., 1964, и др.]. В последние годы эти тесты стали считать индикаторами воспалительного синдрома [Подымова С. Д., 1984, и др.]. Нам представляется целесообразным объединить эти термины и говорить об индикаторах мезенхимально-воспалительного синдрома.
К индикаторам мезенхимально-воспалительного синдрома - продуктам реакции на кишечную антигенную стимуляцию - относится часть ингредиентов гуморального иммунитета с определенными оговорками. Значение иммунных нарушений, входящих в мезенхимально-воспалительный синдром, оценивается все более и более высоко. Появляются предложения [Beorchia S. et аl. 1982, и др.] заменить термин "индикаторы мезенхимально-воспалительного синдрома" термином "маркеры иммунной активности", куда сторонники термина относят также иммуноглобулины, часть гликопротеинов, включая β2-гликопротеины.
На наш взгляд, согласиться с этим предложением трудно, так как при таком подходе из синдрома исключаются компоненты соединительной ткани (оксипролин, проколлаген-III-пептид и др.), значение которых в оценке патологических процессов печени также возрастает.
В дальнейшем, по мере большего использования иммунологических исследований, этот синдром, возможно, будут называть иммуновоспалительным.
Индикаторы мезенхимально-воспалительного синдрома используются как для диагностики (особенно при остром вирусном гепатите, хроническом активном гепатите и циррозе печени), так и для оценки фазы заболевания, активности патологического процесса, определения показаний к лечению и установлению прогноза.
Лабораторные тесты - индикаторы мезенхимальновоспалительного синдрома - представлены в табл.
10.1. Осадочные пробы
Изложение индикаторов мезенхимально-воспалительного синдрома следует начать с осадочных реакций, потому что в повседневной гепатологической практике, особенно в поликлиниках и городских больницах, они пока еще занимают главенствующее место.
Осадочные реакции отражают изменение концентрации в сыворотке крови не какого-либо одного компонента, а ряда веществ. В частности, на патологические изменения тимол-вероналовой пробы влияет повышение концентрации IgM и IgG, а также липопротеинов сыворотки крови, поэтому специфичность осадочных реакций невелика. Однако многолетняя клиническая практика подтвердила несомненную диагностическую ценность этих реакций, особенно при остром вирусном гепатите и хронических прогрессирующих заболеваниях печени - хроническом активном гепатите и циррозе печени. Важно подчеркнуть техническую доступность и сравнительно малую трудоемкость этих тестов. При оценке результатов этих реакций врач всегда должен помнить об их неспецифичности. Основной диагностический "конкурент" этих тестов γ-глобулин сыворотки крови - пока определяется недостаточно точно, а методики его исследования громоздки и трудоемки. Как правило, лаборатории большинства стационаров, а тем более поликлиник могут выполнять весьма ограниченное количество определений белковых фракций сыворотки крови. По крайней мере до внедрения в практику сравнительно простых, малотрудоемких и технически надежных методов определения γ-глобулина сыворотки крови наиболее ценные в клиническом отношении осадочные реакции (тимол-вероналовая и сулемовая) сохранят свое значение. Все другие осадочные реакции (проба Вельтмана, йодная и др.) полностью утратили свое место в обследовании больных с заболеванием печени.
- Тимоловая (тимол-вероналовая) проба
- Сулемовая проба
Наиболее часто применялася в 20 веке при циррозах печени и хроническом активном гепатите. При циррозе печени патологические результаты выявляются у 70-80% обследованных, причем резко патологические результаты (1 мл и ниже) наблюдаются, как правило, только при далеко зашедших циррозах печени. При хроническом активном гепатите патологические результаты отмечены у 75-80% больных.
10.2. γ-Глобулины
γ-Глобулины сыворотки крови являются одним из основных показателей состояния печени. Однако диагностическая значимость γ-глобулина зависит от выбора методики. При использовании электрофореза на бумаге проба малочувствительна. Тем не менее она входит в число проб, рекомендуемых при заболеваниях печени наряду с определением аминотрансферазы, билирубина.
Отсутствие повышения концентрации γ-глобулина сыворотки крови мало о чем говорит. Во всяком случае по этому признаку нельзя исключить поражение печени.
Прежняя точка зрения об исключительно внепеченочном происхождении гипергаммаглобулинемии имеет мало сторонников. Ныне господствует мнение, что γ-глобулины, особенно при острых и хронических гепатитах, могут производиться также в клетках Купфера и плазматическими клетками воспалительных инфильтратов печени.
Подъем γ-глобулинов отражает активацию гуморального иммунитета. Среди заболеваний печени такое явление наблюдается особенно часто при хроническом активном гепатите и активном циррозе печени.
Особенно значимо повышение содержания γ-глобулинов в диагностике хронического активного гепатита. Не случайно одним из старых названий этого заболевания было "хронический гепатит с гипергаммаглобулинемией". Повышение этого показателя наблюдается у 88-92% больных, причем значительное повышение (26 г/л, или в 1,5 раза по сравнению с верхней границей нормы) наблюдается у 60-65% больных. Почти такие же результаты бывают при высокоактивных циррозах печени. При далеко зашедшем циррозе печени нередко приходится наблюдать, что содержание γ-глобулинов превышает содержание альбуминов. Такое извращение протеинограммы является плохим прогностическим признаком: больные с такими формами цирроза печени, по нашим данным, живут менее 2 лет.
При остром вирусном гепатите умеренные повышения γ-глобулина бывают чаще во второй половине заболевания. При остром лекарственном гепатите очень велик разброс результатов - диагностическое значение гипер-гаммаглобулинемии в большинстве случаев небольшое. При остром алкогольном гепатите у 40% больных отмечается более или менее повышенное содержание γ-глобулина сыворотки крови.
10.3. Иммуноглобулины
Иммуноглобулины являются индикаторами нарушения иммунных процессов, их синтез связан, конечно, далеко не только с состоянием печени. В принципе взаимоотношения иммуноглобулинов и печени приближаются к взаимоотношениям у-глобулинов и печени. Последняя проблема освещена выше. Иммуноглобулины можно считать, "тестами, примыкающими к функциональным пробам печени". Это касается в основном их исследования при острых и хронических заболеваниях печени.
Иммуноглобулины представляют собой семейство структурно сходных белковых молекул, обладающих функцией антител [Петров Р. В., 1982; Андреева Н. А., Чернохвостова Е. В. 1985, и др.].
Основу их структуры составляют легкие и тяжелые цепи, удерживаемые ковалентными (дисульфидными) и нековалентными мостиками. Цепи в свою очередь состоят из доменов. Домен - структурная единица, включающая 110-120 аминокислот. Легкую цепь образуют 2 домена (каппа и лямба), тяжелую - 3-5 доменов. Легкие и тяжелые цепи обычно соединены попарно.
Выделяется 5 классов иммуноглобулинов - IgA, IgG, IgD, IgE, IgM. Наибольшие различия иммуноглобулинов заключены в разнообразии структур их тяжелых цепей. В гепатологической практике широко используется определение IgG, IgM, IgA.
- Иммуноглобулин G (IgG) [показать]
- Иммуноглобулин М (IgM - макроглобулин) [показать]
- Иммуноглобулин A (IgA) [показать]
Предполагают [Dancyger Н. et al., 1983, и др.] существование в известной мере автономной иммунной системы желчных путей.
Наиболее закономерно повышение концентраций иммуноглобулинов сыворотки крови при хронических активных заболеваниях печени. Так, мы (совместно с М. В. Пясик, В. А. Джалаловой и А. С. Ивлевым) наблюдали повышение концентраций иммуноглобулинов у 50-60% больных хроническим персистирующим гепатитом в момент обострения, причем в группе с гипериммуноглобулинемией концентрации IgA равнялись 215 ± 16 мг%, IgG - 1412 ± 70 мг%, a IgM - 237 ± 10 мг%. Таким образом, при хроническом персистирующем гепатите преимущественно вирусного происхождения у части больных бывает гипериммуноглобулинемия за счет IgG, IgM.
При хроническом активном гепатите мы наблюдали повышение концентраций иммуноглобулинов у 85-92% обследованных. У больных с гипериммуноглобулинемией средние концентрации IgA равнялись 337 ± 42 мг/100 мл, IgG -1624 ± 57 мг/100 мл, IgM - 262 ± 57 мг/100 мл, т. е. зарегистрирован наиболее резкий подъем иммуноглобулина М.
Наконец, при циррозах печени мы наблюдали повышение концентрации иммуноглобулинов у 70-75% обследованных, в основном с активными формами заболевания. У больных с гипериммуноглобулинемией средние концентрации IgA равнялись 390 ± 42 мг%, IgG - 2124 ± 139 мг%, IgM - 282 ± 9 мг%.
Таким образом, по сравнению с нормой концентрации IgA при активных циррозах печени повышается в 1,85 раза, IgG - в 2,2 раза и IgM - в 2,9 раза.
Хронические вирусные заболевания печени протекают с преимущественным увеличением IgG и IgM, алкогольные - с увеличением IgA. Для первичного билиарного цирроза особенно характерно увеличение IgM. Как правило, при хронических активных заболеваниях печени наблюдается поликлоновая гипериммуноглобулинемия, т. е. бывают повышены все основные классы иммуноглобулинов (A, G, М), хотя чаще один из них бывает повышен несколько больше других. Начало желтушного периода при острых вирусных гепатитах приблизительно у 80% больных со среднетяжелым и тяжелым течением заболевания сопровождается умеренной гипериммуноглобулинемией. Больше - подъем иммуноглобулина М, меньше - G и А (наши совместно с Г. П. Стуловым, В. Н. Некрасовым. В. М. Пясик наблюдения, а также Сафонова Е. С., Михайлова 3. М., 1979; Желтухин П. А., Щелковская Г. А. и др., 1979, и др.). При тяжелом остром вирусном гепатите мы наблюдали гипериммуноглобулинемию, реже снижение концентрации иммуноглобулинов. Небольшое число таких наблюдений не дало возможности установить причину иммуноглобулинопатии. Осталось неясным: либо у больных с врожденным иммунодефицитом тяжело протекал острый вирусный гепатит, либо тяжелое течение острого вирусного гепатита осложнилось приобретенным иммунодефицитом.
Врожденные и приобретенные состояния иммунодефицита становятся самостоятельной проблемой. Она освещена в обзорах М. С. Балояна (1984), в сборнике "Иммунохимия в клинической лабораторной практике" под редакцией А. Уорда и Дж. Уигера (М.: Медицина, 1981).
Мы коснемся еще лишь одной частной пробемы иммунодефицитных состояний. Известно, что многие лекарственные холестазы возникают и длительно держатся на фоне дефицита иммуноглобулина А.
По-видимому, резкое уменьшение IgA, поступающего в желчь, приводит к неблагоприятному течению воспалительных процессов в мельчайших желчных ходах. Возникают дополнительные нарушения в формировании желчной мицеллы, которые усугубляются прямым токсическим действием лекарств (тестостерон, прогестерон, аймалин и др.) и вирусов гепатита В.
Совместно с А. С. Ивлевым мы наблюдали 3 больных с многомесячной холестатической желтухой и резким снижением иммуноглобулина А сыворотки крови. У одного больного заболевание развилось после курса лечения аритмии аймалином, у другого - после инъекций метил-тестостерона по поводу астенического синдрома, у третьего - на фоне острого вирусного гепатита В. Длительная холестатическая желтуха у этих больных требовала полноценного инструментального исследования, включая ретроградную холангиографию.
Убедившись в правильности своих предположений о холестазе на фоне иммунодефицита и объяснив ситуацию больному, мы терпеливо ожидали окончания желтухи. В одном случае она продолжалась 3,5 мес, в двух других - 5 мес. Все 3 больных выздоровели.
При подпеченочных (обтурационных) желтухах концентрация иммуноглобулинов в большинстве случаев существенно не меняется. Однако к предложению И. Т. Жилкиной (1979) об использовании иммуноглобулинов в дифференциальной диагностике желтушной формы острого вирусного гепатита и подпеченочной (обтурационной) желтухи следует подходить, на наш взгляд, с большой осторожностью.
Важное диагностическое значение имеет выделение моноклональных белков.
Под моноклональным подразумевается белок, который синтезируется одним клоном клеток. Все молекулы такого белка обладают одинаковыми размером, конфигурацией, зарядом. Это обусловливает их однотипную электрофоретическую подвижность, в результате чего моноклональные белки обычно представлены на электрофореграмме одной четкой полосой.
Парапротеины - разновидность иммуноглобулинов, относящаяся к моноклональным белкам. Парапротеины особенно характерны для злокачественных моноклональных гаммапатий или парапротеинемических гемобластозов, куда входят миеломная болезнь (плазмоцитома), макроглобулинемия Вальденстрема, лимфомы с парапротеинемией, болезни тяжелых цепей, трудно классифицируемые формы парапротеинемических гемобластозов.
Моноклональная иммуноглобулинопатия наблюдается также и в отсутствие В-лимфопролиферативных заболеваний. Патогенез подобных моноклональных иммуноглобулинопатий изучен недостаточно.
Н. Е. Андреева, Е. В. Чернохвостова (1985) выделяют вторичную, ассоциированную доброкачественную моноклональную иммуноглобулинопатию, возникающую на фоне различных заболеваний (хронический активный гепатит, цирроз печени и др.), а также идиопатическую, или эссенциальную моноклональную иммуноглобулинопатию у практически здоровых людей. J. Radi (1985) среди причин этого вида моноклональных иммуноглобулинопатий различает доброкачественные В-клеточные опухоли, селективный иммунодефицит, связанный с нарушением равновесия Т- и В-клеток, и, наконец, гомогенную продукцию антител, связанную с особой антигенной стимуляцией. В развитии гаммапатий подобного рода у лиц старше 75 лет Н. Storch и соавт. (1986) подчеркивают значение снижения количеств Т-лимфоцитов по сравнению с В-лимфоцитами. Эти факты представляются значимыми, если учесть частоту доброкачественных парапротеинемий у пожилых людей. К возрасту 90 лет и более моноклональные гаммапатии выявляются у 17-19% обследованных.
Дифференцировка доброкачественной и злокачественной моноклональной иммуноглобулинемии очень сложна. О доброкачественной парапротеинемии можно говорить с достоверностью лишь после 5-10 лет наблюдения за больным, если нет выраженной гиперпротеинемии, в частности иммуноглобулины не превышают 20 г/л, нет снижения других клонов (классов) иммуноглобулинов и лимфоплазмоцитарные клетки в костном мозге не превышают 10%.
В последние годы появляется все больше сведений [Апросина 3. Г., 1980; Андреева Н. Е., 1981; Torre G., Bellver I. et al., 1982, и др.] о возможности развития доброкачественной парапротеинемии у отдельных больных хроническим активным гепатитом и активным циррозом печени. Такими же наблюдениями (приблизительно 1:50 активных хронических заболеваний печени) располагаем также и мы совместно с М. В. Пясик. Наши наблюдения дают основание полностью согласиться с положением, выдвигаемым Н. Е. Андреевой, Е. В. Чернохвостовой: "Клинические и морфологические симптомы относительно ранних стадий Ig-секретирующих лимфом печени и селезенки и хронических гепатитов с парапротеинемией могут быть настолько сходными, что дифференциальный диагноз между ними провести невозможно, даже при использовании всего арсенала современных диагностических средств. Только динамика заболевания проясняет его сущность". Можно добавить, что, к счастью, такие формы встречаются редко.
10.4. Антитела
В последние десятилетия определенное место, в диагностике ряда заболеваний печени приобрели антитела к тканевым и клеточным антигенам, выявляемые главным образом методом иммунофлюоресценции. Подробно этот вопрос освещен в руководстве С. Д. Подымо-вой (1984).
- Антинуклеарные антитела
- Гладкомышечные антитела
- Митохондриальные антитела
Митохондриальные антитела - антитела, реагирующие с гомогенатом митохондрий.
Наибольшее значение имеет обнаружение этих антител при первичном билиарном циррозе. По данным С. Д. Подымовой, они не выявляются у больных с подпеченочной (обтурационной) желтухой. К. Miyachi, S. Watanabe и соавт. (1984) обследовали 22 больных первичным билиарным циррозом. С помощью двойного иммунодиффузионного метода они изучали преципитирующие антитела к митохондриям А (МА), митохондриям В (MB) и митохондриям С (МС) печени крыс. Антитела к МА обнаружены у 12 (54%), а антитела к MB - у 11 (50%) больных первичным билиарным циррозом. Антитела к МС выявлены лишь у 1 больного (4%). Титры преципитирующих антител к МА и MB находились в тесной корреляции с титрами антимитохондриальных антител, определяемых с помощью непрямого иммунофлюоресцентного метода. Эта работа подтверждает, что МА и MB являются маркерами первичного билиарного цирроза. У больных циррозом печени, хроническим активным гепатитом, острым вирусным гепатитом и злокачественной гепатомой этим методом антитела к митохондриям обнаружены не были. Большее распространение получило использование антител к антигену внутренней мембраны митохондрий (МП).
По данным I. Salmon (1984), М. Mans (1985) и других авторов, фракцию МП можно отнести к специфическим индикаторам первичного билиарного цирроза печени.
Широкому распространению метода препятствует его техническая сложность.
10.5. ДОПОЛНИТЕЛЬНЫЕ ИНДИКАТОРЫ МЕЗЕНХИМАЛЬНО-ВОСПАЛИТЕЛЬНОГО СИНДРОМА
В последние годы в клиническую практику начинают внедряться дополнительные индикаторы мезенхимально-воспалительного синдрома
|
Таблица Дополнительные индикаторы мезенхимально-воспалительного синдрома |
||
|
Тест |
Метод |
Норма, мг % |
|
Орозомукоид (α1-кислый гликопротеид) |
Вертикальный иммуноэлектрофорез |
127,0 ± 4,0 |
|
Радиоиммунодиффузионный |
55-140 |
|
|
Гаптоглобин |
Вертикальный иммуноэлектрофорез |
144,0 ± 13,4 |
|
Радиоиммунодиффузионный |
83-267 |
|
|
α2-макроглобулин |
По М. В. Пясик и др. |
175,1 ± 5,6 |
|
Радиоиммунодиффузионный |
Мужчины:
150-350 |
|
- Гаптоглобин и орозомукоид
При отсутствии тяжелых поражений печени гаптоглобин и орозомукоид отражают главным образом мезенхимально-воспалительный синдром.
При активных заболеваниях печени и других органов, протекающих с мезенхимально-воспалительным синдромом, наблюдается рост их концентраций в сыворотке крови. При тяжелых заболеваниях печени (в первую очередь при далеко зашедшем циррозе) эти тесты отражают в основном степень гепатодепрессии, и у большинства таких больных наблюдается отчетливое понижение их концентраций в сыворотке крови [Пясик М. В., Хазанов А. И., Ларский Э. Г., 1977; Fabriova V., Dieska D., 1985, и др.] Содержание гаптoглобина сыворотки крови падает при гемолитических состояниях. Это свойство находит все большее клиническое применение [Бейсембаева Р. У., 1986, и др.].
α2-Макроглобулин играет до известной степени роль ингибитора протеиназ. При циррозах печени, по нашим данным [Пясик М. В., Хазанов А. И., Ларский Э. Г., 1977], концентрации α2-макроглобулина растут пропорционально активности цирротического процесса. При энтеропатиях с нарушением всасывания отмечается снижение его концентраций в сыворотке крови.
Орозомукоид, гаптоглобин, β2-микроглобулин исследуются только в научных целях.
- β2-Микроглобулин (В2-МГ)
Белок с низкой молекулярной массой, близкий по структуре к иммуноглобулинам, представляет собой легкую цепь антигенов HLA, т. е. является одним из белков гистосовместимости. Повышение уровня β2-микроглобулина в сыворотке крови характерно для многих заболеваний, при которых играет роль повышение активности Т- и В-лимфоцитов.
Норма - 0,8-2,4 мкг/мл.
Суточная продукция 100-150 мг, половину производят лимфоциты, другую половину - ряд органов, в том числе печень. Выделяют β2-МГ почки. Концентрация β2-МГ сыворотки крови является гуморальным индикатором активности Т-клеток [Lamelin J. et at., 1982]; к этому следует добавить - в случаях отсутствия недостаточности почек, так как при почечной недостаточности повышение β2-МГ свидетельствует о нарушениях в выведении данного белка.
По данным S. Biorchia, С. Тгеро, С. Vincent и соавт. (1982), повышение содержания β2-МГ отмечено у 45% больных острым вирусным гепатитом, у 85% больных хроническим активным гепатитом и 80% больных первичным билиарным циррозом. При хроническом персистирующем гепатите умеренное повышение наблюдалось лишь у 31% обследованных. Уровень билирубина, γ-глобулина, активности аминотрансфераз не коррелировали с концентрацией β2-МГ в сыворотке крови. Близкие результаты получили Ю. Н. Касаткин и соавт. (1984), которые наблюдали также повышение концентрации β2-микроглобулина у большинства больных острыми вирусными гепатитами В и ни А ни В. У большинства больных острым вирусным гепатитом А содержание данного белка соответствует норме. Тест привлекает к себе все большее внимание.
10.6. Продукты обмена соединительной ткани
Большое значение придается изучению продуктов обмена соединительной ткани разных органов, в частности печени
|
Таблица 25. Продукты обмена соединительной ткани и ферменты, участвующие в этом обмене, используемые в оценке состояния печени [Hahn E.G., 1984] |
|||
|
Продукт обмена или фермент |
Печень |
Сыворотка и плазма крови |
Моча |
|
Пролин |
+ |
+ |
+ |
|
+ |
+ |
+ |
|
|
Пролилгидроксилаза |
+ |
+ |
- |
|
Галактозилгидроксилил |
|||
|
глюкозилтрансфераза |
+ |
+ |
|
|
β-ацетилглюкозаминидаза |
+ |
+ |
+ |
|
Проколлагеновые пептиды: |
|||
|
тип I |
- |
+ |
- |
|
тип III |
+ |
+ |
+ |
|
Уроновые кислоты |
- |
- |
+ |
11. Холестатический синдром
Холестатический синдром характеризуется либо первичным, либо вторичным нарушением секреции желчи. Под первичным нарушением секреции желчи подразумевают повреждения собственно желчьсекретирующих механизмов гепатоцита (например, при интоксикации тестостероном или при доброкачественном холестазе беременных). Вторичное нарушение секреции желчи развивается в случаях желчной гипертензии, которая в свою очередь обычно связана с препятствием нормальному току желчи в желчевыводящих путях.
По нашему мнению, в клиническом плане следует различать два вида холестаза - желтушный (более 95% всех случаев холестаза) и безжелтушный (несколько менее 5% случаев).
Для "классической" желтушной формы холестаза характерны: а) желтуха и кожный зуд; б) гипербилирубинемия, в основном за счет конъюгированной формы пигмента; в) повышение активности ферментов - индикаторов холестаза, таких как щелочная фосфатаза, 5-нуклеотидаза, лейцинаминопептидаза, а также γ-глутамилтрансфераза сыворотки крови; г) повышение содержания липидов (желчные кислоты, холестерин, β-липопротеиды и др.).
Пока не общепризнано существование безжелтушной формы холестаза. Безжелтушный холестаз - предстадия желтушного холестаза, например, при первичном билиарном циррозе безжелтушная стадия может длиться много месяцев и даже несколько лет.
Другим примером безжелтушного холестаза может служить опухоль левого печеночного протока, при которой отмечаются кожный зуд, повышение желчных кислот, гиперфосфатаземия, а гипербилирубинемия долго, а иногда и постоянно отсутствует.
Хотя безжелтушный холестаз является редкостью, практическая значимость этого варианта холестаза велика. В диагностическом плане больных с безжелтушным холестазом приходится признать "неудачниками". Как правило, они длительно лечатся у дерматолога по поводу кожного зуда без заметного эффекта, а исследование желчных кислот, щелочной фосфатазы и γ-глутамил-транспептидазы могли бы сразу указать на гепатогенное происхождение страдания.
Изучение патогенеза синдрома холестаза показывает, что секреция желчи требует от гепатоцита большой затраты энергии и содружественной четкой работы пластинчатого комплекса, лизосом, эндоплазматической сети и мембраны билиарного полюса клетки. Нормальная желчь включает 0,15%холестерина, 1% желчно-кислых солей (холатов), 0,05% фосфолипидов и 0,2% билирубина.
Нарушение нормальных соотноошений компонентов желчи делает невозможным образование желчной мицеллы, а только мицелла обеспечивает оптимальное выведение из гепатоцита всех составляющих, так как большинство этих компонентов плохо растворимо в воде. Исключение составляет конъюгированный билирубин, чем можно объяснить редкие случаи безжелтушного холестаза - билирубин может транспортироваться и вне желчной мицеллы (см. также гл. 2, раздел "Микроворсинки билиарного полюса гепатоцита").
Ряд причин способствует нарушению нормальных соотношений компонентов желчи. Чаще в их основе лежат патологические сдвиги в обмене холестерина. Гиперпродукция холестерина возникает по разным причинам.
Во-первых, это гормональные нарушения. Сюда входят гиперпродукция (эндогенная или экзогенная) плацентарных гормонов, гиперпродукция (эндогенная, но чаще экзогенная) тестостерона, (гипер) гипопродукция эстрогенов. Подобные нарушения нередко наблюдаются в III триместре беременности, при приеме пероральных противозачаточных средств, лечении метилтестостероном и др.
Во-вторых, это нарушение нормальной кишечнопеченочной циркуляции холестерина, желчных кислот, а также других липидов и родственных им веществ. Наиболее частой причиной бывает подпеченочная (обтурационная) желтуха.
По тем же причинам в тесной связи с возникающей гиперхолестеринемией происходит гиперпродукция желчных кислот. Естественно, это касается первичных, т. е. вырабатываемых печенью желчных кислот - холевой и хенодезоксихолевой. В этой ситуации особенно энергично продуцируется хенодезоксихолевая кислота, избыток которой сам по себе способствует холестазу.
Ряд факторов (вирусный гепатит, алкоголь, ряд лекарств) вызывает развитие холестатического синдрома, но точный механизм его возникновения ясен не во всех деталях.
Желтушный холестатический синдром представлен тремя разновидностями. Первые две касаются внутрипеченочного холестаза, третья - внепеченочного (подпеченочного), традиционно именуемого обтурационной желтухой. Эти вопросы детально разбираются в гл. 18.
При обеих разновидностях внутрипеченочного холестаза нарушается секреция холестерина, желчных кислот, билирубина в желчные капилляры. Происходит это в результате либо прямого нарушения секреции желчи гепатоцитом (тип I), либо нарушений реабсорбции воды и других преобразований желчи в мельчайших желчных ходах (тип II).
Характерными примерами холестаза типа I являются гормональные лекарственные (тестостероновые) желтухи, типа II - аминазиновые медикаментозные желтухи, холестатические формы острого вирусного гепатита и др.
Тип III представлен так называемым внепеченочным, вернее, подпеченочным холестазом и связан с внепеченочной обтурацией желчных путей: он возникает в результате механического препятствия в области общего печеночного и общего желчного протоков. Классическим примером такой разновидности холестаза является сдавление опухолью парафатеральной зоны или закупорка камнем общего желчного протока. Особенно выраженный и длительный холестаз приводит к комплексу метаболических нарушений - холемии.
| Таблица 26. Индикаторы холестаза1 | |||
| Тесты сыворотки крови | Метод определения | Норма | |
| в традиционных единицах | в системе СИ | ||
| Щелочная фосфатаза 3.1.3.1 | По А. Боданскому | 2-5 ед. | 139-360 нмоль/(с·л) |
| Автоанализатор | 50-120 ИЕ/л | ||
| 5-Нуклеотидаза 3.1.3.5 | По Т. Диксону и М. Пурдону | 2-17 ИЕ/л | 11 - 122 нмоль/(с·л) |
| Лейцииаминопептидаза (амино-кислотная ариламидаза, нафтиламидаэа, 3.4.11.1) | По Д. Гольдбаргу - К. Гегелю | Муж. 330-700 мИЕ/мл Жен. 330-660 мИЕ/мл или 20-50 ИЕ | 33-100 нмоль/(с·л) |
| Желчные кислоты и их соли: | |||
| дезоксихолевая кислота | Газохромато- графический метод | 0,22 ± 0,13 мкг/мл | 0,56 ± 0,33 мкмоль/л |
| хенодезоксихолевая кислота | То же | 0,31 ± 0,32 мкг/мл | 0,79 ± 0,82 мкмоль/л |
| холевая кислота | " " | 0,20 ± 0,17 мкг/мл | 0,49 ± 0,42 мкмоль/л |
| Конъюгированные кислоты: | |||
| холеглицин | Радиоиммунный | 0,13 ± 0,01 мкг/мл Менее 60 уcл. ед | 0,27 ± 0,03 мкмоль/л |
| хенодезоксихолеглицин | 0,09 ± 0,01 мкг/мл | 0,2 ± 0,03 мкмоль/л | |
| дезоксихолеглицин | 0,03 ± 0,005 мкг/мл | 0,06 ± 0,01 мкмоль/л | |
| сульфолитохолеглицин | 0,03 ± 0,005 мкг/мл | 0,06 ± 0,01 мкмоль/л | |
| 1Билирубин, холестерин, β-липопротеиды, γ-глутамилтрансферазу сыворотки крови, уробилин, желчные пигменты мочи, стеркобилин кала см. в гл. 2 и 4. | |||
11.1. Щелочная фосфатаза (фосфомоноэстераза 1-3.1.3.1)
Принятые сокращения: ЩФ, ФМЭ1, APh, PhME-1.
Фосфатазы - относительно неспецифичные ферменты, расщепляющие органические фосфорные соединения. Часть из них действует в щелочной среде (pH 9,0-10,0), часть - в кислой (pH 5,0). В диагностике заболеваний печени главную роль играет щелочная фосфатаза. Кислая фосфатаза используется в диагностике опухолей предстательной железы. В последние годы ее пытаются использовать в качестве лизосомального индикатора.
Щелочная фосфатаза - цинксодержащий гликопротеид с молекулярной массой около 150 000. Вырабатывается в печени, кишечнике, плаценте, костной системе. Однако печень является главным выделительным органом для этого фермента.
Норма. В дополнение к данным табл. 26 использовались также и иные показатели: по Кингу-Армстронгу - 3-14 уcл. ед., по Г. К. Шлыгину и С. Л. Михлину - 20-30 уcл. ед., по Т. Хаузмену (1967) - 60-170 мИЕ/мл.
При заболеваниях гепатобилиарной системы ведущая роль в развитии гиперферментемии принадлежит фосфатазе печеночного происхождения. При этом наблюдается как задержка ее выведения в желчь, так и (главная причина гиперферментемии) индукция фермента, зависящая от блока кишечно-печеночной циркуляции.
Щелочная фосфатаза относится к мембранно-связанным ферментам. В печени наибольшая активность щелочной фосфатазы обнаружена на плазматической мембране синусоидального полюса и мембранах микроворсинок гепатоцитов. Кроме того, активность фермента регистрируется в эпителии мельчайших желчных ходов. Фермент, продуцируемый в желчных ходах ("фосфатаза желчи"), в отличие от собственно печеночного связан с фосфатидил-холином [Price С. Р., 1972]. При обтурационной желтухе предполагается гиперпродукция фермента, в первую очередь в результате роста желчной фракции.
Как было указано выше, щелочная фосфатаза - относительно неспецифичный фермент, т. е. он влияет на относительно разнообразные субстраты. Есть и более специфичные фосфогидролазы - например, 5-нуклеотидаза. Ее субстрат - нуклеотид-пентозо-5-фосфат.
| Таблица 27. Активность щелочной фосфатазы сыворотки крови при болезнях печени | |||
| Болезнь | Всего обследовано больных | Активность повышена, % | Активность резко повышена (в 3 рада и более), % |
| Острый гепатит: | |||
| вирусный | 69 | 78,2 | 2,0 |
| алкогольный | 44 | 88,6 | 41,0 |
| лекарственный | 59 | 95,1 | 69,9 |
| Цирроз печени: | |||
| распространенная форма | 149 | 60,0 | 8,7 |
| билиарная форма | 24 | 95,8 | 83,3 |
| Подпеченочная (обтурационная) желтуха | 77 | 95,5 | 51,5 |
| Рак печени | 149 | 83,9 | 43,1 |
Щелочная фосфатаза может выполнять функцию гидролазы, отщепляя фосфат, либо функцию фосфотран-сферазы, перенося фосфатный радикал.
Следует отметить, что активность щелочной фосфатазы сыворотки крови у детей до 15 лет, а также у беременных в 1,5 - 3 раза выше активности фермента у взрослых.
Повышение уровня щелочной фосфатазы наблюдается при заболеваниях, не связанных с состоянием гепатобилиарной системы, особенно при поражении костей - опухолях костей, миеломной болезни, активном рахите, первичном геперпаратиреоидизме, включая болезнь Реклингхаузена, деформирующей остеодистрофии (болезнь Педжета) и др.. В этих случаях повышение активности щелочной фосфатазы иногда бывает особенно значительным - в 3-10 раз. Наши совместные с И. К. Ряпосовой данные по исследованию щелочной фосфатазы представлены в табл. 27.
Повышение активности щелочной фосфатазы при заболеваниях печени и желчных путей чаще указывает на холестаз. Из табл. 27 видно, что наиболее частая и значительная гиперферментия наблюдается при билиарном циррозе, подпеченочной (обтурационной) желтухе, а также при лекарственном гепатите с холестатическим синдромом.
Гиперфосфатаземией сопровождаются метастатические и первичные опухоли печени, в частности осложнившиеся желтухой. Невысокая гиперфосфатаземия часто наблюдается при остром вирусном гепатите.
По нашим наблюдениям, при исследовании щелочной фосфатазы при подпеченочной (обтурционной) желтухе надо учитывать, что щелочная фосфатаза отчетливо повышается обычно лишь на 4-10-й день обтурационной желтухи и при давней (многонедельной) обтурационной желтухе гиперфосфатаземия редко держится на одном и том же высоком уровне; на некоторое время она может снижаться почти до нормы с тем, чтобы далее вновь, резко подняться. При длительной желтухе неясного происхождения эта закономерность требует многократного исследования щелочной фосфатазы. Небольшое непостоянное повышение щелочной фосфатазы обнаруживается при холангите. При малоактивных хронических гепатитах и циррозах она незначительно повышена или держится на верхних границах нормы, при высокоактивных - значительно повышена у 60-75% больных. При массивных некрозах печени возможен резкий подъем щелочной фосфатазы. Снижение активности щелочной фосфатазы отмечается после приема метионина, ряда сульфаниламидных препаратов, уретана, кортикостероидных гормонов. Гипофосфатаземия наблюдается также при гипотиреозе, целиакии, гиповитаминозе С и др.
Относительно позднее развитие гиперфосфатаземии при подпеченочной (обтурационной) желтухе и отсутствие этого симптома приблизительно у 10-15% таких больных снижают диагностическую ценность теста.
Выделение изоферментов щелочной фосфатазы породило надежды на расширение диагностического диапазона теста.
Изоферменты щелочной фосфатазы включают в себя костную, кишечную и печеночную фракции. У значительной части обследованных удается также определить плацентарную фракцию [Громашевская Л. Л., Татьян-ко Н. В., Радзевич М. М. и др., 1980; Вилкинсон Д., 1981; Price С. P. et al., 1974; Fritsche Н. A. et al., 1974].
Широкого распространения определение изоферментов щелочной фосфатазы пока не получило. Оно не помогает четко разделить внутри- и подпеченочные формы холестаза, выделить особенности гиперферментии при опухоли печени. Несмотря на указанные недостатки, определение общей активности щелочной фосфатазы нашло широкое распространение как общий индикатор холестаза и свидетель опухолевого поражения печени, а также, правда, в меньшей степени, как индикатор хронической интоксикации алкоголем.
11.2. Кислая фосфатаза (3.1.3.2)
Принятые сокращения: КФ, SPh.
Механизм каталитического действия такой же, как и у щелочной фосфатазы, хотя к индикаторам холестаза кислая фосфатаза отношения не имеет.
Фермент сосредоточен в основном в лизосомах. Им богата предстательная железа, в небольших количествах он содержится в печени, селезенке, костях, эритроцитах, тромбоцитах.
Активность фермента достигает нормальных величин к моменту половой зрелости. Активность кислой фосфатазы сыворотки крови здорового человека определяется в основном ферментом селезенки, почек, эритроцитов и тромбоцитов.
Норма - общая активность (набор "Boeringer", по Е. Schmidt, F. Schmidt) 11 мИЕ/мл, активность простатической фракции [Richterich R. et al., 1962] 4 мИЕ/мл.
Подъем активности наблюдается только у 20-25% больных карциномой предстательной железы без метастазов. С момента появления метастазов гиперферментемия определяется у 90% больных.
Повышение активности кислой фосфатазы встречается также при болезни Гоше, первичном гиперпаратиреозе, болезни Педжета, некоторых формах вторичного остеопороза, а также при лимфобластном лейкозе.
Широкого распространения определение кислой фосфатазы пока не получило.
11.3. 5-Нуклеотидаза (3.1.3.5)
Принятые сокращения: 5Н, 5НТ, 5-N, 5-NT.
Фосфомоноэстераза, гидролизующая только нуклеотидпентозо-5-фосфаты. Типичные субстраты: аденозин-5-фосфат и инозин-5-фосфат. Активируется ионами магния, ингибируется в присутствии никеля.
Содержится в печени, щитовидной железе, аорте, мозге, почках, легких. Относится к мембранно-связанным ферментам, т. е. наибольшая активность определяется в мембранах клеточных органоидов и самой оболочке клетки. В печени располагается в эпителии мельчайших желчных канальцев, на синусоидальной поверхности гепатоцитов, в звездчатых клетках Купфера.
Норма см. табл.
Общие закономерности повышения активности 5-нуклеотидаза близки к результатам исследования щелочной фосфатазы, 5-нуклеотидаза несколько превосходит по чувствительности щелочную фосфатазу в отношении выявления холестаза, особенно при развитии холангита, а также при поражении печени опухолью. Проба несколько менее чувствительна к алкогольному повреждению печени.
На результаты исследования 5-нуклеотидазы почти не влияют беременность и поражение костной системы, хотя небольшие повышения активности при заболеваниях костей изредка бывают.
Изоферменты 5-нуклеотидазы широкого применения не нашли.
5-нуклеотидаза обладает некоторыми преимуществами в диагностическом отношении по сравнению с щелочной фосфатазой, но этот тест, по-видимому, несколько уступает результатам исследования γ-глутамилтрансферазы. Определение 5-нуклеотидазы производится в специализированных гепатологических отделениях.
11.4. Лейцинаминопептидаза (аминокислотная ариламидаза, нафтиламидаза, 3.4.11.1)
Принятые сокращения: ЛАП, AKA, LAP.
Лейцинаминопептидаза в основном синтезируется печенью и выделяется с желчью в двенадцатиперстную кишку, а также в кровь.
Норма см. табл.
Расщепление лейцинбетанафтиламида может производиться, по-видимому, несколькими ферментами. Общим для них является расщепление ариламида.
Активность лейцинаминопептидазы повышается при всех формах внутри- и внепеченочного холестаза. При остром гепатите часто встречаются значительно повышенные величины лейцинаминопептидазы, что снижает его ценность в дифференциальной диагностике желтух. Выявление изоферментных фракций заметно не повысило диагностическую ценность этого фермента. Активность лейцинаминопептидазы повышается также при острых панкреатитах, инфекционном мононуклеозе и нормальной беременности. С момента внедрения в клиническую практику определения активности ГГТФ интерес к исследованиям лейцинаминопептидазы заметно упал.
11.5. Желчные кислоты и холеглицин
| Таблица 28. Концентрация холеглицина (норма 0-60 уcл. ед.) в сыворотке крови при различных заболеваниях органов пищеварения (в процентах) | ||||
| Заболевание или синдром | Нор- маль- ная | Патологическая | ||
| в 1,1 - 2 раза | в 2,1 - 10 раз | повышение более чем в 10 раз | ||
| Различные заболевания органов пищеварения без поражения печени и признаков холестаза (n = 189) | 94,4 | 5,6 | - | - |
| Ферментопатические гипербилирубинемии (n = 11) | 100,0 | - | - | - |
| Хронические гепатиты (без хронического активного): | ||||
| без нарушения функции печени (n = 40) | 100,0 | - | - | - |
| с умеренным нарушением функции печени (n = 57) | 94,7 | 5,3 | - | - |
| с выраженным нарушением функции печени (n = 9) | 88,9 | 11,1 | - | - |
| Хронический активный гепатит (n = 14) | 64,3 | 21,4 | 14,3 | |
| Циррозы печени: | ||||
| активные (n = 52) | 30,8 | 25,0 | 42,3 | 1,9 |
| неактивные (n = 6) | 83,3 | 16,7 | ||
| первичный билиарный (n = 8) | 12,5 | - | 37,5 | 50 |
| Нарушение желчеоттока: | ||||
| с синдромом стойкой холе- статической желтухи (n = 17) | 5,9 | 11,8 | 23,5 | 58,8 |
| без синдрома стойкой холе- статической желтухи (n = 12) | 50,0 | 8,3 | 8,3 | 33,4 |
| Рак различной локализации без холестатической желтухи (n = 20) | 60,0 | 30,0 | 5,0 | 5,0 |
| Острый гепатит (n = 13) | 53,8 | 15,4 | 30,8 | - |
Концентрация желчных кислот закономерно повышается при холестазе, особенно значительно при длительном холестазе, сопровождающем первичный билиарный цирроз, при медикаментозном холестазе, а также при длительной подпече-ночной (обтурационной) желтухе [Бочарова Л. В., 1985; Aim R. et al., 1982, и др.].
В настоящее время наиболее достоверные результаты определения желчных кислот дают радиоиммунологические методы. В частности, одним из наиболее частых объектов исследования является соль холевой кислоты - холеглицин. Наши совместно с А. С. Ивлевым и Г. М. Герасимовым данные представлены в табл. 28.
В соответствии с данными литературы мы также наблюдали четкое повышение холеглицина при холестазе, но различий между подпеченочным и внутрипеченочным холестазом при высокой гипербилирубинемии выявить не смогли. Исключение составляют холестатические желтухи без цитолиза с невысокой гипербилирубинемией (в 1,5 - 4 раза выше нормы). Высокая гиперхолеглицинемия говорит в пользу внепеченочной обтурации.
Наконец, мы не смогли подтвердить мнение L. Demers (1976), N. La Russo и соавт. (1975), К. Einerson и соавт. (1985) о том, что холеглицин является чувствительным показателем гепатодепрессии. По нашим наблюдениям, холеглицин малочувствительный индикатор гепатодепрессии.
11.6. Билиарный гликопротеин 1
Билиарный гликопротеин 1 - (БГ1) присутствует в нормальной желчи и сыворотке крови. Молекулярная масса 90 000. Содержит около 40% углеводов и 60% белка. Определение радиоиммунологическим методом.
Норма - 0,5 ± 0,3 мг/л.
По данным Т. Svenberg, S. Hammerstrom и соавт. (1981), при заболеваниях печени и желчных путей с холестазом содержание билиарного гликопротеина в сыворотке крови повышается в 5-10 раз. При заболеваниях печени без холестатического синдрома повышение было незначительным. Результаты исследования БГ1 коррелируют с результатами исследования γ-глутаминлтрансферазы. Тест применяется в научных целях.
Ряд веществ, содержащихся в крови, моче и кале, используют для выявления холестатического синдрома и его особенностей. Однако эти вещества служат индикаторами других синдромов, и поэтому о них говорилось в предшествующих главах. Среди них в выявлении холестатического синдрома особенно велика роль γ-глутамилтрансферазы и билирубина сыворотки крови. Кратко упоминаем о веществах, способствующих выявлению синдрома холестаза.
11.7. Билирубин общий и конъюгированный
Общий и особенно конъюгированный билирубин сыворотки крови - важные индикаторы холестаза. При остро развившемся холестазе, захватывающем большую часть желчевыводящей системы, оба показателя бывают существенно повышены. При острой блокаде желчевыводящих путей в бассейне одного из печеночных протоков (особенно левого) подъем этих показателей может отсутствовать. При хроническом холестатическом синдроме обычно наблюдается гипербилирубинемия. Однако в отдельных случаях подъем общего и конъюгированного билирубина может значительно запаздывать по сравнению с активностью ГГТФ, ЩФ, 5-НТ, а также с повышением концентраций желчных кислот сыворотки крови. Запаздывает гипербилирубинемия в этих случаях и по сравнению с клиническим проявлением холестаза (кожный зуд).
Желчные пигменты (билирубин) мочи
При выраженном желтушном холестатическом синдроме как внутри, так и подпеченочного происхождения в моче появляются желчные пигменты.
Стеркобилин в кале При выраженном внутрипеченочном холестазе и полной механической (подпеченочной) желтухе стеркобилин исчезает из кала. При менее выраженном внутрипеченочном холестатическом синдроме и неполной механической желтухе количество стеркобилина в кале уменьшается. Попытка разделить внутрипеченочной и подпеченочной холестаз по разнице концентраций конъюгированного и неконъюгированного билирубина, билирубин моно- и диглюкуронида, а также различных сочетаний уробилиновых тел и желчных пигментов пока закончилась неудачей. Значительное количество гипербилирубинемий не имеет прямого отношения к холестазу.
11.8. γ-Глутамилтрансфераза (ГГТ; синоним — гамма-глютамилтранспептидаза, ГГТП) сыворотки крови
γ-Глутамилтрансфераза сыворотки крови относится к многоцелевым индикаторам, одной из областей применения которых является холестаз. Исследование γ-глутамилтрансферазы при подозрении на холестаз следует считать обязательным.
ГГТ - фермент, участвующий в обмене аминокислот. Катализирует перенос гамма-глутамилового остатка с гамма-глутамилового пептида на аминокислоту или другой пептид. Накапливается в основном в почках (уровень ГГТ в 7000 раз выше, чем в сыворотке крови), печени (в 200—500 раз выше) и поджелудочной железе. В клетках локализуется в мембране, лизосомах и цитоплазме.
Тест на ГГТ – самый чувствительный анализ в отношении застоя желчи – холестаза. Активность ГГТ при препятствии оттоку желчи, например при камнях в желчных протоках, повышается раньше, чем активность щелочной фосфатазы. Однако повышение это неспецифично, так как оно происходит при большинстве острых заболеваний печени и желчных ходов, например при остром вирусном гепатите или раке, и обычно такой результат не очень информативен при установлении конкретного заболевания или состояния, вызвавшего повреждение печени.
В отличие от других печеночных ферментов, производство ГГТ «запускается» алкоголем, поэтому у лиц, злоупотребляющих им, ее активность может быть повышена даже в отсутствие заболевания печени. Кроме того, выработка ГГТ стимулируется некоторыми лекарствами, включая фенобарбитал и парацетамол, поэтому на фоне их приема можно ожидать повышения ГГТ без повреждения
11.9. Другие индикаторы холестаза
- Холестерин сыворотки крови повышается у большинства больных как с внутрипеченочным, так и с подпеченочным холестазом. Частота и степень повышения нередко зависят от продолжительности холестаза.
- Медь сыворотки крови повышается у 70-80% больных с внутри-и подпеченочным холестазом.
- Общий фосфор сыворотки крови. Норма - 58,5 ± 0,8 мг%.
- Липидный фосфор сыворотки крови. Норма - 10,7 ± 0,25 мг%. Общий и липидный фосфор, по данным Г. К. Хамидова, 3. К. Курбанова (1979), наиболее значительно повышается при холестатическом синдроме, особенно при подпеченочной (обтурационной) желтухе. При остром вирусном гепатите повышение этих двух компонентов выражено меньше. В широкую практику определение общего и липидного фосфора не внедрено.
12. Индикаторы шунтирования печени
Под индикаторами шунтирования печени подразумевают вещества, которые в норме поступают главным образом из кишечника в систему воротной вены и в печень. В патологических условиях, при развитии венозных коллатералей эти вещества поступают в систему общего кровотока, минуя печень, и становятся, таким образом, показателями сброса портальной (венозной) крови. В последние годы тесты этой группы получают все более и более высокую клиническую оценку в связи с громадной ролью кишечной интоксикации в развитии гепатогенных энцефалопатий. Среди характеристик портально-печеночной недостаточности (портосистемной энцефалопатии) им принадлежит основное место.
12.1. АММИАК И ЕГО ПРОИЗВОДНЫЕ
Раскрытие истинной роли аммиака в происхождении гепатогенных энцефалопатий помогло понять клиникофизиологическое значение остальных индикаторов шунтирования.
В последние годы установлено, что, кроме шунтовой гипераммониемии, встречается ферментная гипераммониемия. Ферментная гипераммониемия развивается при нарушении работы систем, участвующих в преобразовании аммиака. Обычно речь идет об ферментах цикла мочевинообразования.
В основном такие нарушения регистрируются у детей и подростков. Хотя ферментные гипераммониемии встречаются несравненно реже шунтовых, их значение достаточно велико. Различают врожденные и приобретенные ферментопатии, приводящие к гипераммониемии. К врожденным относится гиперлизинемия (дефект дегидрогеназы лизина), пропионовая ацидемия (дефект карбоксилазы пропионовой кислоты), метилмалониевая ацидемия (дефект метилмалонилмутазы) и орнитемия (дефект орнитиновой кетокислотной трансаминазы).
| Таблица 29. Аммиак сыворотки крови при болезнях печени | |||
| Болезнь | Всего обследо- вано | Содержание повышено, % | Содержание резко повышено (более 150 мкг %), % |
| Острый вирусный гепатит | 49 | 53,1 | 14,3 |
| "Шоковая печень" | 28 | 86,2 | 31,0 |
| Жировая дистрофия | 69 | 36,2 | 7,2 |
| Хронический активный гепатит | 47 | 72,4 | 31,9 |
| Цирроз печени | 226 | 64,7 | 44,7 |
| Первичный рак печени | 41 | 53,7 | 17,1 |
К приобретенным ферментопатиям относится синдром Рея (см. гл. 2).
Наши данные совместно с Ю. Н. Сурниным и И. К. Ряпосовой по исследованию аммиака у взрослых при различных заболеваниях печени представлены в табл. 29.
Повышение концентрации аммиака сыворотки крови достаточно закономерно наблюдается при циррозах печени (см. табл. 29). При циррозе печени без энцефалопатии гипераммониемия обычно не превышает 25-50% по сравнению с верхней границей нормы. При развитии энцефалопатии повышение концентрации аммиака колеблется обычно между 50% и 100% по сравнению с верхней границей нормы.
Особенно высокие гипераммониемии (в 3-5 раз и более превышающие верхнюю границу нормы) бывают, по данным литературы, при синдроме Рея. Часто гипераммониемия регистрируется при шоковой печени.
Нередко повышение концентрации аммиака отмечают при остром вирусном гепатите. Однако значительная гипераммониемия при этом заболевании наблюдается сравнительно нечасто - при тяжелых формах с небольшим асцитом или синдромом отека кишечных петель (предстадия флегмоны кишечника). Е. П. Шувалова, А. Г. Рахманова (1983) закономерно наблюдали гипераммониемию у больных острым вирусным гепатитом с развитием массивного некроза печени.
Следует заметить, что в развитии гипераммониемии всегда может играть роль поражение ферментов цикла мочевины. Обычно этот компонент генеза гипераммониемии невелик, но в отдельных случаях (см. синдром Рея) ему принадлежит решающая роль. До сих пор неясна доля шунтовой и ферментной гипераммониемии в повышении содержания аммиака сыворотки крови при остром вирусном гепатите.
Повышение аммиака сыворотки крови регистрируется у 80% больных с печеночно-клеточной комой и почти у всех больных с портально-печеночной комой.
Традиционный метод определения (по Конвею) явно устарел. Он ненадежен в техническом отношении. Новые, более совершенные, даже технически несложные методы (например, по Мюллеру - Байзенхирцу в модификации Энгельгардта) внедряются пока медленно, что очень затрудняет правильную дифференциальную диагностику ком.
- Проба с нагрузкой аммиачными солями
Принцип. При мощных коллатералях между воротной и полыми венами аммиак минует печень и поступает в большом количестве в oбщий кровоток.
Методика первая. 4 г хлорида аммония в 5% растворе или капсулах, растворяющихся в тонком кишечнике, дают больному принять внутрь в течение 15-30 мин. Затем через 30, 60, 120, 180 мин исследуют венозную кровь.
Можно дать внутрь 3 г хлорида аммония, разведенного в 250 мл воды, и далее исследовать венозную кровь через 45 и 120 мин. Результаты пробы обсуждены после изложения второй методики.
Методика вторая (по Ju Stahl). Больной находится на постельном режиме. После 12-часового голода у него исследуют содержание аммиака в венозной и артериальной крови. Затем внутрь дают 5 г ацетата аммония в 18% водном растворе и исследуют кровь через 15, 45 и 75 мин. При обтурационной желтухе, нетяжелом остром вирусном гепатите, жировой дистрофии печени подъем аммиака как в венозной, так и в артериальной крови незначителен [Cohn Н. et al., 1963]. При циррозах печени повышение уровня аммиака в венозной крови наблюдается у 60-80% больных. Более чем у 25% больных содержание аммиака после нагрузки повысилось только в артериальной крови. Эти данные объясняют иногда встречающиеся противоречия в обнаружении гипераммониемии после нагрузки. Особенно выражена гипераммониемия у больных циррозом печени, находящихся в коматозном состоянии (рис. 4).
Значение определения аммиака сыворотки крови при тяжелых заболеваниях печени (цирроз, "шоковая печень" и др.) возрастает. Этот тест становится совершенно необходимым у больного с тяжелым заболеванием печени.
Детальное изучение портально-печеночной комы показало, что аналогичным или близким действием на головной мозг обладают также еще некоторые вещества, поступающие из кишечника. Их также можно отнести к индикаторам шунтирования печени: эти вещества действуют в основном при развитии кавапортальных анастомозов.
К этим "новым" индикаторам шунтирования отнесены фенолы, некоторые аминокислоты (тирозин, фенилаланин, метионин, триптофан), жирные кислоты с короткой цепью.
12.2. Фенолы
В 1930 г. Е. Bechler обнаружил повышение свободных фенолов в крови больных циррозом печени. В 1964 г. J. Harborn установил, что эти вещества токсичны для головного мозга. D. Mutting особенно настойчиво подчеркивает значение повышения концентрации фенолов в развитии комы у больных циррозом печени, считая, что фенолы больше, чем аммиак, коррелируют с глубиной портально-печеночной комы.
Однако М. Impler (1968) не подтвердил высокую корреляцию концентрации фенолов и портально-печеночной энцефалопатии. Определение фенолов в клинической практике пока используется мало, главным образом в научно-исследовательских целях. В частности, работающий над созданием искусственной печени G. Brauner (1984) в качестве токсического вещества, способствующего развитию гепатогенной энцефалопатии, выбрал именно фенол и опробовал свою систему на обезвреживании фенола.
Норма - общие фенолы сыворотки крови (по D. Mutting) 0,23 ± 0,068 мг%. Общие фенолы крови по S. Bassett 5-8 мг/л.
12.3. Аминокислоты
Тирозин и фенилаланин под влиянием активизации кишечной флоры (что характерно для снижения функции ретикулоэндотелиальной системы) при болезнях печени легко превращаются в тирамин и особенно в октопамин. Эти два вещества, в первую очередь октопамин, выполняют роль ложных нейротрансмиттеров.
Они вытесняют из синапсов первичных окончаний истинные медиаторы - норадреналин и допамин. Таким путем происходит дезорганизация работы нервной системы, которая может привести к коме. Эти закономерности, впервые обнаруженные I. Parker и сотр. (1970) и подтвержденные в дальнейшем I. Fischer (1971), находят в последние годы все больше сторонников. К настоящему времени отмечена связь между повышением концентрации фенилаланина и переходом тирозина в нормальные нейротрансмиттеры (допамин и норадреналин).
В известной мере антагонистами тирозина и фенилаланина оказываются аминокислоты с разветвленными цепями - лейцин, изолейцин, валин. При тяжелых циррозах печени обычно наблюдается повышение концентрации тирозина и фенилаланина и снижение концентраций лейцина, изолейцина, валина. Эти 3 аминокислоты с разветвленной цепью необходимы для нормальной работы головного мозга. Предполагается, что именно при снижении концентраций в сыворотке крови лейцина, изолейцина и валина тирозин и фенилаланин (а также метионин) могут особенно легко приобретать роль ложных нейротрансмиттеров.
Длительно изучавшие уровень аминокислот сыворотки крови при различных заболеваниях печени I. Fischer и сотр. (1974, 1977) вывели следующее соотношение молярных концентраций в сыворотке крови: валин + лейцин + изолейцин/фенилаланин + тирозин = 3 - 3,5. У больных портально-печеночной недостаточностью это соотношение обычно меньше единицы. Такой профиль концентрации аминокислот считается очень характерным для этого вида энцефалопатии.
12.4. Жирные кислоты с короткой цепью
С 1956 г. известно, что инфузия животным ЖККЦ закономерно вызывает кому. В последние годы у больных с печеночной комой методом газовой хромотографии постоянно обнаруживается повышение этих компонентов в сыворотке крови в 2-8 раз по сравнению с нормой. Особенно часто и значительно повышается концентрация ЖККЦ в сыворотке крови больных с кавапортальными анастомозами. Прием внутрь ЖККЦ людьми без кавапортальных анастомозов значительного повышения концентрации этих веществ в сыворотке крови не вызывает, у лиц с кавапортальными анастомозами ведет к резкому повышению их содержания в сыворотке крови.
ЖККЦ образуются в основном в кишечнике под влиянием бактериальной флоры. К ЖККЦ относятся масляная (бутановая) кислота (С4), валериановая (пентановая) кислота (С5), капроновая (гексановая) кислота (С6), каприловая (октановая) кислота (С8). Особенно токсичны для головного мозга, по-видимому, первые две кислоты.
Установлено, что ЖККЦ воздействуют на синапсы нервных клеток, замедляя проведение нервных импульсов.
В сыворотке крови ЖККЦ связаны с альбумином. Обычно их накопление в этой среде наблюдается либо при сниженном содержании альбумина, либо тогда, когда связывающие способности альбумина полностью исчерпаны.
Норма (в сыворотке крови) - суммарное количество ЖККЦ по методу В. Holmquist составляет 8,7 ± 3,9 мг%.
13. Индикаторы регенерации и опухолевого роста печени
Важность выявления опухолевого роста не вызывает сомнений. До последнего времени при изучении болезней печени основное внимание уделялось механизмам повреждения и мало - механизмам регенерации. В клинике обсуждать эту проблему было бесполезно - отсутствовали объективные методы оценки регенерации; только сейчас начинают подходить к решению этой проблемы. Пока наши возможности в этой области значительно меньше, чем при диагностике других печеночных синдромов. Учитывая эти конкретные задачи, мы выделили в специальную группу тесты, в той или иной мере отражающие интенсивность процессов регенерации.
Индикаторы этой группы обычно отражают как нормальную, так и патологическую регенерацию печени (опухолевый рост определенных клонов печеночных клеток или внедрение в печень опухолевых элементов иного происхождения). Пока лишь одно вещество является индикатором опухолевого роста и регенерации - α-фетопротеин (АФП).
13.1. Альфа фетопротеин (АФП)
АФП - гликопротеин с молекулярной массой 65 000, относящийся к α1-глобулинам.
Связь АФП с опухолью печени впервые обнаружил Г. И. Абелев и сотр. в 1962-1963 г. при изучении в эксперименте гепатом мышей. В 1964 г. Ю. С. Татаринов, используя систему антиген - антитело, созданную Г. И. Абелевым, впервые обнаружил АФП в сыворотке человека, страдавшего гепатоцеллюлярной карциномой.
Главным источником АФП у взрослых является гепатоцит. Особенно много АФП производится во внутриутробном периоде, когда гликопротеид синтезируется в зоне желточного мешка. С 3-го месяца эмбрионального периода его концентрация в сыворотке зародыша достигает 1-3 мг/л. Достаточно много гликопротеида в сыворотке крови ребенка первых недель жизни. С 14-й недели продукция АФП резко снижается, а к 34-й неделе достигает минимальных показателей.
Резкое повышение концентрации этого гликопротеида в сыворотке крови взрослых наблюдается при развитии гепатоцеллюлярной карциномы и тератобластом яичек и яичников.
Однако гиперальфафетопротеинемия наблюдается не только при опухолях: в меньшей степени она имеется у беременных, а также при активных неопухолевых заболеваниях печени (острый гепатит С массивным или субмассивным некрозом печени). Довольно часто гиперальфафетопротеинемия наблюдается у больных хроническим активным гепатитом и циррозом печени.
В настоящее время можно считать, что повышение АФП в сыворотке крови приблизительно в 95% случаев связано с состоянием печени и в 5% - с внепеченочными источниками. S. Nalon (1978) установил связь исходов массивного и субмассивного некрозов печени вирусного происхождения с интенсивностью продукции АФП. Резкий подъем АФП сыворотки крови (500 нг/мл и выше) обнаружен у 85% больных с благоприятным исходом и лишь у 38% - с летальным. Близкие результаты получены рядом других исследователей, что дает основание связывать интенсивность продукции АФП с темпами регенерации. Прямые экспериментальные данные, подтверждающие это положение, получили Г. И. Абелев, Д. А. Эльгорт (1978) и др. Однако АФП как маркер регенерации печени при неопухолевых заболеваниях в практической гепатологии используется мало. Конечно, гиперпродукция АФП при заболевании печени свидетельствует о ряде патологических сдвигов, из которых наиболее важным является регенерация, если можно достоверно исключить опухолевый рост.
Определение АФП важно в первую очередь для обнаружения гепатоцеллюлярной карциномы, а также для характеристики регенерации.
Диагностическое значение и сфера применения теста менялись в зависимости от способа определения этого гликопротеида. Методом преципитации в агаре искомый белок обнаруживается в сыворотке крови 50-55% больных гепатоцеллюлярной карциномой [Татаринов Ю. Н., Ногаллер А. М., 1966; Абелев Г. И. и др., 1967; Хазанов А. И., 1968, и др.], а методом встречного электрофореза - у 60-65% [Горбатенко В. П. и др., 1974; Мансурова И. Д. и др., 1975; Е. Рауслахти и др., 1975, и др.].
При использовании обоих методов АФП изредка удавалось обнаружить в сыворотке больных острым вирусным гепатитом, а также беременных, еще реже - у больных метастатическим раком печени.
Методы третьего поколения, в частности количественное радиоиммунологическое определение, сделали доступными для исследования ничтожно малые количества АФП в сыворотке здоровых людей. Стало возможно динамическое наблюдение за уровнем АФП на разных стадиях заболевания. Повышение продукции АФП выявляется радиоиммунологическим методом у 80-85% больных гепатоцеллюлярной карциномой [Курдыбайло Ф. В., 1980; Абдулаева А. Ю., 1981; Карташова И. А. и др., 1981, и др.].
При холангиоцеллюлярных и метастатических раках печени значительного роста продукции АФП большинство исследователей не обнаружили [Okuda К. et al., 1976; Weiss W., 1978, и др.]. Однако отдельные авторы [Waldman Т., 1970; Kozover М., Fanas К., 1971; Nishioka М., Kamata Н., 1973; Lehman F., 1974] наблюдали повышение концентрации АФП в сыворотке крови определенной части больных метастатическим раком печени. Это обстоятельство побудило, правда, безуспешно, С. Г. Дериманова (1983) испытать АФП-тест в диагностике метастатического рака печени. Известную противоречивость данных в отношении больных метастатическим раком печени в значительной мере объясняют материалы В. В. Шишкиной и соавт. (1982). Приняв за норму концентрацию АФП в сыворотке крови 5,9 ± 0,6 нг/мл, они также получили частое повышение содержания гликопротеида при метастатическом раке печени. Между тем большинство исследователей, пользующихся теми же реактивами, считают нормальными величины лишь ниже 25 нг/мл либо даже ниже 50 нг/мл.
Данные по прогностическому значению гиперальфафетопротеинемии очень скудны. В странах, где гепатоцеллюлярная карцинома значительно распространена (в частности, в Южной Африке), средний уровень альфафетопротеинемии населения в 3-4 раза выше, чем в Центральной Европе [Naumayr А., 1980]. В этих случаях гиперальфафетопротеинемию связывают с высокой частотой вирусных инфекций (вирусный гепатит В и цитомегаловирус), при которых нередко наблюдается умеренная гиперпродукция АФП. При успешном удалении злокачественной гепатомы концентрация АФП в сыворотке больного падает до нормальных величин. В случае рецидива карциномы у этих больных возобновляется гиперпродукция АФП [Fortner S. et al., 1978, и др.].
Совместно с Г. М. Герасимовым мы обследовали 1811 больных. Выполнено 3641 определение концентраций АФП радиоиммунным методом.
У всех больных злокачественными опухолями диагноз верифицирован морфологически. Из 204 больных циррозом печени у 186 (91,2%) диагноз верифицирован гистологически и лапароскопически. У остальных 18 больных диагноз был подтвержден типичной клинико-сцинтиграфической картиной в сочетании с варикознорасширенными венами пищевода.
Радиоиммунологическое определение АФП в сыворотке выполнялось при помощи стандартных наборов фирмы CIS (Франция).
Результаты представлены в табл. 30.
| Таблица 30. Концентрация АФП сыворотки крови у больных различными заболеваниями | |||||||||
| Концентрация, нг/мл | Заболевания | ||||||||
| I | II | III | IV | V | VI | VII | VIII | Всего больных | |
| n = 37 | n = 12 | n = 99 | n = 82 | n = 204 | n = 547 | n = 79 | n = 824 | 1814 | |
| Ниже 25,1 | 10,8% | 41,6% | 74,7% | 96,3% | 77,9% | 95,8% | 74,7% | 96,6% | 1630 |
| Р | < 0,05 | <0,001 | < 0,001 | <0,001 | < 0,001 | < 0,001 | <0,001 | (90,0%) | |
| 25,1-50,0 | 8,1% | 25,0% | 11,2% | 2,4% | 12,8% | 3,6% | 12,7% | 3,0% | 97 |
| Р | < 0,05 | (5,4%) | |||||||
| 50,1-200 | 16,2% | 16,7% | 10,1% | 1,2% | 9,3% | 0,6% | 11,4% | 0,4% | 53 |
| Р | < 0,001 | < 0,001 | < 0,001 | (2,9%) | |||||
| 200,1 и выше | 64,9% | 16,7% | 4,0% | 0% | 0% | 0% | 1,2% | 0% | 31 |
| Р | < 0,001 | < 0,001 | < 0,001 | (1,1%) | |||||
| Примечание: р - достоверность различий по отношению к 1 группе; I - гепатоцеллюлярная карцинома печени; II - рак общего желчного протока; III - метастатический рак печени; IV - карцинома внепеченочной локализации без метастазов в печень; V - цирроз печени; VI - хронический гепатит; VII - острый гепатит; VIII - прочие (неопухолевые) заболевания без явного поражения печени. | |||||||||
14. Гепатозы
Гепатозы – общее название, объединяющее сразу несколько патологий органа, протекающих с дистрофическими изменениями паренхиматозной ткани без явной мезенхимальноклеточной реакции. Выделяют острую и хроническую форму заболевания
14.1. Причины гепатозов
Острый гепатоз возникает при токсическом поражении органа. Это может быть отравление фтором, мышьяком, характерные симптомы острого гепатоза появляются также после приема высоких доз алкоголя, при передозировке лекарственных препаратов, употреблении ядовитых грибов. Порой острая дистрофия печени становится осложнением вирусного гепатита или сепсиса.
Гепатоз в хронической форме в большинстве случаев является следствием длительного приема алкогольных напитков, причиной гепатоза печени может стать также дефицит белка или витаминов, действие бактериальных токсинов, четыреххлористого углерода, фосфорорганических соединений и ряда других агентов, обладающих гепатотропным действием.
Нарушение обменных процессов в организме влечет за собой нарушение обмена веществ в печени. При этом патогенез заболевания заключается в нарушении метаболизма липидов и отражается на формировании липопротеидов в клетках печени.
Ряд экзогенных веществ, среди которых и медикаменты (аминазин, препараты тестостерона, гестагены), при продолжительном бесконтрольном применении могут стать причиной холестатического гепатоза.
При поражении печени в этом случае происходит нарушение обмена холестерина и желчных кислот в клетках печени, также нарушается процесс образования желчи, её отток по протокам. При прогрессировании симптомов заболевания большое значение имеет не только воздействие вредного фактора на гепатоциты, но и токсико-аллергический фактор.
15. Фиброз печени
Фиброз – это накопление в печени жесткой волокнистой (рубцовой) ткани, состоящей преимущественно из коллагена. Основной путь прогрессирования хронических диффузных
заболеваний печени – развитие последовательных стадий фиброза с формированием цирроза
и рака печени, что предопределяет плохой прогноз и короткие сроки выживаемости больных.
Количественные показатели тяжести фиброза – это достоверный индикатор прогрессирования патологий печени, их определение прогностически значимо и используется как один
из важнейших параметров для выработки объективного подхода к схеме лечения и к его
мониторингу.
15.1. Стадии фиброза
КЛАССИФИКАЦИЯ (ГРАДАЦИЯ) СТЕПЕНЕЙ ТЯЖЕСТИ ФИБРОЗА
Общепринятыми являются три основные и стандартизированные системы градации фиброза печени: 1) METAVIR, 2) Индекс гистологической активности (ИГА) согласно Knodell и
3) Модифицированный индекс гистологической активности по Ицхаку (Ishak). Эти системы
основаны на результатах биопсии печени (табл. 1).
Т а б л и ц а 1
Сравнительная характеристика систем полуколичественной оценки фиброза печени
Бал
R.G.Knodell,
P.J.Scheuer,
K.G.Ishak,
К.Р.Batts,
METAVIR,
лы
1981
1991
1994
1995
1994
0
Фиброз
отсутствует
Фиброз
отсутствует
Фиброз
отсутствует
Фиброз
отсутствует
Фиброз
отсутствует
1
Фиброзное
расширение портальных трактов
Расширенные
фиброзные портальные тракты
Фиброзное
расширение портальных трактов с/или без коротких фиброзных септ
Звездчатое
расширение портальных трактов без образования септ
2
Расширение
портальных трактов + портопортальные септы
Перипорталь-ные
и портопортальные септы, строение печени не нарушено
Фиброзное
расширение большинства портальных трактов с/или без коротких фиброзных септ
Портальный
фиброз
Расширение
портальных трактов с единичными портопортальными септами
3
Мостовидный
фиброз -портопортальные или портоцентральные септы
Фиброз
с нарушением строения печени, но без явного цирроза
Фиброзное
расширение большинства портальных трактов с единичными мостовидными
портопортальными септами
Перипортальный
фиброз, септаль-ный фиброз
Многочисленные
портальные септы без цирроза
4
Цирроз
Вероятный
или несомненный цирроз
Фиброзное
расширение портальных трактов с выраженными мостовидными портопортальными и
портоцентральными септами
Цирроз
Цирроз
5
Многочисленные
мостовидные септы с единичными узелками (неполный цирроз)
6
—
—
Цирроз,
вероятный или достоверный
—
—
– –
Можно ли оценивать прогрессирование тяжести фиброза печени согласно этим показателям не с помощью биопсии, а за счет измерения сывороточных уровней подходящих
биомаркеров? Похоже, что "да". При этом, что особенно важно, результаты измерения уровней соответствующих биомаркеров с помощью специально разработанных алгоритмов
сразу преобразуются в показатели тяжести фиброза, чаще всего в показатели систем
METAVIR и Ishak, которые отражают как стадии прогрессирования фиброза, так и активность некровоспалительного процесса в печени.
Однако некоторые авторы предлагают собственные системы индексов и алгоритмы их
вычисления, либо количественно оценивающие тяжесть фиброза, либо свидетельствующие о
нем на качественном уровне: есть или нет. При этом предлагаются пограничные уровни
таких индексов, сопоставляемые с конкретными значениями международных систем оценки
фиброза.
15.2. ДВА КЛАССА МАРКЕРОВ ФИБРОЗА
Биомаркеры фиброза условно разделяются на прямые и непрямые.
1. Прямые. Маркеры, характеризующие: а) метаболизм в клеточном матриксе (фиброгенез и фибролиз) и/или б) изменения в стеллатных клетках, которые доминируют в профиброзных клетках. Такие прямые биомаркеры фиброза – это фрагменты клеточного матрикса печени, образованные стеллатными клетками, и молекулы, участвующие в регуляции прогрессии и регрессии фиброза. Это: гиалуроновая кислота (ГК), коллагены IV и VI, аминотерминальный фрагмент проколлагена III (P3NP), матриксные металлопротеиназы и TIMP-1 – тканевой ингибитор металлопротеиназы 1.
2. Непрямые. Это традиционные сывороточные маркеры, характеризующие изменение функции печени и не обязательно отражающие изменения в клеточном матриксе или в профиброзных клетках. Непрямые маркеры фиброза – это молекулы, высвобождаемые в кровь из-за воспалительного процесса, идущего в печени, в частности, 1) аминотрансферазы АЛТ и АСТ, 2) молекулы, синтезируемые, регулируемые или секретируемые печенью, например, аполипопротеин А1, альфа-2-макроглобулин (А2М), ферритин, гаптоглобин, 3) факторы свертывания, 4) холестерин и билирубин, а также 5) маркеры патологий, которые возникают при повреждении функции печени, например, инсулинорезистентность.
15.3. ТЕСТЫ НА ФИБРОЗ ПЕЧЕНИ
Непрямые
• APRI: АСТ, количество тромбоцитов.
• AST/ALT ratio (AAR): АЛТ/АСТ.
• Model 3: АСТ/АЛТ, протромбиновое время.
• FIB-4: АЛТ/АСТ, количество тромбоцитов, возраст.
• FibroIndex: АСТ, гамма-глобулин, количество тромбоцитов.
• Wai CT et al., 2003: АСТ, щелочная фосфатаза, количество тромбоцитов.
• Hui AY et al., 2005: билирубин, альбумин, количество тромбоцитов, индекс массы тела.
• Forns' score: ГГТ, холестерин, количество тромбоцитов, возраст.
• Fibrotest: А2М, гаптоглобин, АпоА 1, ГГТ, билирубин.
• ActiTest: А2М, гаптоглобин, Апо А1, АЛТ, АСТ, ГГТ, билирубин.
• FibroMaxTest: А2М, гаптоглобин, Апо А1, АЛТ, АСТ, ГГТ, триглицериды, билирубин, холестерин, глюкоза, пол, возраст, вес, рост.
Прямые
• MP3: PIIIN и MMP-1.
• Larrousse M. et al., 2007: ГК, TIMP-1.
• ELF test: ГК, PIIINP и TIMP-1.
Комплексные фиброзные панели, включающие прямые и непрямые биомаркеры
• Fontana R.J. et al., 2008: ГК, TIMP-1, количество тромбоцитов.
• SHASTA: ГК, АСТ, альбумин.
• FIBROSpect II: А2М, ГК, TIMP-1.
• Zeng's score: А2М, ГГТ, ГК, возраст.
• Hepascore: А2М, ГК. ГГТ, билирубин, возраст, пол.
• Fibrometer: А2М, ГК, ферритин, АСТ, мочевина, количество тромбоцитов, протромбиновое время, причина заболевания печени, возраст.
15.4. Какой тест лучше?
Для ответа на этот крайне непростой вопрос проведено большое количество специальных
исследований. Так, эффективность тестов APRI, Fibrometer, Fibrotest, Forns' score, Hepascore,
MP3 cравнивалась в проспективном исследовании (наблюдались 180 пациентов с хроническим ВГС в период с 2002 по 2004 г.). Результаты биопсий оценивались по шкале
METAVIR. Наилучшие результаты дало сочетанное применение нескольких тестов, которые
в наиболее удачных комбинациях надежно диагностировали или отсутствие фиброза, или его
тяжелую стадию. Такие хорошие результаты были получены только для одной трети
пациентов, а вот промежуточные стадии фиброза диагностировались с меньшей надежностью. Авторы полагают, что "текущие неинвазивные методы оценки фиброза печени дают
надежную информацию у одной трети пациентов с хроническим ВГС, особенно, когда эти
методы используются совместно" [99]. Затем, при наблюдении 825 пациентов в четырех
независимых центрах было показано, что по своей точности тесты располагаются так (по
убыванию): FibroMeter, Fibrotest, APRI и Hepascore [100]. В другом недавнем исследовании
было показано, что при диагностике фиброза, связанного с ВГС, эффективность тестов была
следующей (по убыванию): FibroMeter, APRI, Fibrotest, Hepascore, FIB-4 [101]. В двух других
сравнительно больших исследованиях (1056 пациентов в пяти клиниках, фиброз, связанный с
ВГС, шкала METAVIR) тесты по своей точности расположились так: FibroMeter, Fibrotest,
Hepascore, APRI [102].
В недавнем исследовании FibroTest, Fibrometer, Hepascore и другие тесты сравнивались
при наблюдении 218 пациентов с алкогольным заболеванием печени. Показано, что при
диагностике выраженного фиброза и цирроза эффективность FibroTest, FibrometerA и
Hepascore была выше, чем у "непатентованных" тестов APRI, Forns и FIB-4. Наиболее точным и прогностически значимым был FibroTest. Как считают авторы (разработчики
FibroTest), "у пациентов с алкогольными заболеваниями печени тесты FibrometerA и Hepascore не улучшают диагностических и прогностических значений, которые имеет FibroTest"
[103].
В еще одном исследовании панели Fibrotest, Hepascore, Fibrometer, SHASTA, APRI, Forns
index и FIB-4 сравнивались при наблюдении 272 пациентов, инфицированных ВИЧ-1 и ВГС.
Количество пациентов, правильно диагностированных (F2, METAVIR) для тестов Fibrotest,
Hepascore, Fibrometer, составляло 62, 68 и 71%, соответственно. Тесты FIB-4, APRI и Forn's
имели более низкую точность и правильно диагностировали только 37–61% пациентов.
Сочетание Fibrotest, Hepascore, Fibrometer не повысило точности диагностики. Авторы
полагают, что "у пациентов, инфицированных ВИЧ-1/ВГС, тесты Fibrometer, Hepascore и
Fibrotest превосходят другие "неинвазивные" биомаркеры, применяемые для диагностики
фиброза печени" [104].
В пяти независимых госпиталях наблюдались 1056 пациентов с хроническим ВГС. При
использовании наилучших пограничных уровней правильная диагностика тяжелого фиброза
и цирроза составляла
| Тяжелый фиброз, % | Цирроз, % | |
| FibroMeter | 90,1 | 100 |
| FibroTest | 78,2 | 95,1 |
| Hepascore | 73,8 | 94,9 |
| APRI | 71,4 | 88,0 |
| Тяжелый фиброз, % | Цирроз, % | |
| FibroMeter | 15,4 | 15,4 |
| FibroTest | 3,6 | 31,9 |
| Hepascore | 0,3 | 24,6 |
| APRI | 1,4 | 1,4 |
| Тесты | Погра- ничный уровень | Чувстви- тельность. % | Специ- фичность, % | Правильная классиф., % | Положит, предаст, знач., % | Отрнцат. предаст, знач., % |
| FibroTest | ||||||
| >F2 | 0,43 | 70 | 72 | 71 | 80 | 61 |
| >F3 | 0,59 | 73 | 79 | 77 | 67 | 83 |
| F4 | 0,74 | 75 | 85 | 83 | 50 | 94 |
| FibroMeter | ||||||
| >F2 | 0,46 | 73 | 68 | 71 | 78 | 62 |
| >F3 | 0,69 | 72 | 85 | 81 | 74 | 84 |
| F4 | 0,83 | 81 | 85 | 84 | 52 | 96 |
| Hepascore | ||||||
| >F2 | 0,48 | 67 | 68 | 67 | 77 | 57 |
| >F3 | 0,76 | 72 | 87 | 82 | 76 | 84 |
| F4 | 0,9 | 80 | 89 | 88 | 60 | 96 |
| Zeng’ score | ||||||
| >F2 | 17,2 | 74 | 66 | 70 | 77 | 62 |
| >F3 | 18,9 | 70 | 79 | 76 | 66 | 82 |
| F4 | 21,0 | 75 | 87 | 85 | 54 | 94 |
16. Вирусные гепатиты
Вирусные гепатиты входят в ряд важнейших проблем как гражданского здравоохранения, так и и военно-медицинской службы.
В последнее десятилетие (и особенно в последние 5 лет) произошли существенные изменения представлений об этиологии, патогенезе, принципах лечения и профилактики острых и хронических вирусных гепатитов. Идентифицированы новые гепатотропные вирусы (С, Е, F, G), значительно изменились представления о патогенности вируса гепатита В, появились первые возможности этиотропного лечения вирусных гепатитов.
В мире насчитывается более 500 млн. носителей вируса гепатита В и С. У значительной части их них в будущем возможно развитие хронических заболеваний печени.
Ориентировочные расчеты показывают, что количество инфицированных вирусами гепатита В и С солдат и офицеров составляет, по крайней мере, 30-40 тысяч. Из них около 1.5-2 тысяч нуждаются в активной противовирусной терапии для предотвращения развития цирроза печени и гепатоцеллюлярной карциномы. В трансплантации печени и хирургической коррекции портальной гипертензии ежегодно нуждаются до 100 человек, при этом в течение года 35-40 из них умирают от фатальных осложнений.
Около 20% стационарных больных и 8% медицинских сотрудников госпиталей инфицированы вирусами гепатита В и С и, следовательно, нуждаются в детальном обследовании для выяснения активности патологического процесса.
В настоящее время выделяют 7 типов ВГ — А, В, С, D, Е, F, G. Из них до 1989 года клинико-лабораторно идентифицировались лишь гепатиты А и В, а остальные объединялись общим понятием “гепатит ни А, ни В”. В последние годы стало возможно лабораторное обнаружение маркеров всех видов вирусов, за исключением возбудителя вирусного гепатита F.
Хронизация вирусных заболеваний происходит главным образом при гепатитах В, С и D, для которых характерен парентеральный путь инфицирования. Вирусные гепатиты А и Е выраженной тенденции к хронизации не проявляют. Гепатиты F и G пока еще недостаточно изучены.
В 1994 году предложена новая классификация хронических гепатитов, особенно подчеркивающая значение вирусной этиологии.
В методических рекомендациях обобщены современные данные по вирусным гепатитам, которые представляют интерес для широкого круга специалистов военно-медицинской службы.
ОСТРЫЕ ГЕПАТИТЫ
В этиологическом плане ОВГ представлены рядом самостоятельных заболеваний. Их краткая характеристика дана в таблице 1.
Таблица 1. Характеристика форм острого вирусного гепатита
|
* — список сокращений см. в начале методических рекомендаций |
Из таблицы 1 видно, что переход острого вирусного заболевания в хроническое характерен для гепатитов с парентеральным путем заражения.
16.1. Гепатит А
Гепатит A (также называемый Болезнью Боткина) — острое инфекционное заболевание печени, вызываемоевирусом гепатита A (англ. HAV). Вирус хорошо передается по алиментарному пути, через зараженную пищу и воду, ежегодно вирусом инфицируются около десяти миллионов человек. Инкубационный период составляет от двух до шести недель, в среднем — 28 дней.
В развивающихся странах и в районах с недостаточным уровнем гигиены коэффициент заболеваемости гепатитом A высокий и сама болезнь переносится в раннем детстве в стёртой форме. Образцы океанической воды исследуют на наличие вируса гепатита A при изучении качества воды.
Гепатит A не имеет хронической стадии развития и не вызывает постоянных повреждений печени. После инфицирования иммунная система образует антитела против вируса гепатита A, которые обеспечивают дальнейший иммунитет. Заболевание может быть предотвращено вакцинированием. Вакцина против вируса гепатита A эффективно сдерживает вспышки заболевания по всему миру
Вирус гепатита A (англ. Hepatovirus A) — вид вирусов из одноимённого монотипного рода семействапикорнавирусов. Не имеет оболочки и содержит одноцепочечную (+)РНК, упакованную в белковый капсид.
В 1991 году два пикорнавируса (Human hepatitis A virus и Simian hepatitis A virus), вызывающих гепатит A у людей и обезьян соответственно, выделили в род Hepatovirus. Детальные исследования показали, что обе разновидности, среди которых выявили нескольких вирусных генотипов, принадлежат одному серотипу вируса. В 2014 году название вида было изменено, как и ещё у нескольких видов пикорнавирусов.
В 2015 году было установлено происхождение вируса гепатита A: он имеет животное происхождение. Возник около 25 млн лет назад, когда от семейства мартышковых отделилось семейство человекообразных обезьян. К видуHepatovirus A генетически наиболее близок вирус энцефаломиелита птиц.
Вирус гепатита A имеет слабый внутренний участок посадки рибосомы (англ. IRES). Участок генома, который кодирует капсид вируса, содержит консервативные кластеры кодонов, ограничивающих антигенную вариабельность.
Патология
Ранние симптомы инфицирования гепатитом A (ощущение слабости и недомогания, потери аппетита, тошноты и рвоты, боли в мышцах) могут быть ошибочно приняты за симптомы другой болезни с интоксикацией и лихорадкой, однако у ряда лиц, особенно детей, симптомы не проявляются вообще.
Вирус гепатита A обладает прямым цитопатическим действием, то есть способен непосредственно повреждать гепатоциты. Гепатит A характеризуетсявоспалительными и некротическими изменениями в ткани печени и синдромом интоксикации, увеличением печени и селезёнки, клинико-лабораторными признаками нарушений функции печени, в ряде случаев желтухой с потемнением мочи и обесцвечиванием кала.
После попадания в организм вирус гепатита A проникает в кровеносную систему через клетки эпителия ротовой части глотки или кишечник. Кровь переносит вирус к печени, где вирусные частицы размножаются в гепатоцитах и клетках Купфера (макрофагах печени). Вирионы секретируются в жёлчь и выводятся состулом. Вирусные частицы экскретируются в значительных количествах в среднем около 11 дней до появления симптомов или IgM против вируса гепатита A в крови. Инкубационный период длится от 15 до 50 дней, смертность составляет менее 0,5%.
В гепатоците геномная РНК выходит из белковой оболочки и транслируется на рибосомах клетки. Для инициации трансляции РНК вируса требует эукариотический фактор инициации трансляции 4G (eIF4G).
Диагностика
Так как вирусные частицы экскретируются с калом лишь в конце инкубационного периода, возможна лишь специфическая диагностика наличия анти-HAV IgM в крови. IgM появляются в крови лишь после острой фазы инфекции и могут быть обнаружены через одну или две недели после заражения. Появление IgG в крови свидетельствует об окончании острой фазы и появлении иммунитета к инфекции. IgG против HAV появляются в крови после введения вакцины против вируса гепатита A.
В ходе острой фазы инфекции в крови значительно повышается концентрация фермента печени --аланинтрансферазы, (англ. ALT). Фермент появляется в крови в результате разрушения гепатоцитов вирусом.
16.2. Гепатит В
Гепати́т В — антропонозное вирусное заболевание, вызываемое возбудителем с выраженными гепатотропными свойствами — вирус гепатита B (в специальной литературе его могут обозначать «вирус ГВ», ВГВ или HBV) из семейства гепаднавирусов.
Поверхностный антиген гепатита B открыл в 1964 году американский врач и вирусолог Барух Самуэль Бламберг при изучении образцов крови австралийского аборигена, получивший в последующем за исследования гепатита BНобелевскую премию по физиологии или медицине в 1976 году.
Вирус отличается чрезвычайно высокой устойчивостью к различным физическим и химическим факторам: низким и высоким температурам (в том числе кипячению), многократному замораживанию и оттаиванию, длительному воздействию кислой среды. Во внешней среде при комнатной температуре вирус гепатита B может сохраняться до нескольких недель: даже в засохшем и незаметном пятне крови, на лезвии бритвы, конце иглы. В сыворотке крови при температуре +30°С инфекционность вируса сохраняется в течение 6 месяцев, при температуре −20°С около 15 лет; в сухой плазме — 25 лет. Инактивируется при автоклавировании в течение 30 минут, стерилизации сухим жаром при температуре 160°С в течение 60 минут, прогревании при 60°С в течение 10 часов.
Эпидемиология
Инфицирование вирусом гепатита B (HBV) остается глобальной проблемой здравоохранения, и, по оценкам, около 2 миллиардов людей во всем мире были инфицированы этим вирусом, более 350 миллионов людей больны.
Механизм передачи инфекции — парентеральный. Заражение происходит естественным (половой, вертикальный, бытовой) и искусственным (парентеральным) путями. Вирус присутствует в крови и различных биологических жидкостях — слюне, моче, сперме, влагалищном секрете, менструальной крови и др. Контагиозность (заразность) вируса гепатита B превышает контагиозность ВИЧ в 100 раз.
Наибольшее значение раньше повсеместно имел именно парентеральный путь — заражение при лечебно-диагностических манипуляциях, сопровождающихся нарушением целостности кожного или слизистого покрова через медицинский, стоматологический, маникюрный и прочий инструментарий, трансфузии крови и её препаратов.
В последние годы всё большее значение в развитых странах приобретает половой путь передачи вируса, что обусловлено во-первых, снижением значения парентерального пути (появление разового инструментария, применение эффективных дезинфицирующих средств, ранним выявлением больных доноров), во-вторых так называемой «сексуальной революцией»: частой сменой половых партнёров, практикованием анальных контактов, сопровождающихся бо́льшей травматизацией слизистых и, соответственно, возрастанием риска попадания вируса в кровоток. При этом инфицирование при поцелуях, передача инфекции через молоко матери, а также распространение воздушно-капельным путём считается невозможным. Распространение наркомании также играет большую роль, поскольку «внутривенные» наркоманы входят в группу высокого риска и, что немаловажно, они не являются изолированной группой и с лёгкостью вступают в беспорядочные незащищённые половые отношения с другими людьми. Примерно 16-40 % половых партнёров при незащищённом половом контакте заражаются вирусом.
При бытовом пути заражения инфицирование происходит при пользовании общими бритвами, лезвиями, маникюрными и банными принадлежностями, зубными щётками, полотенцами и т. д. В этом отношении опасны любые микротравмы кожи или слизистых оболочек предметами (или соприкосновение с ними травмированной кожи (потёртости, порезы, трещинки, воспаления кожи, проколы, ожоги и т. п.) или слизистых оболочек), на которых имеется даже микроколичество выделений инфицированных людей (мочи, крови, пота, спермы, слюны и др.) и даже в высушенном виде, незаметном невооружённым глазом. Собраны данные о наличии бытового пути передачи вируса: считается, что если в семье есть носитель вируса, то все члены семьи будут заражены в течение нескольких лет.
Большое значение в странах с интенсивной циркуляцией вируса (высокой заболеваемостью) имеет вертикальный путь передачи, когда ребёнка заражает мать, где также реализуется кровоконтактный механизм. Обычно ребёнок заражается от инфицированной матери во время родов при прохождении через родовые пути. Причём имеет большое значение в каком состоянии находится инфекционный процесс в организме матери. Так, при положительномHBe-антигене, косвенно свидетельствующем о высокой активности процесса, риск инфицирования возрастает до 90 %, тогда как при единственном положительном HBs-антигене — такой риск составляет не более 20 %.
С течением времени в России возрастная структура заболевших острым вирусным гепатитом B существенно меняется. Если в 70-80-х годах сывороточным гепатитом чаще болели 40-50-летние люди, то в последние годы от 70 до 80 % заболевших острым гепатитом B — молодые люди в возрасте 15-29 лет.
Патогенез
Самый значимый патогенетический фактор при вирусном гепатите B — гибель заражённых гепатоцитов вследствие атаки собственными иммунными агентами. Массивная гибель гепатоцитов приводит к нарушению функций печени, прежде всего детоксикационной, в меньшей степени — синтетической.
Течение
Инкубационный период (время с момента заражения до появления симптомов) гепатита B составляет в среднем 12 недель, но может колебаться в пределах от 2 до 6 месяцев. Инфекционный процесс начинается с момента попадания вируса в кровь. После попадания вирусов в печень через кровь идёт скрытая фаза размножения и накопления вирусных частиц. При достижении определённой концентрации вируса в печени развивается острый гепатит B. Иногда острый гепатит проходит для человека практически незаметно, и обнаруживается случайно, иногда протекает в легкой безжелтушной форме — проявляется только недомоганием и снижением работоспособности. Некоторые исследователи полагают, что бессимптомное течение, безжелтушная форма и «желтушный» гепатит составляют равные по количеству поражённых лиц группы. То есть выявленные диагностированные случаи острого гепатита B составляют только одну треть всех случаев острого гепатита. По данным других исследователей на один «желтушный» случай острого гепатита B приходится от 5 до 10 случаев заболеваний, которые как правило не попадают в поле зрения врачей. Между тем представители всех трёх групп потенциально заразны для окружающих.
Острый гепатит либо постепенно сходит на нет с элиминацией вируса и оставлением стойкого иммунитета (функция печени восстанавливается через несколько месяцев, хотя остаточные явления могут сопровождать человека всю жизнь), либо переходит в хроническую форму.
Хронический гепатит B протекает волнообразно, с периодическими (иногда имеющими сезонный характер) обострениями. В специальной литературе этот процесс обычно описывают как фазы интеграции и репликации вируса. Постепенно (интенсивность зависит как от вируса, так и иммунной системы человека) гепатоциты заменяются на клетки стромы, развивается фиброз и цирроз печени. Иногда следствием хронической HBV-инфекции бывает первичноклеточный рак печени (гепатоцеллюлярная карцинома). Присоединение вируса гепатита D к инфекционному процессу резко меняет течение гепатита и увеличивает риск развития цирроза (как правило, у таких больных рак печени не успевает развиться).
Стоит обратить внимание на следующую закономерность: чем раньше человек заболевает, тем вероятность хронизации выше. Например, более 95 % взрослых людей заболевших острым гепатитом B, выздоравливают. А из заболевших гепатитом B новорожденных избавятся от вируса только 5 %. Из заразившихся детей в возрасте 1-6 лет хрониками станут около 30 %.
16.3. Гепатозы
Гепатозы — это группа заболеваний печени, в основе которых лежит нарушение обмена веществ в печёночных клетках (гепатоцитах) и развитие в клетках печени дистрофических изменений. При этом воспалительные явления отсутствуют или слабо выражены.
Классификация
Различают жировые и пигментные гепатозы, имеющие острое и хроническое (чаще) течение. Наиболее распространённым гепатозом является хроническийстеатогепатоз (жировой гепатоз, жировая инфильтрация печени, жировая дистрофия печени).
Различают экзогенные и наследственные факторы развития гепатозов. К экзогенным относятся токсические воздействия (острые и хронические), патология других органов и систем и алиментарные (пищевые) факторы — заболевания щитовидной железы, сахарный диабет, ожирение, синдром Кушинга, дефицит белка, авитаминозы и др. Пигментные гепатозы обусловлены нарушениями обмена билирубина и жёлчных кислот в печени.
Стеатогепатоз — это заболевание печени, сопровождающееся ожирением печёночных клеток. Причины ожирения клеток печени — чаще всего избыточное поступление жиров и углеводов в пищу или их избыточное накопление в крови, вследствие различных нарушений обмена веществ, метаболического синдрома,эндокринные заболевания, воздействие токсических для печени веществ, в том числе алкоголя и гепатотоксических лекарственных средств. Возможно развитие жирового гепатоза вследствие нарушения выведения жира из печени. Это происходит при снижении количества веществ, участвующих в переработке жиров (белок, липотропные факторы). Нарушается образование из жиров фосфолипидов, бета-липопротеинов, лецитина, вследствие чего «лишние» свободные жиры откладываются в печеночных клетках.
17. Цирро́з пе́чени
Цирро́з пе́чени — хроническое заболевание печени, сопровождающееся необратимым замещениемпаренхиматозной ткани печени фиброзной соединительной тканью, или стромой. Цирротичная печень увеличена или уменьшена в размерах, необычно плотная, бугристая, шероховатая. Смерть наступает в зависимости от различного рода случаев в течение двух–четырёх лет с сильными болями и мучениями пациента в терминальной стадии болезни.
Эпидемиология
В экономически развитых странах цирроз входит в число шести основных причин смерти пациентов от 35 до 60 лет, составляя 14—30 случаев на 100 тыс. населения. Ежегодно в мире умирают 40 млн человек от вирусного цирроза печени и гепатоцеллюлярной карциномы, развивающейся на фоне носительства вируса гепатита B. В странах СНГцирроз встречается у 1 % населения.
Чаще наблюдается у мужчин: соотношение мужчин и женщин составляет в среднем 3:1. Заболевание может развиться во всех возрастных группах, но чаще после 40 лет
ЭтиологияЧаще цирроз развивается при длительной интоксикации алкоголем (по разным данным, от 40—50 % до 70—80 %) и на фоне вирусных гепатитов B, С и D (30—40 %) и паразитарных инфекций. Более редкие причины цирроза — болезнижелчевыводящих путей(внутри- и внепечёночных), застойная сердечная недостаточность, различные химические и лекарственные интоксикации. Цирроз может развиваться и при наследственных нарушениях обмена веществ (гемохроматоз, гепатолентикулярная дегенерация, недостаточность α1-антитрипсина) и окклюзионными процессами в системе воротной вены (флебопортальный цирроз). Среди инфекционных факторов: хронические вирусные гепатиты, особенно B и C. и паразитарные инфекции, особенно грибковые и трематодозные(шистосомоз, описторхоз, кандидоз,аспергиллёз). Первичный билиарный цирроз печени возникает первично без видимой причины. Приблизительно у 10—35 % больных этиология остаётся неясной.
За многие месяцы и годы меняется геном гепатоцитов и создаются клоны патологически изменённых клеток. Вследствие этого развивается иммуновоспалительный процесс.
Выделяют следующие этапы патогенеза цирроза:
- Действие этиологических факторов: цитопатогенное действие вирусов, иммунные механизмы, влияние гепатотоксичных цитокинов, хемокинов,прооксидантов, эйкозоноидов, ацетальдегида, железа, продуктов перекисного окисления липидов
- Активизация функции клеток Ито, что приводит к избыточному разрастанию соединительной ткани в пространствах Диссе и перицеллюлярному фиброзу печени
- Нарушение кровоснабжения паренхимы печени за счёт капилляризации синусоидов и уменьшения сосудистого русла с развитием ишемических некрозов гепатоцитов
- Активация иммунных механизмов цитолиза гепатоцитов
При мостовидном некрозе гепатоцитов в зону поражения стягиваются Т-лимфоциты, которые активизируют клетки Ито, приобретающие фибробластоподобные свойства: синтезируют коллаген I типа, что и ведёт в итоге к фиброзу. Кроме того, микроскопически в печёночной паренхиме образуются ложные дольки, не имеющие центральной вены.
Алкогольный цирроз печени. Этапы: острый алкогольный гепатит и жировая дистрофия печени с фиброзом и мезенхимальной реакцией. Важнейший фактор — некроз гепатоцитов, обусловленный прямым токсическим действием алкоголя, а также аутоиммунными процессами.
Вирусный цирроз печени. Важным фактором является сенсибилизация иммуноцитов к собственным тканям организма. Основной мишенью аутоиммунной реакции является печёночный липопротеид.
Застойный цирроз печени. Некроз гепатоцитов связан с гипоксией и венозным застоем.
Развивается портальная гипертензия — повышение давления в системе портальной вены, обусловленное обструкцией внутри- или внепечёночных портальных сосудов. Это приводит к появлению портокавального шунтирования крови, спленомегалии и асцита. Со спленомегалией связаны тромбоцитопения (усиленное депонирование тромбоцитов в селезёнке), лейкопения, а также анемия вследствие повышенного гемолиза эритроцитов. Асцит приводит к ограничению подвижности диафрагмы, гастроэзофагальному рефлюксу с пептическими эрозиями, язвами и кровотечениями из варикозно-расширенных вен пищевода, брюшным грыжам, бактериальному перитониту, гепаторенальному синдрому. У больных циррозом печени часто наблюдаются гепатогенные энцефалопатии.
Первичный билиарный цирроз печени. Основное место принадлежит генетическим нарушениям иммунорегуляции. Вначале происходит разрушение билиарного эпителия с последующим некрозом сегментов канальцев, а позднее — их пролиферация, что сопровождается нарушениями экскреции жёлчи. Стадии процесса следующие:
- хронический негнойный деструктивный холангит
- дуктулярная пролиферация с деструкцией жёлчных канальцев
- рубцевание и уменьшение жёлчных канальцев
- крупноузловой цирроз с холестазом
Патологоанатомическая картина первичного билиарного цирроза включает инфильтрацию эпителия лимфоцитами, плазматическими клетками, макрофагами.
Лабораторными исследованиями выявляются антимитохондриальные антитела (АМА), наиболее специфичны — М2-АМА, направленные против Е2 субъединицы пируватдегидрогеназы, повышение IgM сыворотки. Помимо этого выявляются иммуноопосредованные внепечёночные проявления — тиреоидит Хашимото, синдром Шегрена, фиброзирующий альвеолит, тубулоинтерстициальный нефрит, целиакия, а также сочетание с заболеваниями ревматического круга — системной склеродермией, ревматоидным артритом, системной красной волчанкой
Симптомы
Большинство внепечёночных симптомов обусловлено повышением давления в синусоидах, что ведёт к возрастанию давления в системе воротной вены.Портальная гипертензия. Также характерным симптомом является «голова медузы» — перенаполнение вен передней брюшной стенки.
Для цирроза характерны общие симптомы: слабость, пониженная трудоспособность, неприятные ощущения в животе, диспепсические расстройства, повышение температуры тела, боли в суставах, также отмечаются метеоризм, боль и чувство тяжести в верхней половине живота, похудение, астения. При осмотре выявляется увеличение печени, уплотнение и деформация её поверхности, заострение края. Сначала отмечается равномерное умеренное увеличение обеих долей печени, позднее как правило преобладает увеличение левой доли. Портальная гипертензия проявляется умеренным увеличением селезенки.
Развёрнутая клиническая картина проявляется синдромами печёночно-клеточной недостаточности и портальной гипертензии. Имеют место вздутие живота, плохая переносимость жирной пищи и алкоголя, тошнота, рвота, диарея, чувство тяжести или боль в животе (преимущественно в правом подреберье). В 70 % случаев обнаруживается гепатомегалия, печень уплотнена, край заострён. У 30 % больных при пальпации выявляется узловатая поверхность печени.Спленомегалия у 50 % больных.
Субфебрильная температура, возможно, связана с прохождением через печень кишечных бактериальных пирогенов, которые она не в состоянии обезвредить. Лихорадка резистентна к антибиотикам и проходит только при улучшении функции печени.
Могут быть внешние признаки — пальмарная или плантарная эритема, сосудистые звёздочки, скудный волосяной покров в подмышечной области и на лобке, белые ногти, гинекомастия у мужчин вследствие гиперэстрогенемии. В ряде случаев пальцы приобретают вид «барабанных палочек».
В терминальной стадии болезни в 25 % случаев отмечается уменьшение размеров печени. Также возникают желтуха, асцит, периферические отёки из-загипергидратации (прежде всего отёки ног), внешние венозные коллатерали (варикозно-расширенные вены пищевода, желудка, кишечника). Кровотечение из вен часто заканчивается летальным исходом. Реже возникают геморроидальные кровотечения, они менее интенсивны.
Энцефалопатия может быть следствием как печёночно-клеточной, так и портально-печёночной недостаточности
Осложнения
- печёночная кома
- кровотечение из варикозно-расширенных вен пищевода
- тромбоз в системе воротной вены
- гепаторенальный синдром
- формирование рака печени — гепатоцеллюлярной карциномы
- инфекционные осложнения — пневмонии, «спонтанный» перитонит при асците, сепсис
Диагностика
Характерно повышение активности АЛТ, АСТ, щелочной фосфатазы, лейкоцитоз. При гепатолиенальном синдроме может развиваться гиперспленизм, проявляющийся лейкопенией, тромбоцитопенией, анемией и увеличением клеточных элементов в костном мозге.
Расширенные и извитые венозные коллатерали выявляются при ангиографии, компьютерной томографии, ультразвуковом исследовании или в ходе оперативного вмешательства.
17.1. Классификация
Морфологическая классификация
Предложена Всемирной ассоциацией гепатологов (Акапулько, 1974) и ВОЗ (1978).
- мелкоузловой, или мелконодулярный цирроз (диаметр узлов от 1 до 3 мм)
- крупноузловой, или макронодулярный цирроз (диаметр узлов более 3 мм)
- неполная септальная форма
- смешанная (при которой наблюдаются различные размеры узлов) форма
Этиологическая классификация
Различают следующие формы цирроза:
- вирусный
- алкогольный
- лекарственный
- вторичный билиарный
- врождённый, при следующих заболеваниях:
- гепатолентикулярная дегенерация
- гемохроматоз
- дефицит α1-антитрипсина
- тирозиноз
- галактоземия
- гликогенозы
- застойный (недостаточность кровообращения)
- болезнь и синдром Бадда-Киари
- обменно-алиментарный, при следующих состояниях:
- наложение обходного тонкокишечного анастомоза
- ожирение
- тяжёлые формы сахарного диабета
- цирроз печени неясной этиологии
- криптогенный
- первичный билиарный
- индийский детский
17.2. Оценка тяжести цирроза
Классификация Чайлда — Пью (также Чайлда — Тюркотта — Пью; англ. Child-Pugh, Child-Turcotte-Pugh) — оценочная методика, предназначенная для определения тяжести циррозов печени и выживаемости пациента. Кроме этого методика позволяет оценить необходимость трансплантации печени и вероятность летального исхода операции. Метод превосходит метод APACHE II в прогнозировании летального исхода в первые сутки наблюдения.
Впервые метод опубликован в 1964 году учёными-медиками Мичиганского университета Чарльзом Чайлдом и Джереми Тюркоттом, в 1972 году метод усовершенствован группой британских медиков во главе с Пью.
Метод оценки[править | править вики-текст]
В разных источниках имеются небольшие отличия по числовым данным: границам параметров, вероятности выживаемости и другим.
Тяжесть цирроза печени оценивается по сумме баллов от 1 до 3 для каждого из 5 или 6 параметров. Обычно оценивают следующие признаки.
| Параметр | 1 балл | 2 балла | 3 балла |
|---|---|---|---|
| Билирубин, мкмоль/л(мг%) | менее 34 (2,0) | 34—51 (2,0—3,0) | более 51 (3,0) |
| Альбумин, г | более 3,5 | 2.8-3.5 | менее 2,8 |
| ПТВ, (сек) или ПТИ (%) | 1—4 (более 60) | 4—6 (40—60) | более 6 (менее 40) |
| Асцит | Нет | Мягкий, легко поддаётся лечению | Напряжённый, плохо поддаётся лечению |
| Печеночная энцефалопатия | Нет | Лёгкая (I—II) | Тяжёлая (III—IV)(рефрактерная) |
Класс цирроза выставляется в зависимости от суммы баллов по всем параметрам. Сумма баллов 5-6 соответствует классу A, при сумме 7-9 — класс B, а при общей сумме в 10-15 баллов выставляется класс C.
Ожидаемая продолжительность жизни у больных класса А составляет 15-20 лет, послеоперационная летальность при полостном хирургическом вмешательстве — 10 %. Класс В является показанием для рассмотрения вопроса о пересадке печени; при этом послеоперационная летальность при полостном хирургическом вмешательстве достигает 30 %. У больных класса С ожидаемая продолжительность жизни достигает 1-3 года, а послеоперационная летальность при полостном вмешательстве — 82 %. На основании критериев Чайлда — Пью предложено оценивать необходимость в трансплантации печени: высокая необходимость у больных, относящихся к классу С, умеренная — у больных класса В и низкая — у больных класса А.[3]
Оценки выживаемости больных циррозом печени
Существуют разные оценки выживаемости больных циррозом печени. Например, следующие. Через запятую: в течение года, в течение двух лет.
- Для класса A: 100 %, 85 %
- Для класса B: 81 %, 57 %
- Для класса C: 45 %, 35 %
В последние годы для определения прогноза у пациентов в момент развития желудочно-кишечного кровотечения, комы, сепсиса и других осложнений, используется система критериев SAPS (Simplified Acute Physiology Score), включающая основные физиологические параметры[9]. В стратификации имеют значение: возраст, ЧСС, ЧДД, систолическое артериальное давление, температура тела, диурез, гематокрит, лейкоциты крови, мочевина, калий, натрий, ибикарбонаты плазмы, а также стадия печёночной комы[3]. Критерии оценки по системе SAPS Критерий Баллы 4 3 2 1 0 1 2 3 4 Возраст, годы ≤45 46-55 56-65 66-75 >75 ЧСС в минуту ≥180 140—179 110—139 70-109 55-69 40-54 <40 Систолическое артериальное давление, мм рт. ст. ≥190 150—189 80-149 55-79 <55 Температура тела, ºС ≥41 39,0-40,9 38,5-38,9 36,0-38,4 34,0-35,9 32,0-33,9 30,0-31,9 <30 Частота дыхательных движений в минуту ≥50 35-49 25-34 12-24 10-11 6-9 ИВЛ или ППДВ <6 Количество мочи, л/сут ≥5,00 3,50-4,99 0,70-3,49 0,50-0,69 0,20-0,49 <0,2 Мочевина крови, ммоль/л ≥55 36 −54,9 29 −35,9 7,5 −28,9 3,5 −7,4 <3,5 Гематокрит, % ≥60,0 50,0-59,9 46,0-49,9 30,0-45,9 20,0-29,9 <20,0 Количество лейкоцитов, ×109/л ≥40 20,0-39,9 15,0-19,9 3,0-14,9 1,0-2,9 <1 Глюкоза крови, ммоль/л ≥44,4 27,8-44,3 13,9-27,7 3,9-13,8 2,8-3,8 1,6-2,7 <1,6 Калий крови, мэкв/л ≥7,0 6,0-6,9 5,5-5,9 3,5-5,4 3,0-3,4 2,5-2,9 <2,5 Натрий крови, мэкв/л ≥180 161—179 156—160 151—155 130—150 120—129 110—119 <110 НСО3, мэкв/л ≥40 30,0-39,9 20,0-29,9 10,0-19,9 5,0-9,9 <5,0 Шкала Глазго, баллы 13-15 10-12 7-9 4-6 3 ППДВ — постоянное положительное давление воздухаСистема критериев SAPS
17.3. Прогноз летальности при циррозе печени по шкале Чайлд-Пью (Child-Pugh)
Оценка производится по следующим параметрам:
| Критерий | 1 балл | 2 балла | 3 балла |
|---|---|---|---|
| Общий билирубин, мкмоль/л | <34.2 | 34.2-51.3 | >51.3 |
| Альбумин сыворотки крови, г/л | >35 | 28-35 | <28 |
| МНО | <1.7 | 1.7-2.2 | >2.2 |
| Асцит | Нет | Легкий | Средний или тяжелый |
| Степень энцефалопатии | 0 | 1-2 | 3-4 |
Степень энцефалофапатии (согласно FDA)
- Степень 0: ясное сознание; ориентированность в личности, времени, пространстве; нормальный неврологический статус; нормальная энцефалограмма
- Степень 1: беспокойство, нарушение сна, раздражительность, тремор, нарушения письменной речи
- Степень 2: сонливость, дезориентированность во времени, астериксис, атаксия, медленные трехфазные волны
- Степень 3: сомноленция или ступор, дезориентированность в месте, гиперрефлексия, ригидность, на ЭЭГ более медленные волны
- Степень 4: кома, на ЭЭГ дельта-активность
Интерпретация
- <7 баллов: Класс A. Продолжительность жизни: 15-20 лет. Периоперационная летальность при абдоминальных операциях: 10%.
- ≥7 - <10 баллов: Класс B. Значительное функциональное ухудшение. Периоперационная летальность при абдоминальных операциях: 30%.
- ≥10 баллов: Класс C. Продолжительность жизни: 1-3 года. Периоперационная летальность при абдоминальных операциях: 82%.
Дополнительные сведения
У пациентов с неожиданно высокими или низкими баллами рассмотрите возможность сравнения результатов с результатами по шкале MELD.
17.4. Формулировка диагноза цирроза
Диагноз выставляется по следующей схеме:
- Основной:
- Цирроз печени,
- морфология (если есть), этиология,
- активность, класс по шкале Чайлда-Пью, стадия компенсации.
- Осложнения:
- Портальная гипертензия.
- Присутствующие синдромы (асцит, варикозно-расширенные вены пищевода (степень расширения)),
- гиперспленизм (степень),
- энцефалопатия (этиология, степень, стадия …)
17.5. Лечение
Лечение
Лечение цирроза печени заключается в употреблении лекарственных препаратов и строгим соблюдением диеты, однако сформировавшийся цирроз печени является необратимым состоянием.
Профилактические мероприятия
- предупреждение заражения острым вирусным гепатитом
- отказ от алкоголя
- защита от гепатотоксических препаратов
Диета
Диета при ЦП должна быть полноценной, содержащей 70—100 г белка (1—1,5 г на 1 кг массы тела), 80—90 г жиров (из них 50 % — растительного происхождения), 400—500 г углеводов. Необходимо учитывать привычки больного, переносимость продуктов и сопутствующие заболевания органов пищеварения. Исключаются химические добавки, консерванты и токсические ингредиенты. Диета модифицируется при наличии осложнений портальной гипертензии (отечно-асцитический, гепаторенальный синдром, печёночная энцефалопатия и др.).
Урсодезоксихолевая кислота
Для восполнения дефицита жёлчных кислот в кишечнике, вызванного билиарной недостаточностью, целесообразно применять урсодезоксихолевую кислоту(УДХК). Дозировка 10-15 мг на 1 кг веса пациента 1 раз в день на ночь способствует восстановлению процессов пищеварения. Действие УДХК включает следующие моменты:
- увеличение поступления жёлчи и панкреатического сока в кишку за счёт стимуляции их продукции
- разрешение внутрипечёночного холестаза
- усиление сокращения жёлчного пузыря
- омыление жиров и повышения активности липазы
- повышение моторики кишечника, улучшающей смешивание ферментов с химусом
- нормализация иммунного ответа, снятие аутоимунного поражения печени
Гепатопротекторы
- Семена расторопши пятнистой и другие желчегонные препараты запрещены к использованию при циррозе.
Клеточная терапия
Традиционное лечение в основном заключается в применении фармацевтических средств для защиты печёночных клеток от повреждения, стимуляции выделения жёлчи, коррекции нарушений обмена веществ. Без сомнения, это улучшает состояние больного, но не в силах остановить развитие заболевания. Если вышеуказанные методы лечения не помогают, проводят трансплантацию (пересадку) печени.