Функциональная биохимия почек и маркеры их повреждения
| Сайт: | Электронный информационно- образовательный портал ВолгГМУ |
| Курс: | Дисциплина Медицинская биохимия. Принципы измерительных технологий в биохимии. Патохимия, диагностика. Биохимия злокачественного роста». Часть 3 |
| Книга: | Функциональная биохимия почек и маркеры их повреждения |
| Напечатано:: | Гость |
| Дата: | Вторник, 21 Май 2024, 18:29 |
Оглавление
- 1. Локализация биомаркеров в нефроне
- 2. Болезнь минимальных изменений (липоидный нефроз; болезнь Нила)
- 3. Острая почечная недостаточность
- 4. Эпидемиология ОПП
- 5. Классификация биомаркеров ОПП
- 6. Биомаркеры острого повреждения почек (AKI)
- 7. Липокалин-2 (NGAL)
- 8. KIM-1
- 9. L-FABP — белок
- 10. N-ацетил-b-D-глюкозаминидаза (NAG)
- 11. Сосудисто-эндотелиального фактора роста (VEGF)
- 12. Человеческий трансформирующий фактор роста бета-1 (TGF-β1)
2. Болезнь минимальных изменений (липоидный нефроз; болезнь Нила)
Болезнь минимальных изменений имеет острое начало и проявляется отеками и тяжелой протеинурией, главным образом у детей. Почечная функция обычно сохранена. Диагноз устанавливается эмпирически или на основании биопсии почки. Прогноз благоприятный. Лечение включает назначение глюкокортикоидов или циклофосфамида или циклоспорина для пациентов, не отвечающих на глюкокортикоидную терапию.Болезнь минимальных изменений (БМИ) является самой частой причиной нефротического синдрома у детей 4–8 лет (80–90% нефротического синдрома у детей), но она также встречается и у взрослых (10–20% нефротического синдрома у взрослых). Причина почти всегда неизвестна, хотя в редких случаях возможно вторичное развитие болезни на фоне приема лекарственных препаратов (особенно НПВС) и лимфопролиферативных заболеваний (особенно лимфомы Ходжкина).
3. Острая почечная недостаточность
В 2004 г. в г. Виченце (Италия) экспертами трех нефрологических ассоциаций (Национального почечного фонда США (National Kidney Foundation, NKF), Американского общества нефрологов (American Society of Nephrology, ASN) и Международного общества нефрологов (ISN)) и Европейского общества интенсивной терапии (European Society of Intensive Care Medicine, ESICM) была впервые предложена концепция «острого повреждения почек» (ОПП, acute kidney injury (AKI)).
При этом ОПП рассматривалось как более широкое понятие, чем собственно острая почечная недостаточность (ОПН). Согласно заключению экспертов, диагноз «острое повреждение почек» может устанавливаться при быстром (в течение 48 часов) снижении функции почек, которое определяется как нарастание абсолютных значений концентрации креатинина в сыворотке крови на 26 мкмоль/л или более; относительном повышении концентрации сывороточного креатинина, равном или большем 50% (в 1,5 раза от базального уровня) или снижении объема мочи (диурез менее 0,5 мл/кг массы тела/ч в течение 6 часов)
Mehta R. L., Kellum J. A., Shah S. V. et al. Acute Kidney Injury Network: report of initiative to improve outcomes in acute kidney injury // Crit Care. 2007; 11 (2): R31.

4. Эпидемиология ОПП
В целом ОПП развивается у 7% всех госпитализированных пациентов, в том числе у 30% пациентов, находящихся в отделениях реанимации и интенсивной терапии (ОРИТ) [4].
Вероятность возникновения ОПП после кардиохирургических вмешательств достигает 9,5% [5, 6].
Последствия ОПП могут быть тяжелыми: у 50% пациентов, находившихся на остром гемодиализе, имел место летальный исход, а у 25% пациентов через три года после восстановления функции почек развивается терминальная хроническая почечная недостаточность. ОПП является причиной 4 млн смертей в год [7].
Смертность среди пациентов, находящихся в ОРИТ с послеоперационными ОПП и нуждающихся в экстренной заместительной почечной терапии, варьирует от 40% до 60% [8, 9].
Критерии, основанные на показателях концентрации сывороточного креатинина и количестве выделяемой мочи, не обеспечивают раннего обнаружения наступающего ОПП. Уровень креатинина повышается через 2–3 дня после наступления ОПП. Как утверждают Devarajan P. и соавт. [10], измерение сывороточного креатинина для выработки надежного терапевтического вмешательства при ОПП аналогично промедлению на 2–3 дня с началом терапии пациентов с инфарктом миокарда и острым нарушением мозгового кровообращения.
С другой стороны, Waikar S. S. и соавт. отметили, что снижение скорости клубочковой фильтрации (СКФ) не всегда наблюдается даже в случаях тяжелого паренхиматозного повреждения почек, в то же время редукция СКФ может встречаться в ситуациях без явной почечной патологии
4. De Mendonca A., Vincent J. L., Suter P. M. et al. Acute renal failure in the ICU: Risk factors and outcome evaluated by the SOFA score // Intensive Care Med. 2000; 26: 915–921.
5. Mangos G. J., Brown M. A., Chan W. Y., Horton D., Trew P., Whitworth J. A. Acute renal failure following cardiac surgery: Incidence, outcomes and risk factors // Aust. N. Z. J. Med. 1995; 25: 284–289.
6. Hein O. V., Birnbaum J. M., Wernecke K. D. et al. Three-year survival after four major postcardiac operative complications // Crit. Care Med. 2006; 34: 2729–2737.
7. Waikar S. S., Liu K. D., Chertow G. M. Diagnosis, epidemiology and outcomes of acute kidney injury // Clin. J. Am. Soc. Nephrol. 2008; 3 (3): 844–861.
8. Zanardo G., Michielon P., Paccagnella A. et al. Acute renal failure in the patient undergoing cardiac operation // J. Thorac. Cardiovasc. Surg. 1994; 107: 1489–1495.
9. Bove T., Calabro M. J., Landoni G. et al. The incidence and risk of acute renal failure after cardiac surgey // J. Cardiothorac. Vasc. Anesth. 2004; 18: 442–445.
10. Devarajan P. Emerging urinary biomarkers in the diagnosis of acute kidney injury // Expert. Opin. Med. Diag. 2008; 2 (4): 387–398.
11. Melnikov V. Y., Molitoris B. A. Improvements in the diagnosis of acute kidney injury // Saudi J Kidney Dis Transpl. 2008; 19 (4): 537–544.
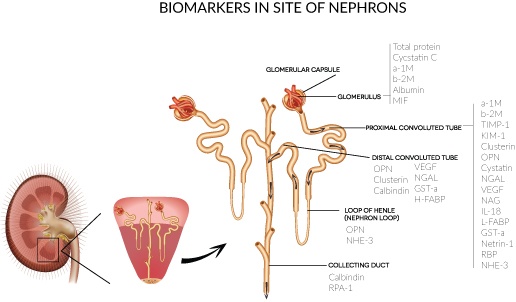
5. Классификация биомаркеров ОПП
Классификация биомаркеров ОПП
I Топическая классификация
|
1. Клубочек |
Альбумин, цистатин С сыворотки, альфа1-микроглобулин, бета2-микроглобулин и др. |
|
2. Проксимальный каналец |
NGAL, KIM-1, L-FABP, цистатин С мочи, IL-18 и др. |
|
3. Дистальный каналец |
GST, NGAL |
|
4. Собирательная трубка |
Калибиндин D28 5. Петля Генле Остеопонтин, NHE-3 |
II Патофизиологическая классификация
|
1. Биомаркеры функции почек |
Креатинин, цистатин С сыворотки и др. |
|
2. Биомаркеры оксидативного стресса |
8(А2а)-изопростан, 4-ОН-2-ноненал и др. |
|
3. Биомаркеры структурного и клеточного повреждения: |
|
|
- подоцитов |
Подокаликсин, нефрин |
|
- тубулоинтерстиция |
NGAL, KIM-1, L-FABP |
|
- факторы экзосомальной транскрипции АТФ3 |
|
|
4. Маркеры иммунного ответа |
Иммуноглобулины, хемокины, компоненты комплемента |
|
5. Маркеры фиброза |
TGF- β1, CTGF, Βig-H3, Collagen type IV |
|
6. Маркеры апоптоза |
Аннексин-5 |
III. Клиническая классификация
1. Маркер в качестве фактора риска развития ОПП
2. Маркер, использующийся при скрининге ОПП
3. Диагностический маркер, указывающий на патогенетический вариант ОПП
4. Биомаркер, стратифицирующий тяжесть процесса
5. Маркер с высокой предиктивной значимостью
6. Маркер, характеризующий ответ на терапию
IV. Рабочая классификация
|
1. Белки, экспрессия которых повышается при ОПП |
NGAL, L-FABP, KIM-1, IL-18 |
|
2. Функциональные маркеры |
Цистатин С сыворотки |
|
3. Низкомолекулярные белки мочи |
Цистатин С мочи, альфа1-микроглобулин, бета2-микроглобулин |
|
4. Внутриклеточные энзимы |
NAG, a-GST, p-GST, ГГТП, ЩФ |
Примечание. NGAL – липокалин, ассоциированный с желатиназой нейтрофилов, KIM-1 – молекула почечного повреждения, L-FABP – печеночный протеин, связывающий жирные кислоты, GST – глутатион-S-трансфераза, NHE-3 – натрий-водородный об- менник 3, TGF-β1 – фактор роста опухолей β1, CTGF – фактор роста соединительной ткани, NAG – N-ацетил-D-глюкозаминидаза, ГГТП – гамма-глутамилтранспептидаза, ЩФ – щелочная фосфатаза [Смирнов А.В., Добронравов В.А., Румянцев А.Ш., Каю- ков И.Г. Острое повреждение почек. МИА, М., 2015; с разрешения издательства].
6. Биомаркеры острого повреждения почек (AKI)

Функциональная классификация биомаркеров
| Маркеры функции почек |
Канальцевые ферменты |
Регуляторные пептиды |
|
Creatinine |
Alanine Amino Peptidase |
KIM-1 |
|
Cystatin C |
Alkaline Phosphatase |
Clusterin |
|
Β-2 Microglobulin |
α-Glutathione-S-Transferase |
NGAL |
|
Retinol-binding Protein |
ϒ-Glutamyl Transpeptidase |
IL-18 |
|
Microalbumin |
N-Acetyl-β-Glucosamidase |
Cysteine-Rich Protein |
7. Липокалин-2 (NGAL)
Биологическая роль NGAL
NGAL «нормализует» поврежденные ткани за счет:
- участия в процессе апопотоза,
- повышения выживаемости поврежденных клеточных структур,
- восстановления поврежденного эпителия,
- стимулирования дифференцировки и структурной реорганизации ренальных эпителиальных клеток.
NGAL Образует комплексы с микробными сидерофорами (железо переносящие белки животных и бактерий), связывает железо, необходимое микробам и, тем самым, тормозит их рост  (http://www.nature.com/nrneph/journal/v9/n7/fig_tab/nrneph.2013.98_F1.html).
(http://www.nature.com/nrneph/journal/v9/n7/fig_tab/nrneph.2013.98_F1.html).
При патологиях NGAL может стимулировать:
- злокачественный рост,
- ремоделирование атеросклеротических бляшек,
- ремоделирование миоцитов при ишемических повреждениях миокарда.
Липокалин-2 является одним из наиболее информативных биомаркеров ОПП. Первоначально NGAL был выделен из супернатанта активированных нейтрофилов человека и позднее был обнаружен в тубулярном эпителии почек. Липокалин-2 выходит в плазму крови из вторичных гранул активированных нейтрофилов, но синтезироваться он может в разных органах и в разных типах их клеток. Липокалин-2 является белком-компонентом острой фазы воспалительного ответа. Его основные функции заключаются в стимулировании пролиферации поврежденных клеток, в первую очередь, эпителиальных, а также в противодействии бактериальным инфекциям [12].
Одним из методов количественного определения липокалина-2 является хемилюминесцентный иммуноанализ на парамагнитных микрочастицах.
7.1. Особенности синтеза и экскреции липокалина-2
Повышение синтеза NGAL в клетках проксимальных канальцев вызывается нарушениями, связанными с ишемией почечной паренхимы и ее поражениями нефротоксическими соединениями.
Природа и источники NGAL в плазме крови и мочи во время AKI. Системное воспаление индуцирует синтез NGAL в экстраренальных тканях и высвобождение NGAL из нейтрофилов. Мочевые NGAL возрастают вследствие нарушение реабсорбции отфильтрованной мочи (понижающая регуляция Megalin-cubulin рецепторов в проксимальных канальцах), увеличение синтеза из нагруженных тубулярных клеткок в дистальной части нефрона и высвобождении при инфильтрации нейтрофилами. Нейтрофилы главным образом выделяют димерную форму (и в некоторой степени мономерную форму), в то время как канальцевые клетки в основном продуцируют мономерную форму и в некоторое количество NGAL, конъюгированного с ММР-9 (Гетеродимерный NGAL).

В целом у человека в ответ на повреждение ренальных канальцев уровень NGAL резко возрастает как в плазме крови (уровень сывороточного NGAL (s-NGAL) повышается в 7–16 раз), так и в моче (уровень NGAL в моче (u-NGAL) увеличивается в 25–1000 раз) . При этом экскреция NGAL с мочой на 24–48 часов опережает повышение концентрации креатинина в сыворотке крови.
При ОПП источниками высоких уровней s-NGAL являются печень, легкие, нейтрофилы, макрофаги и другие клетки иммунной системы. Оказалось, что хотя s-NGAL свободно фильтруется клубочками, он в большой степени реабсорбируется в проксимальных канальцах за счет эндоцитоза. Показано, что при ОПП происходит быстрое 1000?кратное увеличение синтеза мРНК, кодирующей u-NGAL, в восходящем колене петли Генле и в собирательных трубочках. По этой причине в моче преобладает «ренальный» пул NGAL, синтезируемый в почках, которые не поступает в систему кровообращения, а полностью экскретируется в мочу. Изучение причин и механизмов повышения уровней NGAL в сыворотке крови и моче послужили основой для разработки метода ранней диагностики ОПП.
7.2. Клиническое применения NGAL
Области клинического применения NGAL
Липокалин-2 как показатель нефротоксичности фармпрепаратов
Wasilewska A. и соавт. наблюдали 19 детей со стероидзависимым нефротическим синдромом, получающих циклоспорин, у которых измерялись уровни NGAL в моче и в плазме крови. Перед назначением циклоспорина уровни указанных маркеров были такими же, как и в контрольной группе, однако они повысились во время применения данного препарата. Была отмечена прямая зависимость между уровнями липокалина-2 в моче и сыворотке крови и концентрацией циклоспорина в сыворотке крови пациентов [20].
Предполагается, что измерение уровня липокалина-2 может быть полезным как для проверки эффективности новых фармпрепаратов, так и для выявления их возможной нефротоксичности [21, 22].
Липокалин-2 в качестве предиктора рентгеноконтрастной нефропатии
Рентгеноконтрастная нефропатия (РКН) является одной из наиболее частых причин развития ОПП в условиях стационара и способствует повышению острой госпитальной и отдаленной смертности. В настоящее время методы ранней диагностики и прогнозирования РКН остаются несовершенными.
Частота возникновения РКН у госпитализированных пациентов варьирует от 1% до 6%, однако при наличии факторов риска она может развиваться более чем в 50% случаев. РКН является одной из наиболее распространенных причин почечной недостаточности в условиях стационара и занимает 3?е место среди всех причин возникновения ОПН.
Ряд исследований показал, что NGAL может быть предиктором РКН. В многоцентровом исследовании Malyszko J. и соавт. наблюдали пациентов с исходно нормальными уровнями сывороточного креатинина, подвергшихся чрескожным коронарным вмешательствам (ЧКВ). РКН диагностировалась у 11% пациентов, у которых уровни s-NGAL были значительно повышены через 2 часа, а уровни u-NGAL через 4 часа после проведения ЧКВ [23]. В другом исследовании измерялся уровень s-NGAL до ЧКВ и через 2, 4, 12, 24 и 48 часов после него. Повышение уровня s-NGAL через 2 часа после ЧКВ коррелировало с концентрацией сывороточного креатинина, длительностью ЧКВ и объемом введенного рентгеноконтрастного препарата. Таким образом, липокалин-2 может использоваться как ранний маркер острого повреждения почек после ЧКВ [24].
Липокалин-2 после кардиохирургических вмешательств
Ишемическое повреждение почек после кардиохирургических операций, проведенных с применением аппарата искусственного кровообращения (АИК), является частой причиной ОПП. В исследовании Koyner J. L. и соавт. наблюдали 72 взрослых пациента после аортокоронарного шунтирования (АКШ) в условиях АИК, из них у 47% развилось ОПП. Уровни u-NGAL, измеренные через 6 часов, предсказывали ОПП [25]. В педиатрической практике весьма впечатляющими были наблюдения Bennett M. и соавт. за 196 пациентами, у 51% из них после АКШ развилось ОПП. При этом уровни u-NGAL через 2 часа после операции до повышения концентрации креатинина в сыворотке крови возрастал в 15 раз, а через 4–6 часов — в 25 раз. Чувствительность теста составила 82%, специфичность — 90%. Степень повышения концентрации липокалина-2 в моче коррелировала с тяжестью и длительностью ОПП, с потребностью в остром гемодиализе и летальностью больных [26].
Липокалин-2 при гемолитическом уремическом синдроме
Гемолитический уремический синдром (ГУС), связанный с диареей, является одной из самых частых причин ОПП у детей. В многоцентровом исследовании 34 детей с ГУС в течение 5 дней после госпитализации измерялись уровни u-NGAL. У 58% детей обнаруживался повышенный уровень липокалина-2, у 29% пациентов с наиболее высоким u-NGAL впоследствии развилась острая почечная недостаточность, потребовавшая проведения экстренного гемодиализа [27].
Липокалин-2 при остром сепсисе
ОПП при остром сепсисе по сравнению с другими формами ОПП характеризуется более неблагоприятным прогнозом, низким уровнем выживаемости и более длительным сроком госпитализации как у детей, так и у взрослых. В одном из последних исследований Bagshaw S. M. и соавт. наблюдали 83 пациента, поступивших в отделение хирургической терапии, у половины из которых был диагностирован септический шок. Уровни NGAL в крови и в моче больных измерялись через 12, 24 и 48 часов, самые высокие значения уровня липокалина-2 были связаны с септическим шоком [28].
Липокалин-2 как предиктор преэклампсии
Установлено, что повышенный уровень s-NGAL может служить фактором прогноза развития тяжелой нефропатии беременных и преэклампсии. В исследовании Danna R. и соавт. показано, что четырехкратное по сравнению с нормой повышение уровня s-NGAL во втором триместре беременности сопровождается последующим развитием преэклампсии и ОПН. По мнению авторов, сывороточный NGAL вовлечен в патофизиологию преэклампсии и может быть ранним признаком этого синдрома [29].
Липокалин-2 у пациентов, находящихся в ОРИТ
Пациенты отделения ОРИТ нуждаются в экстренном определении причины критического состояния. В исследовании Nickolas T. L. и соавт. приняли участие более 600 пациентов с полиорганной недостаточностью, включая острую и хроническую почечную недостаточность и преренальную азотемию. У больных проводилось измерение u-NGAL, концентрации креатинина сыворотки крови и др. показателей. Установлено, что однократное определение u-NGAL позволяет отдифференцировать ОПП от преренальной азотемии и хронической почечной недостаточности, прогнозировать исход и выбрать эффективную тактику ведения пациентов. Наиболее высокие уровни u-NGAL были зафиксированы в группе пациентов ОРИТ со 100-процентной летальностью [30].
При метаанализе, включавшем 19 исследований, проведенных с участием более чем 2500 пациентов в 8 странах мира, установлено, что уровень NGAL в крови и в моче является ранним диагностическим признаком и прогностически значимым биомаркером ОПП разной этиологии как у детей, так и у взрослых.
7.3. Статистические показатели роли NGAL в диагностике ОПП
|
Вариант ОПП |
Биоматериал |
АUC |
PPV, % |
NPV, % |
Sе, % |
Sp, % |
|
ОПП после кардиохирургических вмешательств |
Кровь |
0,76 |
52,3 |
90,6 |
67,9 |
83,0 |
|
|
Моча |
0,77 |
48,4 |
67,7 |
75,7 |
76,0 |
|
ОПП у пациентов в ОРИТ |
Кровь |
0,79 |
64,7 |
81,5 |
78,5 |
77,5 |
|
|
Моча 0,76 |
87,7 |
82,0 |
70,6 |
79,9 |
|
|
Рентгеноконтрастная нефропатия |
Кровь |
0,73 |
20,0 |
97,0 |
— |
— |
|
|
Моча |
|
|
|
|
|
|
ОПП у пациентов в приемном отделении |
Кровь |
0,82 |
70,0 |
99,0 |
— |
— |
|
|
Моча |
0,88 |
15,0 |
98,0 |
— |
— |
Примечание (здесь и далее). AUC (area under curve) – среднее значение площади под характеристической кривой диагностического теста (ROC-кривой – receiver operating characteristics); PPV (positive predictive value) – среднее значение прогностической ценности положительного результата (отношение истинно положительных результатов к положительным результатам, определенным с применением диагностического теста); NPV (negative predictive value) – среднее значение прогностической ценности отрицательного результата (отношение истинно отрицательных результатов к отрицательным результатам, определенным с применением диагностического теста); Se (sensitivity) – чувствительность диагностического теста (доля лиц с заболеванием,имеющих положительный результат диагностического теста); Sp (specificity) – специфичность диагностического теста (доля лиц без заболевания, имеющих отрицательный результат диагностического теста); данные представлены на основании обзоров исследований, опубликованных в 2013 г. [Tsigou E., Psallida V., Demponeras C., 2013; Vanmassenhove J., Vanholder R., Nagler E. и соавт., 2013]; статистические термины переведены в соответствии с работой М. Михайловской, М. Шерстобитова, (2009).
8. KIM-1
Структура KIM-1. КИМ-1 представляет собой мембранный гликопротеин типа 1, который содержит в своей внеклеточной части, новый шести-цистеиновый иммуноглобулин-подобный домен, два сайта N-гликозилирования и Т/SP богатый домен с характерным для муциноподобных белков O-гликозилированнием . Существует один трансмембранный домен и короткий внутриклеточный домен с фосфорилированием тирозина сигнальный мотив, присутствующей в почечной форме (КИМ-1b)


9. L-FABP — белок
L-FABP — белок, связывающий жирные кислоты, печеночная форма
Печеночная форма белка L-FABP экспрессируется не только в печени, а также и в почках (в извитой и прямой частях почечных канальцев). L-FABP в моче (уL-FABP) — чувствительный маркер повреждения. При ОПП, вызванном цисплатиной, L-FABP растет в первые 24 ч., а сывороточный креатинин (сКр) — только через 72 ч. Концентрация L-FABP коррелирует с временем ишемии трансплантированной почки и перитубулярным капиллярным кровотоком (в обоих случаях р<0,0001), а также со временем госпитализации (р<0,05). L-FABP увеличивается с 20 до 1885 нг/мл креатинина за 4 ч. у пациентов с ОПП после операции на сердце. Концентрация L-FABP в моче повышена у пациентов с недиабетической ХБП, ранней диабетической нефропатией, идиопатическим фокальным гломерулосклерозом и поликистозом почки. Другое обстоятельство, связанное с его ограниченным применением как маркера ОПП, заключается в том, что белок значительно экспрессируется в печени, свободно фильтруется клубочками, как и NGAL, но большая часть быстро реабсорбируется мегалинзависимым механизмом в проксимальных канальцах. Появились первые обнадеживающие данные о том, что вклад L-FABP из плазмы при ХБП — только около 3%, что свидетельствует о специфичности определения маркера именно для повреждения почек. Так, в подтверждении этому у пациентов после операции на сердце с рано развившейся печеночной недостаточностью было обнаружено повышение концентрации сывороточного L-FABP через 12 ч. после операции, но не через 4 ч. И, наоборот, уL-FABP в этой группе пациентов, резко поднявшись в первые 4 ч., к 12 ч. начал снижаться. Эти факты согласуются с гипотезой, что у пациентов с развившейся ОПП рост уL-FABP к 4 ч. после операции скорее связан с усиленным шеддингом белка в проксимальных канальцах, чем с растущей фильтрацией белка в плазме. В клинических исследованиях среди пациентов с ХБП, уL-FABP точно отражает степень тубулоинтерстициального повреждений и коррелирует со скоростью прогрессирования ХБП. Кроме того, многоцентровое исследование показало, что уL-FABP более чувствителен, чем протеинурия в прогнозировании прогрессирования ХБП. В отношении диабетической нефропатии и ОПП, уL-FABP является маркером ранней диагностики заболевания почек или предиктором ранней почечной патологии.
После многих клинических исследований, уL-FABP был утвержден в качестве нового канальцевого биомаркера обнародованного Министерством здравоохранения, труда и благосостояния Японии
10. N-ацетил-b-D-глюкозаминидаза (NAG)
Среди лизосомальных ферментов, обнаруживаемых в моче, для ранней диагностики поражения почек может быть использован NAG, высокая активность которого проявляется в клетках проксимальных почечных канальцев. Так, в ряде исследований выявлено повышение данного энзима в моче, что свидетельствует о ранних признаках хронического тубулоинтерстициального нефрита еще до появления микроальбуминурии и увеличения креатинина крови
11. Сосудисто-эндотелиального фактора роста (VEGF)
VEGF, играя важную роль в
поддержании стабильности эндотелия и физиологическом неоангиогенезе,
одновременно принимает активное участие в процессах неоваскуляризации в
патологических ситуациях, в частности в росте атеросклеротической бляшки и
неопластических процессах при онкогенезе.
В настоящее время описаны многочисленные представители семейства VEGF: А, В, С, D и Е. Присутствие множества форм VEGF наводит на мысль о высокой дифференциации регуляции процессов васкулогенеза и ангиогенеза [22]. VEGF А был открыт первым, он наиболее изучен и является широко распространенным объектом исследований. Транскрипция в ответ на гипоксию, в частности, является особенностью VEGF A в отличие от других членов VEGF-семейства и других ангиогенных факторов [22]. VEGF способен влиять на состояние липидного обмена — снижать токсичность липопротеидов низкой плотности по отношению к эндотелию [22].
Экспрессия VEGF стимулируется множеством проангиогенных факторов, включая эпидермальный ростовой фактор, основной фибробластный ростовой фактор, тромбоцитарный ростовой фактор и интерлейкин-1. Кроме того, уровни VEGF непосредственно регулируются такими факторами окружающей среды, как рН, давление и концентрация кислорода. На уровни VEGF влияют содержание глюкозы натощак, липопротеидов и другие метаболические факторы [22].
В ряде работ приводятся данные, которые могут указывать на связь уровней VEGF с показателями липидного обмена и факторами воспаления. Так, J. Trape и соавт. (2006) в своей работе выявили достоверно более высокие уровни VEGF у больных, у которых уровень холестерина изначально был более 6,1 ммоль/л по сравнению с больными с содержанием холестерина менее 5,1 ммоль/л. Ими также была выявлена положительная корреляция между уровнем VEGF и уровнем С-реактивного белка в крови [23]. В другом исследовании описано достоверное повышение уровней VEGF у больных АГ при развитии нефропатии. Выявлена прямая корреляция между величиной микроальбуминурии и уровнем экскреции с мочой молекулярных медиаторов PAI-1, TGF-p1, а также уровнем VEGF и коллагена IV типа. Указанные показатели отражают как наличие эндотелиальной дисфункции, так и активацию механизмов фиброгенеза, которые являются звеньями процессов ремоделирования микрососудистого русла почки при гипертонической нефропатии [22, 24-26].
Выявлено повышение уровня VEGF в крови у больных с абдоминальным ожирением [27]. С учетом хорошо доказанной взаимосвязи абдоминального ожирения с АГ эти данные подтверждают описанное выше увеличение уровня VEGF в крови при ГБ.
Дополнительным подтверждением участия VEGF в патогенезе АГ могут служить и приведенные в литературе данные о влиянии отдельных антигипертензивных препаратов на показатели VEGF в крови [28]. Так, обнаружено достоверное снижение уровня VEGF в сыворотке крови у больных ГБ после 12-недельной монотерапии блокатором рецепторов ангиотензина II телмисартаном [22].
Исследования, проведенные И.Н. Бобковой, Л.В. Козловской с соавт. показали высокий уровень экскреции маркеров эндотелиальной дисфункции у пациентов с хроническим гломерулонефритом и тубулоинтерстициальным фиброзом (ТИФ) по сравнению с группой пациентов без ТИФ, но при прогрессирующем течении нефрита уровень в моче VEGF снижался, что свидетельствовало о нарушении способности эндотелия к регенерации [29]. Имеются также сведения, согласно которым не было выявлено различий между сывороточными и мочевыми показателями VEGF у пациентов с гломерулярным склерозом, ТИФ, амилоидозом почки, различными формами гломерулонефрита и у контрольной группы пациентов. Была обнаружена лишь корреляция между уровнем креатинина крови и уровнем экскреции VEGF, а также количеством эритроцитов в моче и VEGF [30].
В исследовании (А.П. Реброва и соавт.) биомаркеров VEGF, МСР-1 в моче и сыворотке крови среди пациентов с системной красной волчанкой (СКВ), было выявлено достоверное повышение данных маркеров по сравнению с группой контроля, причем как в моче, так и в сыворотке крови, что свидетельствует об активности воспалительного процесса у больных с СКВ на уровне не только эпителия мочевыводящих путей, но и экстрацеллюлярного матрикса почечной паренхимы, т.е. о развитии процессов тубулоинтерстициального фиброза и эндотелиальной дисфункции [31].
С другой стороны есть ряд работ, где указано снижение уровня VEGF-A. В покое у больных с ишемической болезнью сердца (ИБС) и умеренно выраженным коронарным атеросклерозом уровень VEGF может не отличаться от такового у здоровых лиц [22]. В ряде работ изучался полиморфизм гена VEGF у больных ИБС. Было, в частности, показано, что 2578-полиморфизм VEGF ассоциируется с тяжестью ИБС, предположительно, из-за снижения экспрессии VEGF [32]. Таким образом, возможна протективная роль VEGF при атеросклерозе. Можно предположить, что для пациентов с относительно сниженной способностью к компенсации кровообращения при поражении коронарного русла, которое, в конечном счете, проявляется развитием некроза миокарда, более характерно снижение (а возможно, и отсутствие компенсаторного повышения) уровня VEGF на фоне ишемии миокарда. В ряде работ изучалось изменение уровней факторов ангиогенеза в динамике лечения ИБС. Так, показано снижение уровня VEGF у больных ИБС после устранения ишемии миокарда после реваскуляризации, а также после применения статинов
12. Человеческий трансформирующий фактор роста бета-1 (TGF-β1)
TGF-β1 — мультифункциональный цитокин, впервые выделенный из тромбоцитов в 1990-х гг. [33]. Свое название TGF-β получил благодаря способности стимулировать рост клеток и вызывать их трансформацию in vitro. TGF-β в норме является важным регулятором клеточной пролиферации, дифференцировки, апоптоза, иммунного ответа, ремоделирования экстрацеллюлярного матрикса. T. Yamamoto и соавт. полагают [35], что TGF-β играет роль в прогрессировании гломерулосклероза и интерстициального фиброза. Иммуногистохимическим методом была отмечена выраженная экспрессия TGF-β в гломерулах и интерстиции при различных формах нефрита (IgA-нефропатии, фокально-сегментарном гломерулосклерозе, нефрите с полулуниями и диффузном пролиферативном волчаночном нефрите), сопровождающихся накоплением фибронектина, а также ингибитора активатора плазминогена-1 (PAI-1). Повышение количества мРНК TGF-β отмечено в клубочках, а также в перигломерулярных и тубулоинтерстициальной областях, местах макрофагальной инфильтрации и отложений эндоплазматического ретикулума. В интерстиции TGF-β экспрессировался макрофагами, а также клетками канальцев с перитубулярной мононуклеарной инфильтрацией и артерий с утолщенной интимой [35].