Оценка секреции инсулина и резистентности к инсулину у человека
So Young Park , 1 Жан-Франсуа Готье ,![]() 2, 3 и Сук Чон
2, 3 и Сук Чон![]() 1 , 4
1 , 4
Диабет Метаб Дж. 2021 Сентябрь; 45(5): 641–654.
PMCID: PMC8497920
PMID: 34610719
| Сайт: | Электронный информационно- образовательный портал ВолгГМУ |
| Курс: | Дисциплина Медицинская биохимия. Принципы измерительных технологий в биохимии. Патохимия, диагностика. Биохимия злокачественного роста». Часть 3 |
| Книга: | Оценка секреции инсулина и резистентности к инсулину у человека |
| Напечатано:: | Гость |
| Дата: | Пятница, 17 Май 2024, 18:04 |
Оглавление
- 1. Резюме
- 2. Введение
- 3. СЕКРЕЦИЯ ИНСУЛИНА И ДЕЙСТВИЕ ИНСУЛИНА
- 4. МЕТОДЫ ОЦЕНКИ ФУНКЦИИ β-КЛЕТОК ПОДЖЕЛУДОЧНОЙ ЖЕЛЕЗЫ/РЕЗИСТЕНТНОСТИ К ИНСУЛИНУ
- 5. Внутривенный тест на толерантность к глюкозе
- 6. Гиперинсулинемический эугликемический клэмп-тест
- 7. Минимальные модели C-пептида с постепенной инфузией глюкозы
- 8. Пероральный тест на толерантность к глюкозе
- 9. Тест на переносимость смешанной пищи
- 10. Инсулиносупрессивный тест
- 11. Тест стимуляции глюкагоном
- 12. ПОКАЗАТЕЛИ ФУНКЦИИ β-КЛЕТОК ПОДЖЕЛУДОЧНОЙ ЖЕЛЕЗЫ
- 13. ПОКАЗАТЕЛИ НЕЧУВСТВИТЕЛЬНОСТИ/РЕЗИСТЕНТНОСТИ К ИНСУЛИНУ
- 14. ВЫВОДЫ
- 15. ИСПОЛЬЗОВАННАЯ ЛИТЕРАТУРА
1. Резюме
Нарушение секреции инсулина и повышенная инсулинорезистентность (или снижение чувствительности к инсулину) играют основную роль в патогенезе всех форм сахарного диабета (СД). Очень важно оценить функцию β-клеток поджелудочной железы и резистентность/чувствительность к инсулину для определения типа СД и планирования оптимальной стратегии лечения и профилактики СД. К настоящему времени разработаны различные методы и индексы для оценки функции β-клеток и резистентности/чувствительности к инсулину на основе статических, динамических тестов и расчета их результатов. На самом деле, поскольку метаболизм глюкозы и инсулина осуществляется посредством сложного процесса, связанного с различными раздражителями в нескольких тканях, трудно полностью отразить реальную физиологию. Для решения теоретических и практических трудностей исследования нового индекса все еще продолжаются. Также, важно выбрать соответствующий метод и индекс в соответствии с целью использования и клинической ситуацией. В этом обзоре обобщены различные традиционные методы и показатели для оценки функции β-клеток поджелудочной железы и резистентности/чувствительности к инсулину, а также представлены новые показатели.
Ключевые слова: сахарный диабет, инсулинорезистентность, секреция инсулина.
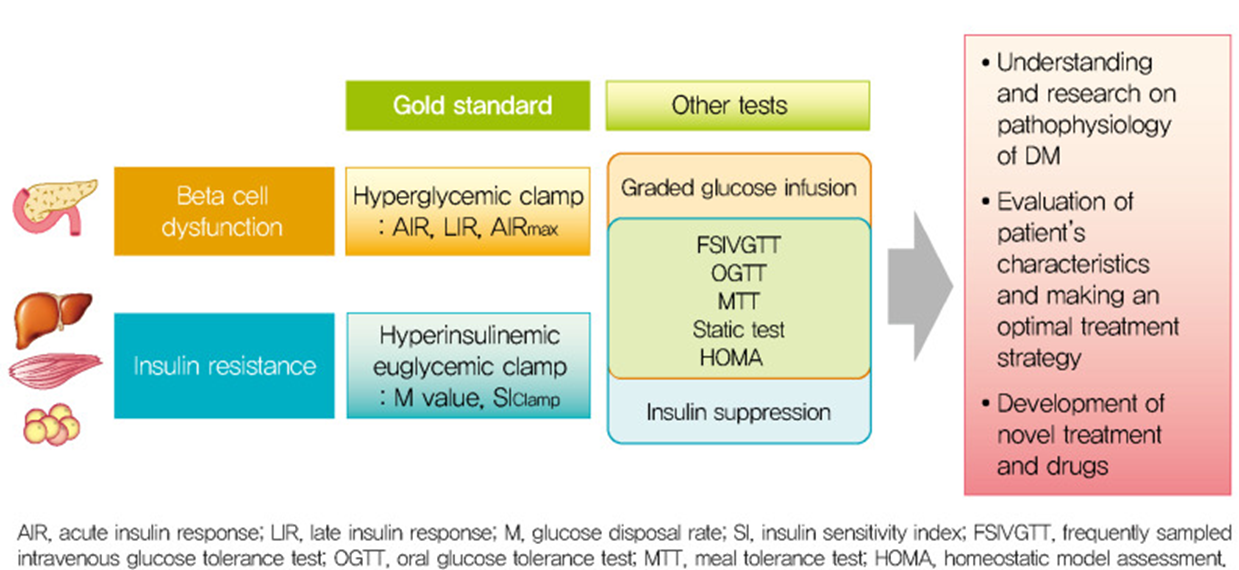
2. Введение
Распространенность сахарного диабета (СД) растет среди людей всех возрастов во всем мире, становясь серьезным бременем для общественного здравоохранения [ 1 ]. Инсулин, пептидный гормон, состоящий из 51 аминокислоты, является наиболее важным гормоном для энергетического метаболизма, такого как глюкоза, жир и белок, а также для поддержания гомеостаза. Нарушение секреции и действия инсулина вносят основной вклад в патогенез СД [ 2 ]. В частности, нарушение функции β-клеток поджелудочной железы является предпосылкой для развития гипергликемии и СД, а прогрессирующая потеря функции β-клеток связана с ухудшением гипергликемии [ 3 , 4 ]. Инсулинорезистентность, первоначально предложенная для описания пациентов с диабетом, нуждающихся в высоких дозах инсулина [ 5] .], в настоящее время определяется как сниженная реактивность (максимальный эффект инсулина) или чувствительность (концентрация инсулина, необходимая для полумаксимального ответа) на метаболические действия инсулина, такие как инсулин-опосредованное удаление глюкозы из мышечной и жировой ткани и ингибирование глюконеогенеза в печень [ 6 ]. Резистентность к инсулину также связана с метаболическим синдромом, который включает дислипидемию, гипертонию и ожирение, что приводит к повышенному риску сердечно-сосудистых заболеваний [ 7] .]. Оценка функции β-клеток поджелудочной железы и инсулинорезистентности очень важна для определения типа СД и планирования оптимальной тактики лечения и профилактики в клинической практике. Это также имеет значение в таких областях исследований, как разработка новых противодиабетических препаратов, многие виды экспериментальных и клинических исследований СД и метаболических заболеваний. Разработаны различные методы и индексы для оценки функции β-клеток и резистентности/чувствительности к инсулину на основе статических, динамических тестов и расчета их результатов. Тем не менее, они остаются сложными из-за сложности ответа β-клеток на различные стимулы, механизма обратной связи, передачи сигналов инсулина и метаболизма в органах [ 8] .]. Для решения теоретических и практических трудностей исследования нового индекса все еще продолжаются. Также важно понимать теоретические предпосылки, преимущества и ограничения каждого метода, чтобы выбрать соответствующий метод и индекс для целей использования и клинической ситуации.
В этом обзоре мы обобщили различные применяемые в настоящее время методы и показатели для оценки функции β-клеток поджелудочной железы и резистентности/чувствительности к инсулину, а также представили новые показатели.
3. СЕКРЕЦИЯ ИНСУЛИНА И ДЕЙСТВИЕ ИНСУЛИНА
Инсулин секретируется β-клетками поджелудочной железы в ответ на уровень глюкозы и питательных веществ в плазме (аминокислота, свободная жирная кислота), а дополнительный сигнал, такой как метаболический фактор, нейротрансмиттер и гормон, модулирует секрецию инсулина [9 ] . Глюкоза является основным фактором, контролирующим функцию и выживание β-клеток. Глюкоза, поступающая в β-клетку через переносчики глюкозы, быстро фосфорилируется до глюкозо-6-фосфата глюкокиназой и подвергается окислению в митохондриях, что приводит к образованию аденозинтрифосфата (АТФ). Повышение соотношения АТФ/аденозиндифосфат в β-клетке приводит к последующему закрытию КАТФ-канала, что вызывает деполяризацию клеточной мембраны и делает возможным проникновение Ca 2+ через открытие потенциал-зависимых кальциевых каналов L-типа. Повышенный уровень внутриклеточного Ca2+ вызывают экзоцитоз секреторных гранул, содержащих инсулин/проинсулин, из β-клеток поджелудочной железы. Фармакологический период полураспада инсулина оценивается в пределах от 5 до 8 минут и в основном выводится инсулиназной активностью в печени, почках и некоторых других тканях [10 ] .
Глюкоза индуцирует секрецию инсулина (GSIS) двухфазным образом; за быстрым ранним пиком (1-я фаза) следует второй, более медленный и постепенно нарастающий пик (2-я фаза) [ 11 ]. Секреция инсулина первой фазы быстро стимулируется повышенным цитозольным Ca 2+ и в значительной степени обусловлена экзоцитозом подготовленных (легко высвобождаемых) гранул инсулина. Вторая фаза секреции инсулина медленная, активируется продукцией цитозольного Ca 2+ , АТФ и циклического аденозинмонофосфата, а также за счет последующего поступления новых гранул инсулина для высвобождения. GSIS можно модулировать аминокислотами, свободными жирными кислотами и непищевыми стимуляторами секреции, такими как инкретиновые гормоны, факторы роста и нейротрансмиттеры.
Инсулин связывается с рецептором клетки-мишени, связанным с плазматической мембраной, и координирует интегративное анаболическое действие доступности питательных веществ [ 12] .]. Инсулиновый рецептор (ИР), тирозинкиназа, состоит из α- и β-цепей и также активируется инсулиноподобными факторами роста I и II, а также инсулином. Существует две изоформы IR, А и В, но изоформа В является основной изоформой и более специфична для инсулина. Изоформа В экспрессируется в печени, мышцах и жировой ткани, поэтому считается, что она опосредует большинство метаболических эффектов инсулина. Связывание этих эндогенных лигандов с α-цепью IR вызывает структурные изменения в β-цепи, вызывая аутофосфорилирование остатков тирозина. Эти изменения важны для нижестоящих событий, таких как рекрутирование субстратов IR адаптерных белков. После активации IR можно функционально разделить на митогенные и метаболические сигналы.
Роль инсулина в гомеостазе глюкозы представлена прямым действием инсулина на скелетные мышцы, печень и белые адипоциты [ 12] .]. Эти ткани нуждаются в тканеспецифических сигнальных путях инсулина. В скелетных мышцах, представительной ткани, действующей на инсулин, инсулин способствует утилизации и хранению глюкозы за счет увеличения транспорта глюкозы и чистого синтеза гликогена. В печени инсулин активирует синтез гликогена, увеличивает экспрессию адипогенных генов и ингибирует глюконеогенез за счет снижения экспрессии глюконеогенных генов. В ткани белых адипоцитов инсулин ингибирует липолиз и увеличивает транспорт глюкозы и адипогенез. Хотя эффекты инсулина различаются от ткани к ткани, проксимальные компоненты, участвующие в передаче сигналов инсулина, очень похожи во всех инсулиночувствительных клетках. Более того, инсулин подавляет секрецию глюкагона α-клетками поджелудочной железы, что само по себе является мощным индуктором гипергликемии [ 13 ].
Известно, что секреция инсулина 1-й фазы GSIS играет ключевую роль в переходе от голодания к питанию посредством следующих функций: ингибирование продукции глюкозы в печени (HGP); ингибирование липолиза; подготовка клеток-мишеней к действию инсулина через эндотелиальный барьер [ 14 ]. Секреция инсулина 2-й фазы GSIS снижает HGP, как и в 1-й фазе, но в меньшей степени [ 15 ]. Что еще более важно, он увеличивает утилизацию глюкозы в периферических тканях [ 16 ]. Следовательно, хотя значение секреции инсулина 2-й фазы относительно недооценено по сравнению с 1-й фазой, она важна для поддержания гомеостаза глюкозы.
4. МЕТОДЫ ОЦЕНКИ ФУНКЦИИ β-КЛЕТОК ПОДЖЕЛУДОЧНОЙ ЖЕЛЕЗЫ/РЕЗИСТЕНТНОСТИ К ИНСУЛИНУ
Для полной оценки функции β-клеток поджелудочной железы следует измерять как массу β-клеток, так и секреторную функцию инсулина; однако массу β-клеток нельзя измерить непосредственно у человека. В общем, функцию β-клеток можно оценить путем измерения инсулина или С-пептида, секретируемого с инсулином из β-клеток, на эквимолярной основе. Около половины вновь секретируемых молекул инсулина экстрагируется печенью при первом прохождении, а степень печеночного клиренса инсулина зависит от болезненного состояния и инсулиновой нагрузки [17], в отличие от этого, С-пептид не подвергается существенному клиренсу печенью. [ 18 , 19 ]. In vivo оценка динамического высвобождения инсулина β-клетками из воротной вены печени [ 20].] редко применяется у людей, поэтому эту проблему можно решить, используя свойства инсулина и С-пептида, которые секретируются совместно, но имеют разные механизмы клиренса [21 ] .
Путем математического моделирования (с деконволюцией) последовательно измеренных во времени концентраций С-пептида и инсулина при различных условиях, которые стимулируют β-клетки, можно вывести скорость предпеченочной секреции инсулина (ISR) [22 ] .
Между прочим, базальная функция β-клеток измеряется инсулином или С-пептидом в статической ситуации, но 1-я фаза, 2-я фаза секреции инсулина, кривая доза-реакция между глюкозой и ISR и максимальная секреторная функция инсулина могут быть измерены в динамическом стимулирующем состоянии. Для этого динамического теста применялись однократная инъекция глюкозы (например, однократная болюсная инфузия, инфузия фиксированной дозы или пероральный прием глюкозы), поэтапная инфузия глюкозы (GGI) или методика гипергликемического клэмпа. Кроме того, неглюкозный стимулятор, такой как глюкагон или аргинин, используется для индукции максимальной инсулиновой реакции во время динамического теста.
Чтобы измерить действие инсулина на весь организм, необходимы особые условия для полного подавления эндогенной продукции глюкозы и измерения утилизации глюкозы каждой тканью при введении инсулина извне. Условия для достижения нового эугликемического равновесного состояния в гиперинсулинемическом состоянии путем инфузии различных концентраций инсулина для подавления HGP (что является основным) и непрерывной инфузии глюкозы для поддержания эугликемического статуса [23] .]. В настоящее время, поскольку скорость инфузии глюкозы (GIR) отражает скорость утилизации глюкозы в организме, можно напрямую измерить системное действие инсулина на утилизацию глюкозы. В этих условиях от 80% до 90% введенной глюкозы потребляется скелетными мышцами и менее 5% - жировой тканью и незначительно - другими тканями, поэтому измеренное действие инсулина в основном отражает чувствительность скелетных мышц к инсулину. Таким образом, чувствительность к инсулину может быть измерена непосредственно с помощью метода гиперинсулинемического эугликемического зажима (HEC) с использованием этих условий.
Поскольку исследования HEC невозможны в обычных клинических условиях и исследованиях, измерение чувствительности к инсулину с помощью теста на толерантность к глюкозе с частыми пробами (FSIVGTT) может использоваться для оценки как печеночной, так и периферической резистентности к инсулину и хорошо коррелирует с методом HEC [24 ] . Другие суррогатные маркеры чувствительности к инсулину рассчитываются по значениям глюкозы и инсулина натощак или после перорального теста на толерантность к глюкозе (ПГТТ) [ 25–27 ] . Оценка гомеостатической модели (HOMA) по инсулину и глюкозе в состоянии натощак хорошо коррелирует с исследованием HEC [ 27] .], но в первую очередь отражает чувствительность печени к инсулину, поскольку уровень глюкозы в плазме натощак определяется в основном скоростью ХГП, а инсулин является первичным регулятором ГГП. Следовательно, корреляция между HOMA и HEC менее надежна при анализе у субъектов с нарушенной толерантностью к глюкозе [ 28 ]. С другой стороны, индексы резистентности к инсулину из OGTT отражают как печеночную, так и периферическую инсулинорезистентность [ 26 ]. Поскольку значительное (от 30% до 40%) количество глюкозы поглощается внутренностным руслом во время OGTT, а также HGP менее полностью подавляется, чем во время исследования HEC [29] .], на концентрацию глюкозы в плазме во время ПГТТ влияет как печеночная, так и периферическая (в первую очередь мышечная) резистентность к инсулину. Эти показатели, полученные на основе ОГТТ, хорошо коррелируют (R; примерно 0,7) с чувствительностью к инсулину, измеренной в исследовании HEC [ 26 ].5. Внутривенный тест на толерантность к глюкозе
После ночного голодания внутривенно болюсно вводят глюкозу (0,3 г/кг массы тела) в течение 2 минут, начиная с момента времени 0. Через двадцать минут после инфузии глюкозы в течение 5 минут вводят определенное количество инсулина. В модифицированном FSIVGTT используется экзогенный инсулин (4 мкМЕ/кг/мин) [ 30–32 ] . Толбутамид использовали вместо инсулина в модифицированном FSIVGTT для стимуляции секреции эндогенного инсулина [ 32–35 ] .]. Образцы крови берутся для измерения уровня глюкозы и инсулина в плазме при -10, -1, 1, 2, 3, 4, 5, 6, 7, 8, 10, 12, 14, 16, 20, 22, 23, 24, 25. , 27, 30, 40, 50, 60, 70, 80, 90, 100, 120, 160 и 180 минут. Во время FSIVGTT наблюдаются две фазы высвобождения инсулина. FSIVGTT может отражать реакцию β-клеток на повышение уровня глюкозы в условиях, сходных с приемом пищи. При FSIVGTT глюкоза вводится внутривенно и непосредственно стимулирует β-клетки. Поскольку ему не нужно проходить через пищеварительную систему, он свободен от инкретинового эффекта и отличается временем опорожнения желудка по сравнению с ПГТТ. На FSIVGTT влияют клиренс инсулина и глюкозы.
Анализ минимальной модели был разработан Bergman et al. [ 36 ]. Данные, полученные из FSIVGTT, рассчитывают с использованием компьютерной программы MINMOD для получения индекса функции β-клеток, чувствительности к инсулину и эффективности глюкозы. С-пептид можно использовать вместо инсулина в анализе минимальной модели с помощью FSIVGTT.
Анализ минимальной модели определяется двумя парами дифференциальных уравнений, описывающих динамику глюкозы в монокомпартментном «пространстве глюкозы» и динамику инсулина в «удаленном компартменте». Минимальная модель однозначно определяет параметры модели, которые определяют наилучшее соответствие исчезновению глюкозы во время модифицированного FSIVGTT. Минимальный модельный анализ менее трудоемок, чем гипергликемический клэмп, не требует стационарных условий и обеспечивает постоянный контроль скорости внутривенной инфузии. Но минимальный модельный анализ чрезмерно упрощает нормальную физиологию метаболизма глюкозы, что приводит к плохой точности [ 37 , 38 ].
6. Гиперинсулинемический эугликемический клэмп-тест
Тест HEC, разработанный DeFronzo et al. [ 39 ], широко признан золотым стандартом для прямого определения резистентности/чувствительности к инсулину у людей [ 42 ]. Инсулин вводят внутривенно с постоянной скоростью (от 5 до 120 мкМЕ/м 2 )./мин) после ночного голодания. Новая равновесная концентрация инсулина поддерживается на более высоком уровне, чем в состоянии натощак. В это время HGP подавляется, а поглощение глюкозы мышечной и жировой тканью увеличивается. В этом состоянии уровень глюкозы в крови часто контролируют с интервалами от 5 до 10 минут с помощью анализатора глюкозы, в то время как 20% декстроза вводится внутривенно для поддержания уровня глюкозы в крови в нормальном диапазоне (эугликемический). Инфузия фосфата калия также проводится для предотвращения гипокалиемии, возникающей в результате гиперинсулинемии и увеличения утилизации глюкозы. После нескольких часов инфузии инсулина с постоянной скоростью достигается равновесное состояние, при котором инсулин плазмы, глюкоза крови и GIR остаются постоянными.6 , 43 ]. Предполагая, что гиперинсулинемия в достаточной степени ингибирует HGP, GIR согласуется со скоростью утилизации глюкозы (M), поскольку нет разницы между введенной и утилизированной глюкозой в этом равновесном состоянии (рисунок 1) [ 43 ]. M корректируется на массу тела, особенно безжировую массу. Таким образом, HEC может измерять утилизацию глюкозы всем телом (в основном в скелетных мышцах) непосредственно при заданном уровне гиперинсулинемии в стационарном состоянии. Когда радиоактивно меченные индикаторы глюкозы используются в условиях клэмп-теста, можно одновременно количественно определять HGP, а также утилизацию глюкозы в организме [ 44 , 45] .]. При повышении чувствительности к инсулину вводимое количество глюкозы увеличивается. При этом увеличивается и разница в уровне глюкозы крови между артериальной и венозной кровью. Следовательно, если GIR определяется на основе концентрации глюкозы, измеренной в венозной крови, чувствительность к инсулину может быть завышена. Чтобы решить эту проблему, рука, используемая для забора крови, может быть ретроградно канюлирована и согрета грелкой (открытие артериовенозных анастомозов) для «артериализации» венозной крови [46 ] . Радиоактивные индикаторы глицерина или аминокислот могут использоваться во время HEC для оценки чувствительности к инсулину в отношении липолиза или белкового метаболизма [ 47 , 48 ]. 31Р-магнитно-резонансная спектроскопия может быть использована в сочетании с HEC для оценки скорости стимулированного инсулином потока мышечной митохондриальной АТФ-синтазы и стимулированного инсулином увеличения концентрации внутримиоцеллюлярного неорганического фосфата [49 ] . Доплеровская и контрастная ультразвуковая визуализация также использовались в сочетании с HEC для изучения чувствительности к инсулину в отношении действия инсулина на сосуды [ 50].]. Однако исследование HEC занимает много времени, является трудоемким и дорогостоящим. Кроме того, он не подходит для крупномасштабных эпидемиологических исследований и рутинного ухода за пациентами, поскольку требует квалифицированного оператора. HEC может неточно отражать действие инсулина и динамику глюкозы в физиологических условиях, которые могут быть определены динамическим тестом, таким как пероральный прием пищи или пероральная нагрузка глюкозой.
Техника гиперинсулинемически-эугликемического клэмпа глюкозы.
7. Минимальные модели C-пептида с постепенной инфузией глюкозы
После ночного голодания в оба предплечья вводят катетеры для забора крови и инфузии глюкозы. Глюкозу вводят с постепенно увеличивающейся, а затем уменьшающейся скоростью (0, 4, 8, 16, 8, 4, 0 мг/кг/мин). Каждая инфузия глюкозы проводится в течение 40 минут. Уровни глюкозы и с-пептида измеряют с 10-минутными интервалами в течение 40-минутного исходного периода перед инфузией глюкозы и в течение 240-минутной инфузии глюкозы. Как базальные, так и динамические реакции секреции инсулина, а также чувствительность β-клеток можно рассчитать с использованием минимальных моделей С-пептида [ 51 ]. ISR можно оценить с помощью компьютерного программного обеспечения для анализа минимальной модели [ 52] .]. Поскольку он проще, чем анализ минимальной модели с помощью FSIVGTT, его можно широко применять в клинических исследованиях, но инкретиновый эффект не отражается.
8. Пероральный тест на толерантность к глюкозе
ПГТТ — наиболее широко используемый в клинической практике тест для диагностики непереносимости глюкозы и СД [ 53 ]. После ночного голодания образцы крови для определения концентрации глюкозы и инсулина берут через 0, 30, 60, 90 и 120 минут после стандартной пероральной нагрузки глюкозой (75 г). Функция β-клеток, оцениваемая по ПГТТ, представляет более физиологический характер изменений уровня глюкозы, инсулина и инкретиновых гормонов, чем гипергликемический клэмп или FSIVGTT [ 21 , 54 ]. ПГТТ легко провести, но не может четко отразить и различить 1-ю и 2-ю фазы секреции инсулина из-за вариабельности концентрации глюкозы.
9. Тест на переносимость смешанной пищи
Были разработаны смешанные тесты с едой, чтобы отразить реакции инсулина и глюкозы на различные питательные вещества вместе с глюкозой. Существует много видов смешанного питания с различным составом распределения питательных веществ (например, 10 ккал/кг, 45% углеводов, 15% белков и 40% жиров). Образцы крови собирали для определения концентрации глюкозы, инсулина и С-пептида натощак и через 15, 30, 60, 90, 120, 180 и 240 минут после приема смешанной пищи [53 , 55 ] . Как и OGTT, тест на толерантность к смешанной пище (MTT) более точно имитирует динамику глюкозы и инсулина в физиологических условиях, чем условия гипергликемического клэмпа, теста на супрессию инсулина (IST) или FSIVGTT. Но из-за различий в абсорбции глюкозы и абсорбции глюкозы во внутренних органах смешанный МТТ имеет плохую воспроизводимость.
10. Инсулиносупрессивный тест
IST используется для непосредственного измерения резистентности к инсулину. Он был разработан Shen et al. [ 56 ] и модифицированный Harano et al. [ 57 ]. После ночного голодания внутривенно вводят соматостатин (250 мкг/ч) или аналог соматостатина октреотид (25 мкг болюсно, затем 0,5 мкг/мин) для подавления эндогенной секреции инсулина и глюкагона. Предполагается, что инфузии соматостатина достаточно для полного подавления секреции эндогенного инсулина и глюкагона. Постоянная доза инсулина (25 мкМЕ/м 2 ∙мин) и глюкозы (240 мг/м 2∙мин) затем вводят в ту же локтевую вену в течение 3 часов. Из контралатеральной руки образцы крови на глюкозу и инсулин берут каждые 30 минут в течение 2,5 часов, а затем с 10-минутными интервалами от 150 до 180 минут ИСТ. Стабильные состояния легче достичь с помощью IST, чем с HEC, из-за отсутствия переменных инфузий. У лиц с выраженной чувствительностью к инсулину во время ИСТ может возникнуть гипогликемия, а у лиц с СД 2 типа — глюкозурия вследствие гипергликемии, что затрудняет точное измерение резистентности к инсулину. Инфузия соматостатина может независимо влиять на периферический клиренс глюкозы [ 58 ]. Поэтому ИСТ имеет ограниченное применение в крупномасштабных эпидемиологических исследованиях или клинических испытаниях.
11. Тест стимуляции глюкагоном
Тест стимуляции глюкагоном (GST) был описан в 1977 г. [ 59 ]. Собирают исходный С-пептид сыворотки и образец глюкозы плазмы. 1 мг глюкагона вводят в течение 10 секунд. Образцы собирают через 2, 4 и 6 минут после введения глюкагона. GST является более чувствительным и воспроизводимым тестом по сравнению с провокационным тестом с использованием других субстратов, таких как глюкоза или толбутамид. И это связано с типом диабета и будущим использованием инсулина. Большинство пациентов испытывали тошноту при GST.
12. ПОКАЗАТЕЛИ ФУНКЦИИ β-КЛЕТОК ПОДЖЕЛУДОЧНОЙ ЖЕЛЕЗЫ
Первая и вторая фазы секреции
инсулина
Во время FSIVGTT секреция инсулина 1-й фазы или AIR представлена как высвобождение инсулина в течение первых 10 минут после инъекции глюкозы [ 60 ] и рассчитывается с использованием площади под кривой (AUC) концентрации инсулина в течение первых 10 минут или среднего значения. Значения инсулина через 3, 4 и 5 минут после инъекции глюкозы минус базальное значение. Пик секреции инсулина приходится на период от 3 до 10 минут, в это время уровень 40 мкМЕ/мл или менее соответствует низкому ответу, а уровень более 140 мкМЕ/мл — высокому ответу. Секреция инсулина 2-й фазы рассчитывается как площадь инсулина над уровнем до стимула в течение 10-60 минут после болюса глюкозы [ 61 ].
В минимальном модельном анализе с FSIVGTT реактивность β-клеток первой фазы (Φ 1 ) рассчитывается как количество инсулина, высвобождаемого во время первого пика, пропорционально изменению уровня глюкозы. реактивность β-клеток во второй фазе (Φ 2 ) рассчитывают как количество инсулина, высвобождаемого во время второй фазы.
Во время гипергликемического клэмпа AIR представляет собой AUC концентрации инсулина в течение первых 10 минут. А поздний ответ на инсулин — это AUC концентрации инсулина между 10 и 120 минутами. Острый инсулиновый ответ на аргинин (AIRarg) рассчитывали как среднее значений через 2, 3, 4 и 5 минут минус среднее исходных значений [ 41 ]. AIRarg во время клэмп-теста 230 мг/дл глюкозы позволяет определить усиление глюкозой аргинин-индуцированного высвобождения инсулина (AIRpot). AIRarg во время клэмпа с глюкозой 340 мг/дл позволяет определить максимальное усиление аргинин-индуцированного высвобождения инсулина (AIRmax), поскольку острые реакции на аргинин максимальны при концентрации глюкозы в плазме 315 мг/дл.
С-пептид
Поскольку период полувыведения С-пептида больше (от 20 до 30 минут), чем у инсулина (от 3 до 5 минут), печеночный клиренс С-пептида незначителен, а скорость клиренса в периферическом кровообращении постоянна по сравнению с инсулином. [ 62 ]. У здоровых людей концентрация С-пептида в плазме натощак составляет от 0,3 до 0,6 нмоль/л с постпрандиальным повышением до 1-3 нмоль/л [63] .]. Можно определить точечный или 24-часовой анализ С-пептида в моче, соотношение С-пептида в моче и креатинина. С-пептид представляет эндогенную выработку инсулина, и измерение С-пептида не имеет ловушки перекрестной реакции анализа между экзогенным и эндогенным инсулином у пациентов с диабетом, получающих инсулин. С-пептид также коррелирует с типом заболевания, длительностью диабета, а также возрастом постановки диагноза. Поскольку большая часть С-пептида метаболизируется почками, а затем выводится с мочой [ 64 ], измерение С-пептида у пациентов с хроническим заболеванием почек является неточным. На метаболизм С-пептида влияют возраст, пол, ожирение, форма тела и степень толерантности к глюкозе [ 65 ]. Обнаружение малозаметных уровней С-пептида ограничено.
Кроме того, отношение С-пептида к глюкозе натощак или после приема пищи (CPRI) было предложено в качестве практического маркера функции β-клеток при диабете, особенно постпрандиального CPRI при СД 2 типа [66 ] . Концентрации С-пептида заметно различались и были выше при повышении и понижении GGI по сравнению с FSIVGTT, что представляет собой эффект нарушения уровня глюкозы или статина и динамического контроля уровня глюкозы. β-клетки более чувствительны к медленному увеличению уровня глюкозы, но β-клетки реагируют на снижение уровня глюкозы.
Инсулиногенный индекс
Инсулиногенный индекс (IGI) используется для количественной оценки реакции β-клеток в соответствии с изменением уровня глюкозы в плазме. ИГИ рассчитывают по изменению инсулина/изменению глюкозы в течение первых 30 минут после нагрузки на ПГТТ.
IGI = [Δинсулин (30–0 минут) (мкМЕ/мл)/Δглюкоза (30–0 минут) (мг/дл)]
IGI также рассчитывается на основе смешанного МТТ. Параметры функции β-клеток были выше во время смешанного МТТ, чем во время OGTT, это предполагает, что на параметры функции β-клеток влияет состав пищи [ 67 ].
Гомеостатическая модель оценки функции β-клеток
НОМА была разработана в 1985 году как модель корреляции между динамикой уровня глюкозы и инсулина [ 27 ]. Как исходный HOMA, так и обновленный HOMA2 предполагают петлю обратной связи между печенью и β-клеткой. Например, концентрация глюкозы регулируется HGP через инсулин, а концентрация инсулина регулируется реакцией β-клеток поджелудочной железы на концентрацию глюкозы. Его можно использовать в качестве индекса, отражающего резистентность к инсулину и функцию β-клеток. Гомеостатическая модель оценки функции β-клеток (HOMA-β) представляет собой простую статическую оценку функции β-клеток с использованием базовых значений глюкозы и инсулина [ 27 ].
HOMA-β = [инсулин плазмы натощак (мкМЕ/мл) × 360/(глюкоза плазмы натощак (мг/дл)–63]
Поскольку НОМА-β проста и удобна, она широко используется в эпидемиологических исследованиях. HOMA-β имеет ограничение, поскольку уровень глюкозы и инсулина натощак в один момент времени не может представлять сложную взаимосвязь между переменными в системе обратной связи глюкоза-инсулин. А для достоверного значения HOMA-β требуется точный анализ инсулина [ 42 ].
Индекс диспозиции
Индекс диспозиции (DI) выражается путем расчета произведения секреторной способности инсулина и чувствительности к инсулину. В качестве альтернативы он рассчитывается путем деления секреторной способности инсулина на значение резистентности к инсулину [ 68] .]. DI представляет собой понятие способности секреции инсулина с учетом резистентности к инсулину. У здоровых людей произведение чувствительности к инсулину и секреции инсулина постоянно. Секреция инсулина увеличивается в ответ на увеличение резистентности к инсулину, но когда происходит недостаточность β-клеток, способность компенсировать резистентность к инсулину снижается, что приводит к снижению DI. Таким образом, DI не просто указывает на секрецию инсулина, но считается более полезным и практичным индикатором функции β-клеток, поскольку указывает на секреторную способность инсулина, отражающую состояние инсулинорезистентности каждого субъекта.
Показатели для измерения функции β-клеток, описанные до сих пор, суммированы вТаблица 1. В соответствии с методом измерения он подразделяется на динамический тест и статический тест, а расчетные формулы для различных индексов секреции инсулина, рассчитанные на основе значений инсулина, С-пептида и глюкозы, измеренных в каждом тесте, суммированы. Чтобы оценить острую и позднюю секреторную функцию инсулина и максимальную секреторную способность инсулина, необходимо измерение на основе динамических тестов. Соответствующий метод следует выбирать и использовать в соответствии с сильными и слабыми сторонами индексов, средой, в которой они могут использоваться, и целью.
Таблица 1.
Показатели секреторной функции инсулина β-клеток поджелудочной железы
|
Метод |
Измерение функции β-клеток |
|||
|
На основе динамических тестов |
||||
|
|
ФСИВГТТ |
Высвобождение инсулина первой фазы или AIR: AUC концентрации инсулина в течение первых 10 минут инъекции глюкозы или среднее значение значений инсулина через 3, 4 и 5 минут после инъекции глюкозы. |
||
|
Высвобождение инсулина второй фазы: площадь инсулина выше престимульного уровня в течение 10–60 мин после импульса глюкозы. |
||||
|
DI: AIR с поправкой на чувствительность к инсулину (значение M) |
||||
|
Гипергликемический зажим |
AIR: AUC концентрации инсулина в течение первых 10 мин. |
|||
|
Поздний ответ на инсулин: AUC концентрации инсулина между 10–120 мин. |
||||
|
AIR max : AIR со стимуляцией аргинином. |
||||
|
Анализ минимальной модели с помощью FSIVGTT |
Вычислительная модель |
|||
|
|
Φ 1 : реакция β-клеток первой фазы, которая рассчитывается как количество инсулина, высвобождаемого во время первого пика, пропорционально изменению уровня глюкозы. |
|||
|
Φ 2 : чувствительность β-клеток второй фазы, которая рассчитывается как количество инсулина, высвобождаемого во время второй фазы. |
||||
|
Минимальные модели C-пептида с постепенной инфузией глюкозы |
Вычислительная модель |
|||
|
SR( t )=SRS ( t ) + SRd ( t ) |
||||
|
ОГТТ или МТТ |
Рассчитывается на основе OGTT или смешанного MTT |
|||
|
IGI = [Δинсулин (30–0 мин) (мкМЕ/мл)/Δглюкоза (30–0 мин) (мг/дл)] |
||||
|
Рассчитывается на основе OGTT или смешанного MTT |
||||
|
Пероральный DI: IGI/HOMA-IR или [AUC инсулина /AUC глюкозы ]×индекс Мацуда |
||||
|
Статические тестовые индексы |
||||
|
Простые суррогатные маркеры |
||||
|
|
метод НОМА |
HOMA-β = [инсулин плазмы натощак (мкМЕ/мл) × 360/(глюкоза плазмы натощак (мг/дл)–63] |
||
|
C-пептид натощак |
Измерение С-пептида натощак |
|||
|
Отношение С-пептида к глюкозе (CPRI) |
С-пептид (нг/мл)/глюкоза (мг/дл) (×100) |
|||
FSIVGTT, внутривенный тест на толерантность к глюкозе с частой выборкой; AIR, острый инсулиновый ответ; AUC, площадь под кривой; DI, индекс расположения; SR S , скорость секреции по концентрации глюкозы (статический контроль глюкозы); SR d , скорость секреции по скорости изменения концентрации глюкозы (динамический контроль глюкозы); ПГТТ, пероральный тест на толерантность к глюкозе; МТТ, тест на толерантность к еде; ИГИ, инсулиногенный индекс; HOMA-IR, гомеостатическая модель оценки резистентности к инсулину; HOMA-β, гомеостатическая модель оценки функции β-клеток.
13. ПОКАЗАТЕЛИ НЕЧУВСТВИТЕЛЬНОСТИ/РЕЗИСТЕНТНОСТИ К ИНСУЛИНУ
Индекс чувствительности к
инсулину
Индекс чувствительности к инсулину (S I ) рассчитывается из HEC.
Зажим SI =M/(G×ΔI) [ 25 ]
M: скорость утилизации глюкозы,
G: устойчивая концентрация глюкозы в крови,
ΔI: разница между концентрациями инсулина в плазме натощак и в стационарном состоянии (SSPI)
Для точного измерения M и SI Clamp в тесте HEC важно, чтобы выполнялось предположение о том, что HGP полностью подавляется стационарной гиперинсулинемией [ 25 , 45 , 69 , 70 ].
Стабильные концентрации глюкозы в плазме
Во время ИСТ период от 150 до 180 минут считается стационарным периодом, и в это время постоянные инфузии инсулина и глюкозы будут определять SSPI и стационарные концентрации глюкозы в плазме (SSPG). Концентрации SSPI, как правило, одинаковы у субъектов, в то время как концентрации SSPG обратно пропорциональны чувствительности к инсулину. Таким образом, концентрация SSPG будет выше у субъектов с резистентностью к инсулину и ниже у субъектов с чувствительностью к инсулину, что можно использовать в качестве индикатора резистентности/чувствительности к инсулину. SSPG представляет собой прямое измерение метаболического действия инсулина с высокой воспроизводимостью, менее трудоемкое и менее технически сложное, чем HEC.
Чувствительность к инсулину (S I ) и эффективность глюкозы (S G )
Чувствительность к инсулину (SI ) и эффективность глюкозы (SG ) рассчитывают на основе анализа минимальной модели. S I определяется как фракционное исчезновение глюкозы на единицу концентрации инсулина. SG определяется как способность глюкозы per se способствовать ее собственной утилизации и ингибировать HGP в отсутствие дополнительного эффекта инсулина [ 68 , 71 , 72 ].
1/Инсулин натощак
1. Инсулин натощак хорошо известен как суррогатный показатель резистентности к инсулину, который снижается по мере увеличения резистентности к инсулину [ 73 ]. Однако, поскольку концентрации инсулина обычно не распределяются, линейная корреляция между 1/(инсулин натощак) и инсулинорезистентностью по методу HEC не является строгой. А секреция инсулина снижается в условиях гипергликемии у больных диабетом или у субъектов с непереносимостью глюкозы, что может привести к ошибочным результатам. Таким образом, 1/(инсулин натощак) имел ограниченное применение у пациентов с непереносимостью глюкозы или диабетом. Отсутствуют стандартизированные анализы инсулина.
Соотношение глюкоза/инсулин
Соотношение глюкоза/инсулин натощак (соотношение G/I) использовалось в качестве показателя резистентности/чувствительности к инсулину в предыдущих исследованиях [ 74-76 ] . Однако отношение G/I не отражает должным образом физиологию, лежащую в основе детерминант чувствительности к инсулину [ 77].]. У здоровых субъектов отношение G/I натощак функционально эквивалентно 1/(глюкоза натощак) из-за уровня глюкозы натощак в нормальном диапазоне. Но в условиях относительной гиперинсулинемии натощак у больных с нарушением толерантности к глюкозе или сахарным диабетом соотношение G/I натощак ошибочно увеличивается по сравнению с 1/(глюкоза натощак). У больных сахарным диабетом концентрация инсулина натощак низкая и недостаточное поддержание уровня глюкозы в крови в пределах нормы; таким образом, существуют ограничения в применении этих суррогатных индексов, полученных для пациентов с диабетом.
Гомеостатическая модель оценки резистентности к инсулину
HOMA-IR = [инсулин натощак (мкМЕ/мл)] × [глюкоза натощак (ммоль/л)]/22,5
Модель гомеостаза резистентности к инсулину (HOMA-IR) проста, минимально инвазивна, но резистентность к инсулину у пациентов, получающих инсулин, нуждается в дальнейшей проверке. Знаменатель 22,5 является нормирующим коэффициентом. HOMA-IR имеет разумную линейную корреляцию с HEC и минимальные модельные оценки резистентности к инсулину в нескольких исследованиях различных групп населения [ 78 , 79 ]. Log (HOMA-IR) представляет собой гораздо более сильную линейную корреляцию с оценками инсулинорезистентности HEC. HOMA-IR или log (HOMA-IR) могут не давать соответствующих результатов у субъектов с серьезно нарушенной или отсутствующей функцией β-клеток.
Количественный контрольный индекс чувствительности к инсулину
Количественный контрольный индекс чувствительности к инсулину (QUICKI) представляет собой эмпирически полученное математическое преобразование концентрации глюкозы в крови натощак и концентрации инсулина в плазме, которое обеспечивает надежный, воспроизводимый и точный индекс чувствительности к инсулину с превосходной положительной прогностической силой [25 , 70 , 80 , 81 ] . . Это просто разновидность уравнения HOMA, поскольку оно преобразует данные, беря как логарифм, так и обратную величину произведения глюкоза-инсулин. Поскольку уровни инсулина натощак не имеют нормального распределения, логарифмическое преобразование улучшает его линейную корреляцию с SI Clamp .. Чтобы решить проблему, связанную с трудностью поддержания эугликемии у больных диабетом с гипергликемией натощак и нарушенной функцией β-клеток, добавление log (глюкоза натощак) к log (инсулин натощак) обеспечивает разумную коррекцию.
QUICKI= 1/[log (инсулин натощак, мкМЕ/мл) + log (глюкоза натощак, мг/дл)]
QUICKI имеет значительно лучшую линейную корреляцию с зажимом SI , чем SI, полученный из минимальной модели или HOMA-IR, особенно у пациентов с ожирением и диабетом [ 25 , 70 , 81 ]. Кроме того, QUICKI имеет самую сильную положительную прогностическую силу для определения развития диабета [ 82 ] и наиболее коррелирует с изменениями SI Clamp после терапевтических вмешательств [ 70 ]. QUICKI — это простой, недорогой и неинвазивный суррогатный индекс. По сравнению с другими суррогатными индексами резистентности к инсулину QUICKI является наиболее тщательно оцененным и подтвержденным.
Индекс Маколи
Индекс McAuley [ 83 ] используется для прогнозирования резистентности к инсулину у лиц с нормогликемией. Статистически метод регрессионного анализа использовался для оценки пороговых значений и важности различных параметров для резистентности к инсулину, таких как инсулин натощак, триглицериды, аспартатаминотрансфераза, скорость основного обмена (индекс массы тела [ИМТ]) и окружность талии.
Индекс Маколи = exp [2,63–0,28 лн (инсулин в мкМЕ/л)–0,31 лн (триглицериды в ммоль/л)]
Индекс Мацуда
Составной SI инсулина всего тела, включающий чувствительность к инсулину как в печени, так и в периферических тканях, разработанный Matsuda и DeFronzo на основе данных OGTT [ 26 ].
ISI (Мацуда) = 10 000 / √ [(G 0 × I 0 ) × (G среднее × I среднее )]
G 0 : Концентрация глюкозы в плазме натощак (мг/дл), полученная с момента 0 OGTT.
I 0 : Концентрация инсулина в плазме натощак (мкМЕ/л), полученная с момента 0 OGTT.
G означает : средняя концентрация глюкозы в плазме во время ПГТТ (мг/дл).
Я имею в виду : Средняя концентрация инсулина в плазме во время ПГТТ (мкМЕ/л)
Квадратный корень используется для поправки на нелинейное распределение инсулина, а 10 000 является масштабным коэффициентом в уравнении.
Индекс Стамволла
Stumvoll и Gerich предложили использовать демографические данные, такие как возраст, пол и ИМТ, в дополнение к реакции глюкозы в плазме (ммоль/л) и инсулина (пмоль/л) во время ПГТТ для прогнозирования чувствительности к инсулину и функции β-клеток [84 ] .
ISI Штумволла =0,156–0,0000459×I 120 (пмоль/л) –0,000321×I 0 (пмоль/л) –0,00541×G 120 (ммоль/л)
I 0 , концентрация инсулина в плазме натощак
I 120 , концентрация инсулина в плазме через 120 минут
G 120 , концентрация глюкозы в плазме через 120 минут.
Авиньонский индекс
Авиньон и др. [ 85 ] разработали три индекса чувствительности к инсулину: SiM, Sib и Si2h путем вычисления данных уровня глюкозы и инсулина натощак и через 2 часа во время ПГТТ. Он полезен для совмещения определения толерантности к глюкозе и оценки чувствительности к инсулину в одном простом тесте.
Sib=10 8 /(I 0 (мкМЕ/л) × G 0 (ммоль/л) × ВД)
Si2h=10 8 /(I 120 (мкМЕ/л) × G 120 (ммоль/л) × ВД)
SiM=[(0,137×Sиб)+Si2h]/2
I 0 , концентрация инсулина в плазме натощак
I 120 , концентрация инсулина в плазме через 120 минут
G 0 , концентрация глюкозы в плазме натощак
G 120 , концентрация глюкозы в плазме через 120 минут.
VD, объем распределения глюкозы (150 мл/кг массы тела)
Индекс Гутта, ISI (0,120)
ISI (0,120) рассчитывали с использованием концентрации глюкозы в плазме и концентрации инсулина натощак (0 минут) и 120-минутных образцов из OGTT [ 86 ]. Индекс хорошо коррелирует с прямыми оценками чувствительности к инсулину, полученными в исследовании HEC.
ISI(0, 120)=75 000+(G 0 –G 120 ) (ммоль/л) × 0,19 × масса тела (кг) / 120 × Gсреднее (0, 120) (ммоль/л) × Log (I означает( 0, 120) ) (мкМЕ/л)
G 0 , концентрация глюкозы в плазме натощак во время ПГТТ
G 120 , концентрация глюкозы в плазме через 120 минут во время ПГТТ
G mean , средняя концентрация глюкозы в плазме во время ПГТТ
Я имею в виду среднюю концентрацию инсулина во время ПГТТ.
Индекс Бельфиоре
Индекс Бельфиоре рассчитывали по нормальным значениям базальной концентрации глюкозы и инсулина, а также по среднему нормальному значению площади глюкозы и инсулина во время ПГТТ [ 87 ].
Индекс Бельфиоре = 2 (G S / GN ) × (IS / I N )+1
С, предметы
N, нормальные эталонные значения
G S , G N : концентрации глюкозы в плазме, выраженные как значения натощак или как площади, полученные во время стандартного ПГТТ через 0 и 2 часа.
I S , I N : концентрации инсулина в плазме, выраженные в виде значений натощак или в виде площади, полученной во время стандартного ПГТТ через 0 и 2 часа.
Показатели для измерения чувствительности/резистентности к инсулину, описанные до сих пор, суммированы вТаблица 2. Прямые измерения чувствительности к инсулину, основанные на HEC или IST, в основном отражают чувствительность скелетных мышц к инсулину. С другой стороны, косвенные показатели чувствительности к инсулину, основанные на FSIVGTT или суррогатных показателях, основанных на OGTT или MTT, отражают печеночную и периферическую резистентность к инсулину. Индексы резистентности к инсулину, основанные на статических тестах, в первую очередь отражают чувствительность печени к инсулину.
Таблица 2.
Показатели инсулинорезистентности
|
Метод |
Измерение резистентности к инсулину |
||
|
На основе динамических тестов |
|||
|
|
Прямая оценка инсулинорезистентности |
||
|
|
Гиперинсулинемический эугликемический клэмп |
Зажим SI =M/(G×ΔI) |
|
|
Инсулиносупрессивный тест |
SSPG (стабильное состояние глюкозы в плазме) |
||
|
Косвенное измерение резистентности к инсулину |
|||
|
Анализ минимальной модели FSIVGTT |
Вычислительная модель |
||
|
SI: фракционное исчезновение глюкозы на единицу концентрации инсулина |
|||
|
SG: способность глюкозы сама по себе способствовать ее утилизации и ингибировать HGP в отсутствие добавочного эффекта инсулина. |
|||
|
Индексы на основе OGTT или MTT |
|||
|
Индекс Мацуда |
ISI (Мацуда) = 10 000 / √ [(G 0 × I 0 ) × (G среднее × I среднее )] |
||
|
Индекс Стамволла |
ISI Штумволла =0,156–0,0000459×I 120 (пмоль/л) –0,000321×I 0 (пмоль/л) –0,00541×G 120 (ммоль/л) |
||
|
Авиньонский индекс |
SiM=[(0,137×Sиб)+Si2h]/2 |
||
|
Индекс Гутта, ISI (0,120) |
ISI (0, 120) = 75 000+(G0–G120) (ммоль/л) × 0,19 × масса тела (кг)/120 × Gсреднее ( 0, 120) (ммоль/л) × Log (I означает (0, 120)) (мкМЕ/л) |
||
|
Индекс Бельфиоре |
Индекс Бельфиоре = 2 (G S / GN ) × (IS / I N )+1 |
||
|
Статические тестовые индексы |
|||
|
Простые суррогатные маркеры |
|||
|
1/инсулин натощак |
Обратная концентрация инсулина в плазме натощак, мкМЕ/мл |
||
|
Соотношение глюкоза/инсулин |
Соотношение концентрации глюкозы в плазме натощак (мг/дл) и концентрации инсулина (мкМЕ/мл) |
||
|
HOMA-IR |
HOMA-IR = [инсулин натощак (мкМЕ/мл)] × [глюкоза натощак (ммоль/л)]/22,5 |
||
|
БЫСТРО |
QUICKI=1/[log инсулина натощак, мкМЕ/мл)+log (глюкоза натощак, мг/дл)] |
||
|
индекс Маколи |
Индекс Маколи = exp [2,63–0,28 ln (I 0 )–0,31 ln (TAG 0 )] |
||
SI, индекс чувствительности к инсулину; M, скорость утилизации глюкозы; G — равновесная концентрация глюкозы в крови; ΔI, разница между концентрациями инсулина в плазме натощак и в стационарном состоянии; FSIVGTT, внутривенный тест на толерантность к глюкозе с частой выборкой; HGP, производство глюкозы печенью; ПГТТ, пероральный тест на толерантность к глюкозе; МТТ, тест на толерантность к еде; ISI, индекс чувствительности к инсулину; Gmean — средняя концентрация глюкозы в плазме во время ПГТТ; Я имею в виду , среднюю концентрацию инсулина при ПГТТ; G 0 , концентрация глюкозы в плазме натощак; G 120 , концентрация глюкозы в плазме через 120 минут; I 0 , концентрация инсулина в плазме натощак (мкМЕ/л); я 120, концентрация инсулина в плазме через 120 минут; HOMA-IR, гомеостатическая модель оценки резистентности к инсулину; QUICKI, количественный индекс проверки чувствительности к инсулину; TAG 0 , концентрация триглицеридов натощак.
14. ВЫВОДЫ
На сегодняшний день
разработаны различные методы измерения функции β-клеток поджелудочной железы и
резистентности/чувствительности к инсулину. Каждый из этих тестов имеет
преимущества и ограничения. Наиболее подходящий метод следует выбирать с
учетом целей, методов и практической ситуации. Гипергликемический клэмп и
исследование HEC по-прежнему являются золотым стандартом для определения функции
β-клеток и чувствительности к инсулину соответственно, но они являются
инвазивными и трудоемкими. Таким образом, необходимо разработать
неинвазивный, недорогой и простой метод, наилучшим образом отражающий
физиологию метаболизма глюкозы и инсулина. Лучшее понимание того, как
измерять функцию β-клеток и резистентность/чувствительность к инсулину, поможет
нам понять патофизиологию СД и разработать стратегию лечения и новые лекарства.
15. ИСПОЛЬЗОВАННАЯ ЛИТЕРАТУРА
1. Чен Л., Мальяно Д.Дж., Зиммет
П.З. Мировая эпидемиология сахарного диабета 2 типа: настоящее и
перспективы на будущее. Нат Рев Эндокринол. 2011
г.; 8 : 228–36. [ PubMed ] [ Академия Google ]
2. ДеФронзо Р.А. Патогенез сахарного диабета 2 типа. Мед Клин Норт Ам. 2004 г.; 88 : 787–835. [ PubMed ] [ Академия Google ]
3. Группа проспективного исследования диабета в Великобритании (UKPDS). Интенсивный контроль уровня глюкозы в крови с помощью производных сульфонилмочевины или инсулина по сравнению с обычным лечением и риском осложнений у пациентов с диабетом 2 типа (UKPDS 33) Lancet. 1998 год; 352 : 837–53. [ PubMed ] [ Академия Google ]
4. Виберти Г., Кан С.Э., Грин Д.А., Герман В.Х., Зинман Б., Холман Р.Р. и др. Исследование прогрессирования исхода диабета (ADOPT): международное многоцентровое исследование сравнительной эффективности розиглитазона, глибурида и метформина при недавно диагностированном диабете 2 типа. Уход за диабетом. 2002 г.; 25 :1737–43. [ PubMed ] [ Академия Google ]
5. Моллер Д.Э., Флиер Дж.С. Резистентность к инсулину: механизмы, синдромы и последствия. N Engl J Med. 1991 год; 325 : 938–48. [ PubMed ] [ Академия Google ]
6. Мунияппа Р., Ли С., Чен Х., Куон М.Дж. Современные подходы к оценке чувствительности и резистентности к инсулину in vivo: преимущества, ограничения и правильное использование. Am J Physiol Endocrinol Metab. 2008 г.; 294 : Е15–26. [ PubMed ] [ Академия Google ]
7. Reaven G. Метаболический синдром или синдром инсулинорезистентности?: разные названия, разные концепции и разные цели. Эндокринол Метаб Клин Норт Ам. 2004 г.; 33 : 283–303. [ PubMed ] [ Академия Google ]
8. Nielsen JH, Galsgaard ED, Moldrup A, Friedrichsen BN, Billestrup N, Hansen JA, et al. Регуляция массы бета-клеток гормонами и факторами роста. Диабет. 2001 г.; 50 Приложение 1 : S25–9. [ PubMed ] [ Академия Google ]
9. Ньюсхолм П., Краузе М. Пищевая регуляция секреции инсулина: последствия для диабета. Clin Biochem Rev. 2012; 33 : 35–47. [ Бесплатная статья PMC ] [ PubMed ] [ Google Scholar ]
10. Кеппен Б.М., Стэнтон Б.А. Берн и Леви физиология. 7-е изд. Филадельфия: Эльзевир; 2018. [ Google Академия ]
11. Рорсман П., Ренстром Э. Динамика гранул инсулина в бета-клетках поджелудочной железы. Диабетология. 2003 г.; 46 : 1029–45. [ PubMed ] [ Академия Google ]
12. Петерсен М.С., Шульман Г.И. Механизмы действия инсулина и инсулинорезистентность. Physiol Rev. 2018; 98 : 2133–223. [ Бесплатная статья PMC ] [ PubMed ] [ Google Scholar ]
13. Фаерч К., Вистисен Д., Пачини Г., Тореков С.С., Йохансен Н.Б., Витте Д.Р. и соавт. Инсулинорезистентность сопровождается повышением уровня глюкагона натощак и замедленной супрессией глюкагона у лиц с нормальной и нарушенной регуляцией уровня глюкозы. Диабет. 2016; 65 : 3473–81. [ PubMed ] [ Академия Google ]
14. Чон С., Готье Дж. Ф. Обновленная информация о влиянии терапии на основе инкретинов на функцию и массу β-клеток. Диабет Метаб Дж. 2016; 40 : 99–114. [ Бесплатная статья PMC ] [ PubMed ] [ Google Scholar ]
15. Лузи Л., ДеФронзо Р.А. Влияние потери первой фазы секреции инсулина на выработку глюкозы в печени и утилизацию глюкозы в тканях у людей. Am J Physiol. 1989 год; 257 (2 часть 1): E241–6. [ PubMed ] [ Академия Google ]
16. Steiner KE, Mouton SM, Bowles CR, Williams PE, Cherrington AD. Относительная важность первой и второй фаз секреции инсулина в противодействии действию глюкагона на обмен глюкозы у собак, находящихся в сознании. Диабет. 1982 год; 31 : 964–72. [ PubMed ] [ Академия Google ]
17. Хансен Б.С., Виник А., Джен К.Л., Шильке Г.П. Колебания базального уровня и влияние измененного питания на соматостатин плазмы. Am J Physiol. 1982 год; 243 : R289–95. [ PubMed ] [ Академия Google ]
18. Ferrannini E, Cobelli C. Кинетика инсулина у человека. II. Роль печени. Diabetes Metab Rev. 1987; 3 : 365–97. [ PubMed ] [ Академия Google ]
19. Ferrannini E, Cobelli C. Кинетика инсулина у человека. I. Общие аспекты. Diabetes Metab Rev. 1987; 3 : 335–63. [ PubMed ] [ Академия Google ]
20. Хансен Б.С., Стриффлер Дж.С., Бодкин Н.Л. Снижение экстракции инсулина печенью предшествует явному инсулинзависимому диабету (II типа) у тучных обезьян. Обес Рез. 1993 год; 1 : 252–60. [ PubMed ] [ Академия Google ]
21. Ховорка Р., Джонс Р.Х. Как измерить секрецию инсулина. Diabetes Metab Rev. 1994; 10 : 91–117. [ PubMed ] [ Академия Google ]
22. Ховорка Р., Сунс П.А., Янг М.А. ISEC: программа для расчета секреции инсулина. Вычислительные методы Программы Биомед. 1996 год; 50 : 253–64. [ PubMed ] [ Академия Google ]
23. DeFronzo RA, Tripathy D. Инсулинорезистентность скелетных мышц является основным дефектом при диабете 2 типа. Уход за диабетом. 2009 г.; 32 (Приложение 2): S157–63. [ Бесплатная статья PMC ] [ PubMed ] [ Google Scholar ]
24. Пачини Г., Файнгуд Д.Т., Бергман Р.Н. Клэмп глюкозы на основе минимальной модели, обеспечивающий чувствительность к инсулину независимо от гликемии. Диабет. 1982 год; 31 (5 ч. 1): 432–41. [ PubMed ] [ Академия Google ]
25. Кац А., Намби С.С., Мазер К., Барон А.Д., Фоллманн Д.А., Салливан Г. и др. Количественный индекс проверки чувствительности к инсулину: простой и точный метод оценки чувствительности к инсулину у людей. J Clin Endocrinol Metab. 2000 г.; 85 :2402–10. [ PubMed ] [ Академия Google ]
26. Мацуда М., ДеФронзо Р.А. Показатели чувствительности к инсулину, полученные при пероральном тесте на толерантность к глюкозе: сравнение с эугликемическим инсулиновым клэмпом. Уход за диабетом. 1999 г.; 22 :1462–70. [ PubMed ] [ Академия Google ]
27. Мэтьюз Д.Р., Хоскер Дж.П., Руденски А.С., Нейлор Б.А., Тричер Д.Ф., Тернер Р.С. Оценка модели гомеостаза: резистентность к инсулину и функция бета-клеток по концентрации глюкозы в плазме натощак и концентрации инсулина у человека. Диабетология. 1985 год; 28 :412–9. [ PubMed ] [ Академия Google ]
28. Tripathy D, Almgren P, Tuomi T, Groop L. Вклад стимулированного инсулином поглощения глюкозы и базальной чувствительности печени к инсулину в суррогатных показателях чувствительности к инсулину. Уход за диабетом. 2004 г.; 27 :2204–10. [ PubMed ] [ Академия Google ]
29. Ferrannini E, Bjorkman O, Reichard GA, Jr, Pilo A, Olsson M, Wahren J, et al. Избавление от пероральной нагрузки глюкозой у здоровых людей: количественное исследование. Диабет. 1985 год; 34 : 580–8. [ PubMed ] [ Академия Google ]
30. Finegood DT, Hramiak IM, Dupre J. Модифицированный протокол оценки чувствительности к инсулину с использованием минимальной модели кинетики глюкозы у больных инсулинозависимым диабетом. J Clin Endocrinol Metab. 1990 г.; 70 : 1538–49. [ PubMed ] [ Академия Google ]
31. Quon MJ, Cochran C, Taylor SI, Eastman RC. Прямое сравнение стандартного и модифицированного инсулином протоколов для минимальной модельной оценки чувствительности к инсулину у здоровых субъектов. Диабет рез. 1994 год; 25 : 139–49. [ PubMed ] [ Академия Google ]
32. Саад М.Ф., Стейл Г.М., Кадес В.В., Аяд М.Ф., Эльсевафи В.А., Бояджян Р. и соавт. Различия между протоколами минимальной модели, усиленной толбутамидом, и модифицированной инсулином. Диабет. 1997 год; 46 :1167–71. [ PubMed ] [ Академия Google ]
33. Beard JC, Bergman RN, Ward WK, Porte D., Jr Индекс чувствительности к инсулину у мужчин без диабета. Корреляция между значениями, полученными из зажима, и значениями, полученными из IVGTT. Диабет. 1986 год; 35 :362–9. [ PubMed ] [ Академия Google ]
34. Бергман Р.Н., Прагер Р., Велунд А., Олефски Дж.М. Эквивалентность индекса чувствительности к инсулину у человека, полученного методом минимальной модели и эугликемическим клэмпом глюкозы. Джей Клин Инвест. 1987 год; 79 : 790–800. [ Бесплатная статья PMC ] [ PubMed ] [ Google Scholar ]
35. Ян Ю.Дж., Юн Ю.Х., Бергман Р.Н. Модифицированные протоколы улучшают оценку чувствительности к инсулину с использованием минимальной модели. Am J Physiol. 1987 год; 253 (6 ч. 1): E595–602. [ PubMed ] [ Академия Google ]
36. Бергман Р.Н., Идер Ю.З., Боуден К.Р., Кобелли К. Количественная оценка чувствительности к инсулину. Am J Physiol. 1979 год; 236 : E667–77. [ PubMed ] [ Академия Google ]
37. Кобелли С., Беттини Ф., Каумо А., Куон М.Дж. Переоценка минимальной эффективности модели глюкозы при наличии инсулинового ответа происходит из-за недостаточного моделирования. Am J Physiol. 1998 год; 275 : E1031–6. [ PubMed ] [ Академия Google ]
38. Cobelli C., Caumo A., Omenetto M. Минимальная завышенная оценка SG модели и недооценка SI: улучшенная точность байесовской двухкомпонентной модели. Am J Physiol. 1999 г.; 277 : Е481–8. [ PubMed ] [ Академия Google ]
39. ДеФронзо Р.А., Тобин Дж.Д., Андрес Р. Техника клэмп-глюкозы: метод количественной оценки секреции и резистентности к инсулину. Am J Physiol. 1979 год; 237 : E214–23. [ PubMed ] [ Академия Google ]
40. Чой К.С., Ким С., Ли В.Дж., Пак Дж.И., Хонг С.К., Ли М.Г. и др. Связь между массой тела при рождении и чувствительностью к инсулину у здоровых молодых мужчин в Корее: роль висцерального ожирения. Diabetes Res Clin Pract. 2000 г.; 49 : 53–9. [ PubMed ] [ Академия Google ]
41. Ларссон Х., Арен Б. Глюкозозависимый тест стимуляции аргинином для характеристики функции островков: исследования воспроизводимости и начального эффекта аргинина. Диабетология. 1998 год; 41 : 772–7. [ PubMed ] [ Академия Google ]
42. Чой К.С., Ким М.Ю., Хан К., Ли М.С. Оценка функции β-клеток у пациентов-людей. Островки. 2012 г.; 4 : 79–83. [ PubMed ] [ Академия Google ]
43. Feingold KR, Anawalt B, Boyce A, Chrousos G, de Herder WW, Dhatariya K, et al. Южный Дартмут: MDText.com Inc; 2021. Эндотекст. Глава, Оценка чувствительности и резистентности к инсулину у людей [цитируется 11 сентября 2021 г.]. Доступно по адресу: https://www.ncbi.nlm.nih.gov/books/NBK278954 . [ PubMed ] [ Академия Google ]
44. Кэмпбелл П.Дж., Мандарино Л.Дж., Герич Дж.Е. Количественная оценка относительного нарушения действия инсулина на продукцию глюкозы печенью и периферическое поглощение глюкозы при инсулиннезависимом сахарном диабете. Метаболизм. 1988 год; 37 :15–21. [ PubMed ] [ Академия Google ]
45. Рицца Р.А., Мандарино Л.Дж., Герич Дж.Е. Дозозависимые характеристики эффектов инсулина на выработку и утилизацию глюкозы у человека. Am J Physiol. 1981 год; 240 : E630–9. [ PubMed ] [ Академия Google ]
46. Моррис А.Д., Уеда С., Петри Дж.Р., Коннелл Дж.М., Эллиотт Х.Л., Доннелли Р. Эугликемический гиперинсулинемический зажим: оценка современной методологии. Clin Exp Pharmacol Physiol. 1997 год; 24 : 513–8. [ PubMed ] [ Академия Google ]
47. Гельфанд Р.А., Барретт Э.Дж. Влияние физиологической гиперинсулинемии на синтез и распад белков скелетных мышц у человека. Джей Клин Инвест. 1987 год; 80 : 1–6. [ Бесплатная статья PMC ] [ PubMed ] [ Google Scholar ]
48. Greenfield MS, Doberne L, Kraemer F, Tobey T, Reaven G. Оценка резистентности к инсулину с помощью теста на подавление инсулина и эугликемического зажима. Диабет. 1981 год; 30 : 387–92. [ PubMed ] [ Академия Google ]
49. Петерсен К.Ф., Дюфур С., Бефрой Д., Гарсия Р., Шульман Г.И. Нарушенная митохондриальная активность у резистентного к инсулину потомства больных сахарным диабетом 2 типа. N Engl J Med. 2004 г.; 350 : 664–71. [ Бесплатная статья PMC ] [ PubMed ] [ Google Scholar ]
50. Клерк Л.Х., Винсент М.А., Ян Л.А., Лю З., Линднер Дж.Р., Барретт Э.Дж. Ожирение притупляет рекрутирование микрососудов, опосредованное инсулином, в мышцах предплечья человека. Диабет. 2006 г.; 55 :1436–42. [ PubMed ] [ Академия Google ]
51. Тоффоло Г., Бреда Э., Каваган М.К., Эрманн Д.А., Полонски К.С., Кобелли С. Количественные показатели функции бета-клеток во время поэтапной инфузии глюкозы с повышением и понижением на минимальных моделях С-пептида. Am J Physiol Endocrinol Metab. 2001 г.; 280 : Е2–10. [ PubMed ] [ Академия Google ]
52. Eaton RP, Allen RC, Schade DS, Erickson KM, Standefer J. Надпеченочная выработка инсулина у человека: кинетический анализ с использованием поведения периферических соединительных пептидов. Дж. Клин Эндокринол Метаб. 1980 г.; 51 : 520–8. [ PubMed ] [ Академия Google ]
53. Американская диабетическая ассоциация. Диагностика и классификация сахарного диабета. Уход за диабетом. 2007 г.; 30 Приложение 1 : S42–7. [ PubMed ] [ Академия Google ]
54. Ясухара Д., Наруо Т., Нагаи Н., Танака М., Муранага Т., Нозоэ С. Инсулиногенный индекс через 15 минут как маркер нутритивной реабилитации при нервной анорексии. Am J Clin Nutr. 2003 г.; 77 : 292–9. [ PubMed ] [ Академия Google ]
55. Dalla Man C, Campioni M, Polonsky KS, Basu R, Rizza RA, Toffolo G, et al. Двухчасовой пероральный тест на толерантность к глюкозе с семью образцами и протокол приема пищи: минимальная модельная оценка чувствительности бета-клеток и чувствительности к инсулину у людей, не страдающих диабетом. Диабет. 2005 г.; 54 :3265–73. [ PubMed ] [ Академия Google ]
56. Шен С.В., Ривен Г.М., Фаркуар Дж.В. Сравнение сопротивления инсулин-опосредованному поглощению глюкозы у здоровых людей и у людей с латентным диабетом. Джей Клин Инвест. 1970 г.; 49 :2151–60. [ Бесплатная статья PMC ] [ PubMed ] [ Google Scholar ]
57. Харано Ю., Хидака Х., Такацуки К., Огаку С., Ханэда М., Мотои С. и др. Инфузия глюкозы, инсулина и соматостатина для определения чувствительности к инсулину in vivo. Метаболизм. 1978 год; 27 (9 Приложение 1): 1449–1452. [ PubMed ] [ Академия Google ]
58. Бергман Р.Н., Адер М., Файнгуд Д.Т., Пачини Г. Экстрапанкреатический эффект инфузии соматостатина для увеличения клиренса глюкозы. Am J Physiol. 1984 год; 247 (3 часть 1): E370–9. [ PubMed ] [ Академия Google ]
59. Faber OK, Binder C. Ответ C-пептида на глюкагон: тест на остаточную функцию бета-клеток при сахарном диабете. Диабет. 1977 год; 26 : 605–10. [ PubMed ] [ Академия Google ]
60. Pratley RE, Weyer C. Роль нарушенной ранней секреции инсулина в патогенезе сахарного диабета II типа. Диабетология. 2001 г.; 44 : 929–45. [ PubMed ] [ Академия Google ]
61. Пфайфер М.А., Граф Р.Дж., Холтер Дж.Б., Порте Д., мл. Регуляция секреции инсулина, индуцированной глюкозой, с помощью уровня глюкозы и толбутамида до стимула у здорового человека. Диабетология. 1981 год; 21 :198–205. [ PubMed ] [ Академия Google ]
62. Лейтон Э., Сейнсбери, Калифорния, Джонс, Дж.К. Практический обзор тестирования пептидов при диабете. Диабет Тер. 2017; 8 : 475–87. [ Бесплатная статья PMC ] [ PubMed ] [ Google Scholar ]
63. Yosten GL, Maric-Bilkan C, Luppi P, Wahren J. Физиологические эффекты и терапевтический потенциал проинсулинового C-пептида. Am J Physiol Endocrinol Metab. 2014; 307 : E955–68. [ Бесплатная статья PMC ] [ PubMed ] [ Google Scholar ]
64. Джонс А.Г., Хаттерсли А.Т. Клиническая ценность измерения С-пептида при лечении пациентов с диабетом. Диабет Мед. 2013; 30 : 803–17. [ Бесплатная статья PMC ] [ PubMed ] [ Google Scholar ]
65. Ван Каутер Э., Местрез Ф., Стурис Дж., Полонски К.С. Оценка скорости секреции инсулина по уровням С-пептида: сравнение индивидуальных и стандартных кинетических параметров клиренса С-пептида. Диабет. 1992 год; 41 : 368–77. [ PubMed ] [ Академия Google ]
66. Saisho Y. Отношение С-пептида к глюкозе после приема пищи как маркер функции β-клеток: значение для лечения диабета 2 типа. Int J Mol Sci. 2016; 17 :744. [ Бесплатная статья PMC ] [ PubMed ] [ Google Scholar ]
67. Rijkelijkhuizen JM, Girman CJ, Mari A, Alssema M, Rhodes T, Nijpels G, et al. Классические и основанные на модели оценки функции бетаклеток во время смешанной еды по сравнению с OGTT в популяционной когорте. Diabetes Res Clin Pract. 2009 г.; 83 : 280–8. [ PubMed ] [ Академия Google ]
68. Бергман Р.Н., Адер М., Хюкинг К., Ван Читтерс Г. Точная оценка функции бета-клеток: гиперболическая коррекция. Диабет. 2002 г.; 51 Приложение 1 : S212–20. [ PubMed ] [ Академия Google ]
69. Бонадонна Р.С., Груп Л., Кремер Н., Ферраннини Э., Дель Прато С., ДеФронцо Р.А. Ожирение и резистентность к инсулину у людей: исследование доза-реакция. Метаболизм. 1990 г.; 39 : 452–9. [ PubMed ] [ Академия Google ]
70. Чен Х., Салливан Г., Юэ Л.К., Кац А., Куон М.Дж. QUICKI — полезный индекс чувствительности к инсулину у пациентов с гипертонией. Am J Physiol Endocrinol Metab. 2003 г.; 284 : E804–12. [ PubMed ] [ Академия Google ]
71. Бергман Р.Н. Оркестровка гомеостаза глюкозы: от маленького желудя до калифорнийского дуба. Диабет. 2007 г.; 56 :1489–501. [ PubMed ] [ Академия Google ]
72. Хаффнер С.М., Ховард Г., Майер Э., Бергман Р.Н., Сэвидж П.Дж., Реверс М. и др. Чувствительность к инсулину и острая инсулиновая реакция у афроамериканцев, неиспаноязычных белых и латиноамериканцев с NIDDM: исследование атеросклероза, резистентного к инсулину. Диабет. 1997 год; 46 : 63–9. [ PubMed ] [ Академия Google ]
73. Лааксо М. Насколько хорошим маркером инсулинорезистентности является уровень инсулина? Am J Эпидемиол. 1993 год; 137 : 959–65. [ PubMed ] [ Академия Google ]
74. Легро Р.С., Файнгуд Д., Дунайф А. Соотношение глюкозы и инсулина натощак является полезной мерой чувствительности к инсулину у женщин с синдромом поликистозных яичников. J Clin Endocrinol Metab. 1998 год; 83 :2694–8. [ PubMed ] [ Академия Google ]
75. Silfen ME, Manibo AM, McMahon DJ, Levine LS, Murphy AR, Oberfield SE. Сравнение простых показателей чувствительности к инсулину у молодых девушек с преждевременным адренархе: отношение уровня глюкозы к инсулину натощак может быть простым и полезным показателем. J Clin Endocrinol Metab. 2001 г.; 86 : 2863–8. [ PubMed ] [ Академия Google ]
76. Вугуин П., Сэнгер П., Димартино-Нарди Дж. Соотношение глюкозы и инсулина натощак: полезная мера резистентности к инсулину у девочек с преждевременным адренархе. J Clin Endocrinol Metab. 2001 г.; 86 :4618–21. [ PubMed ] [ Академия Google ]
77. Куон М.Дж. Ограничения отношения глюкозы к инсулину натощак как показателя чувствительности к инсулину. J Clin Endocrinol Metab. 2001 г.; 86 :4615–7. [ PubMed ] [ Академия Google ]
78. Радзюк Ю. Чувствительность к инсулину и ее измерение: структурные сходства методов. J Clin Endocrinol Metab. 2000 г.; 85 :4426–33. [ PubMed ] [ Академия Google ]
79. Уоллес Т.М., Леви Дж.К., Мэтьюз Д.Р. Использование и злоупотребление моделированием HOMA. Уход за диабетом. 2004 г.; 27 :1487–95. [ PubMed ] [ Академия Google ]
80. Чен Х., Салливан Г., Куон М.Дж. Оценка прогностической точности QUICKI как суррогатного индекса чувствительности к инсулину с использованием калибровочной модели. Диабет. 2005 г.; 54 : 1914–25. [ PubMed ] [ Академия Google ]
81. Mather KJ, Hunt AE, Steinberg HO, Paradisi G, Hook G, Katz A, et al. Характеристики повторяемости простых индексов резистентности к инсулину: последствия для исследовательских приложений. J Clin Endocrinol Metab. 2001 г.; 86 : 5457–64. [ PubMed ] [ Академия Google ]
82. Hanley AJ, Williams K, Gonzalez C, D'Agostino RB, Jr, Wagenknecht LE, Stern MP, et al. Прогноз диабета 2 типа с использованием простых показателей резистентности к инсулину: объединенные результаты исследования сердца в Сан-Антонио, исследования диабета в Мехико и исследования атеросклероза с резистентностью к инсулину. Диабет. 2003 г.; 52 : 463–9. [ PubMed ] [ Академия Google ]
83. McAuley KA, Williams SM, Mann JI, Walker RJ, Lewis-Barned NJ, Temple LA, et al. Диагностика резистентности к инсулину в общей популяции. Уход за диабетом. 2001 г.; 24 :460–4. [ PubMed ] [ Академия Google ]
84. Stumvoll M, Mitrakou A, Pimenta W, Jenssen T, Yki-Jarvinen H, Van Haeften T, et al. Использование перорального теста на толерантность к глюкозе для оценки высвобождения инсулина и чувствительности к инсулину. Уход за диабетом. 2000 г.; 23 : 295–301. [ PubMed ] [ Академия Google ]
85. Avignon A., Boegner C., Mariano-Goulart D., Colette C., Monnier L. Оценка чувствительности к инсулину по инсулину в плазме и глюкозе натощак или после пероральной нагрузки глюкозой. Int J Obes Relat Metab Disord. 1999 г.; 23 : 512–7. [ PubMed ] [ Академия Google ]
86. Gutt M, Davis CL, Spitzer SB, Llabre MM, Kumar M, Czarnecki EM, et al. Валидация индекса чувствительности к инсулину (ISI(0,120)): сравнение с другими показателями. Diabetes Res Clin Pract. 2000 г.; 47 : 177–84. [ PubMed ] [ Академия Google ]
87. Belfiore F, Iannello S, Volpicelli G. Индексы чувствительности к инсулину, рассчитанные на основе базального и индуцированного OGTT уровня инсулина, глюкозы и свободных жирных кислот. Мол Жене Метаб. 1998 год; 63 : 134–41. [ PubMed ] [ Академия Google ]
