Боль
| Site: | Электронный информационно- образовательный портал ВолгГМУ |
| Course: | Дисциплина Экспериментальная патобиохимия клетки |
| Book: | Боль |
| Printed by: | Гость |
| Date: | Saturday, 18 May 2024, 9:08 AM |
Table of contents
- 1. Понятие боли
- 2. Виды боли
- 3. Распознавание повреждающих сигналов
- 4. Передача болевых сигналов в центральную нервную систему
- 5. Современные теории боли
- 6. Механизм возникновения болевых ощущений
- 7. TRP ионные каналы
- 8. Медиаторы воспаления и ноцицепторы
- 9. Потенциа́л де́йствия
- 10. Общие принципы фармакологии боли
- 11. Ионные каналы
- 12. Глутамат
- 13. ГАМК
- 14. Нейропептиды
- 15. Опиоидные рецепторы
- 16. Субста́нция Р
- 17. Клинико-фармакологические аспекты терапии болевого синдрома
1. Понятие боли
Международная ассоциация по изучению боли (IASP) дала следующее определение понятию боль:
Боль — неприятное сенсорное и эмоциональное переживание, связанное с истинным или потенциальным повреждением ткани или описываемое в терминах такого повреждения.
То есть боль, как правило, нечто большее, чем чистое ощущение, связанное с существующим или возможным органическим повреждением, поскольку обычно сопровождается эмоциональным переживанием.
Боль - системная реакция организма, возникающая на действие повреждающего фактора и направаленная на избавление организма от него. П. К. Анохин.
Системная реакция проявляется комплексом реакций.
Соматические - обеспечивают уход организма от повреждающего агента (двигательные).
Вегетативные - перестройка работы внутренних органов на новый уровень, изменяется гемодинамика. В результате обеспечивается работа органов на постоянном уровне. Эти реакции обеспечиваются за счёт вовлечения в ответный процесс вегетативной нервной системы и желёз внутренней секреции.
Эмоциональные реакции - обеспечиваются высшими отделами центральной нервной системы.
Боль - психофизиологический феномен, обеспечивающий перестройку внутри организма, меняя его отношения с внешней средой.
Как системная реакция организма боль состоит из 3-х процессов:
- возбуждение рецепторов;
- проведение импульсов в центральную нервную систему и возбуждение центральных структур;
- комплекс эффективных реакций, направленных на избавление организма от вредного фактора.
Ноцице́пция; ноциперце́пция; физиологи́ческая боль — это активность в афферентных (чувствительных) нервных волокнах периферической и центральной нервной системы, возбуждаемая разнообразными стимулами, обладающими пульсирующей интенсивностью. Данная активность генерируется ноцицепторами, или по-другому рецепторами боли, которые могут отслеживать механические, тепловые или химические воздействия, превышающие генетически установленный порог возбудимости. Получив повреждающий стимул, ноцицептор передаёт сигнал через спинной мозг и далее в головной. Ноцицепция сопровождается также самыми разнообразными проявлениями и может служить для возникновения опыта боли у живых существ.
Реакции, вызываемые ноцицепцией
Когда ноцицепторы стимулируются, они передают сигналы через сенсорные нейроны в спинном мозге. Эти нейроны высвобождают глютамат, главный нейромедиатор, который пересылает сигналы от одного нейрона к другому через синапсы. Если сигналы поступают в ретикулярную формацию и таламус, ощущение боли возникает в сознании в тупой, плохо локализуемой форме. Из таламуса сигнал может направляться в соматосенсорную кору головного мозга, и тогда боль локализуется более чётко и ощущается с более определёнными характеристиками. Ноцицепция может также вызывать менее определённые автоматические реакции, не зависимые от сознания, такие как бледность, потоотделение, брадикардию, гипотонию, головокружение, тошноту и обморок.
Происхождение термина
Термин «ноцицепция» был введен Чарльзом Скоттом Шеррингтоном, чтобы более чётко дифференцировать между физиологическим характером нервной активности при повреждении ткани и психологической реакцией на физиологическую боль. Слово «ноцицепция» происходит от латинских слов nocere — вредить и capere — брать, взять, принимать.

2. Виды боли
Впервые боль описана Гёзом, который проводил эксперименты на себе. В процессе опыта перерезал, а затем сшивал веточки нервов. Было обнаружено, что по мере срастания нервных волокон возникали болевые ощущения.
Выделяют 2 вида болевой чувствительности.
Протопатическая - возникает под действием любого неповреждающего фактора (прикосновение, температура). Это сильная боль тянущего характера, не имеет точной локализации не вызывает адаптации (т. е. к ней нельзя привыкнуть). Это наиболее примитивный вид болевой чувствительности.
Эпикритическая болевая чувствительность - возникает только под действием повреждающего фактора: носят острый режущий характер, обладают точной локализацией, но к ней можно приспособиться (явление адаптации). Это более новый путь болевой чувствительности.
Классификация боли.
По причине возникновения болевых ощущений:
- физиологическая - возникает как адекватная ответная реакция на действия повреждающего фактора.
- патологическая - возникает при поражении нервной системы или на действие неповреждающего фактора (каузалгия).
По времени возникновения и продолжительности болевых ощущений:
- острая - кратковременная, в виде приступов.
- хроническая - более длительная.
По локализации болевых ощущений:
- местная - в месте действия повреждающего фактора;
- проэкционная - возникает в зоне иннервации повреждённого волокна.
По виду раздражаемых рецепторов:
- интероцентивная.
- экстроцентивная.
- проприоцентивная.
Также выделяют боль соматическую и висцеральную.
Соматическая боль подразделяется на:
- поверхностную - возникает при поражении кожи и слизистых оболочек, подкожной жировой клетчатки - от экстерорецепторов - характеризуется свойствами эпикритической болевой чувствительности;
- глубокую - возникает при поражении мышц, суставов, суставных сумок, других глубоко расположенных образований - от проприорецепторов - характеризуется всеми свойствами протопатической болевой чувствительности.
Висцеральная боль.
Возникает при поражении внутренних органов - от интерорецепторов. При максимальном растяжении полых органов, действии химических веществ, нарушения гемодинамики. Характеризуется свойствами протопатической болевой чувствительности.
Нейропатическая боль – это болевой синдром, обусловленный поражением соматосенсорной нервной системы вследствие самых разных причин.
|
Периферическая нейропатическая боль |
|
Диабетическая полиневропатия |
|
Алкогольная полиневропатия |
|
Острая и хроническая воспалительная демиелинизирующая полиневропатии |
|
Алиментарно-обусловленные полиневропатии |
|
Идиопатическая сенсорная невропатия |
|
Компрессия или инфильтрация нерва опухолью Фантомные боли |
|
Постгерпетическая невралгия |
|
Тригеминальная невралгия |
|
ВИЧ-обусловленные сенсорные невропатии |
|
Туннельные невропатии |
|
Радикулопатии (шейные, пояснично-крестцовые) |
|
Боли после мастэктомии |
|
Пострадиационная плексопатия |
|
Комплексный регионарный болевой синдром |
|
центральная нейропатическая боль |
|
Компрессионная миелопатия при стенозе спинномозгового канала |
|
Пострадиационная миелопатия |
|
Сосудистая миелопатия |
|
ВИЧ-обусловленная миелопатия |
|
Травма спинного мозга |
|
Постинсультная боль |
|
Боли при рассеянном склерозе |
|
Боли при болезни Паркинсона |
|
Сирингомиелия |
Частота встречаемости в популяции составляет 6–7%, а на неврологических приемах пациенты с нейропатической болью составляют 10–12%. Клинически этот тип боли характеризуется комплексом специфических чувствительных расстройств, которые можно разделить на две группы. С одной стороны, это позитивные симптомы (спонтанная боль, аллодиния, гипералгезия, дизестезии, парестезии), с другой – негативные симптомы (гипестезия, гипалгезия). Этот тип болевого синдрома бывает трудно лечить, и не всегда удается полностью купировать болевой синдром. Нередко у таких пациентов нарушается сон, развивается депрессия и тревога, снижается качество жизни. Многие из них долго мучаются, прежде чем получают адекватную помощь. Большинство пациентов (около 80%) более года испытывают боль до своего первого обращения к специалисту.
Клиническая классификация боли
По локализации:
• соматическую поверхностную (в случае повреждения кожных покровов),
• соматическую глубокую (при повреждении костно-мышечной системы),
• висцеральную (при повреждении внутренних органов).
По месту повреждения структур нервной системы:
• Боли, возникающие при повреждении периферических нервов, называют нейропатическими болями, а при повреждении структур ЦНС - центральными болями
При не совпадении боли с местом повреждения выделяют:
• проецируемую боль (например, при сдавлении спинномозговых корешков, боль проецируется в иннервируемые ими области тела).
• отраженную боль (возникает вследствие повреждения внутренних органов и локализуется в отдаленных поверхностных участках тела. Иными словами, по отношению к кожной поверхности боль отражается на соответствующем дерматоме, например в виде зон Захарьина-Геда.)
По временным характеристикам:
• Острая боль - это новая, недавняя боль, неразрывно связанная с вызвавшим ее повреждением и, как правило, является симптомом какого-либо заболевания. Такая боль исчезает при устранении повреждения.
• Хроническая боль часто приобретает статус самостоятельной болезни, продолжается длительный период времени даже после устранения причины, вызвавшей острую боль. Наиболее приемлемым сроком для оценки боли как хронической, считается ее продолжительность более 3 мес
Боль, с которой чаще всего сталкивается в своей практике поликлинический врач:
• головная боль (мигрень, пучковые или кластерные головные боли, хроническая пароксизмальная гемикрания и головные боли мышечного напряжения; вторичные или симптоматические - следствие перенесенной черепно-мозговой травмы, сосудистой патологии мозга, опухолей и т.д.).
• боль, связанная с воспалением элементов опорно-двигательного аппарата (суставные боли, дискогенные радикулиты, миофасциальные боли, миалгии)
• абдоминальные боли
• лицевые боли
• боль при травме (ушибы, вывихи)
• боль при повреждениях кожи (ссадины, ожоги)
• зубная боль и боль после стоматологических вмешательств
• боль при стенокардии
• менструальная боль
• боль у онкологических больных
2.1. Нейропатическая боль
Это вид боли, который, в отличие от обычной боли, возникает не вследствие реакции на физическое повреждение, а в результате патологического возбуждения нейронов в периферической или центральной нервной системе, отвечающих за реакцию на физическое повреждение организма (обычную боль). Нейропатическая боль может быть ассоциирована с аномальными ощущениями (дизестезия) или болью, вызываемой стимулами, которые в норме не вызывают боли (аллодиния). Она может быть постоянной и / или эпизодической.
Клинические особенности
Нейропатические боли, как правило, имеют хроническое течение.
Для субъективной характеристики НБ больные используют такие определения, как жгучая, колющая, стреляющая, режущая. Для этих болей характерен комплекс специфических сенсорных расстройств, которые можно разделить на две группы. С одной стороны, это позитивные спонтанные (спонтанная боль, дизестезии, парестезии) и вызванные (аллодиния, гипералгезия, гиперестезия, гиперпатия) симптомы, с другой – негативные (гипестезия, гипалгезия) симптомы выпадения функции поврежденных структур. Для НБ характерна комбинация позитивных и негативных симптомов, меняющаяся у одного и того же больного в течение заболевания.
Очень характерным для нейропатического вида боли является феномен аллодинии – появление боли в ответ на стимул, который у здоровых людей ее не вызывает. В таких случаях больные испытывают сильные боли при малейшем прикосновении, иногда даже при дуновении ветра.
Различают температурную и механическую аллодинию. Механическая подразделяется на статическую, которая появляется при давлении на фиксированную точку кожного покрова, и динамическую, возникающую при движущихся стимулах (раздражение кожи кисточкой или пальцем).
При гипералгезии чувствительность к болевому стимулу оказывается значительно выше, чем ожидается в норме. При гиперпатии субъективный ответ как на болевой, так и на неболевой стимулы является чрезмерным и часто сохраняется в течение долгого времени после прекращения раздражения. Чувства щекотания, безболезненного покалывания и другие подобные ощущения относятся к парестезиям; если эти ощущения причиняют боль, их называют дизестезиями. Типичный пример НБ – феномен невралгии (тригеминальная, постгерпетическая). Одним из характерных симптомов НБ является каузалгия – интенсивная упорная жгучая боль, нередко носящая ланцинирующий характер, сочетающаяся с аллодинией и гиперпатией и часто сопровождающаяся сосудистыми и трофическими нарушениями. Сочетание жгучей боли с выраженными трофическими расстройствами, а также эффективность в части случаев симпатических блокад послужили поводом для предположения об участии в формировании этой боли симпатической нервной системы. Такую боль называют также симпатически поддерживаемой болью.
Клиническими признаками НБ являются:
- отсутствие причины для прямого раздражения ноцицепторов на периферии (травмы, воспаления, ишемии);
- персистирующий, длительный характер боли;
- неэффективность анальгетиков для купирования боли;
- локализация боли в зоне сенсорного дефекта, соответствующего поражению какого-либо отдела нервной системы;
- наличие стимулозависимых болевых феноменов – аллодинии, гипералгезии, гиперестезии, гиперпатии;
- сочетание с вегетативными расстройствами в области боли в виде снижения кровотока, гипер- или гипогидроза и т.д.;
- сочетание с моторными расстройствами;
- частое ухудшение самочувствия по ночам.
В жалобах пациентов патогномоничными дескрипторами боли считаются следующие определения: жгучая, стреляющая, дергающая, режущая или сравнимая с ощущением прохождения электрического тока.
Для НБ характерны коморбидные расстройства, в частности, нарушения сна, расстройства настроения в виде симптомов депрессии и тревоги. Распространенность депрессивных и тревожных расстройств у пациентов с НБ значительно выше, чем в общей популяции. У больных с сочетанием хронической боли и депрессии качество жизни хуже, а интенсивность боли выше. Тревога также является частым коморбидным состоянием при НБ. Пациенты с хронической болью обычно испытывают тревогу как результат стресса от жизни с болью. Боль может вызывать изменения уровня тревоги, а повышенная тревога способна усилить восприятие боли
Патогенез
Выделяют следующие периферические механизмы нейропатической боли:
1. Прямая стимуляция чувствительных нейронов (например, невралгия тройничного нерва, которая может быть вызвана компрессией нерва сосудами в области мостомозжечкового угла).
2. Периферическая сенситизация ноцицепторов медиаторами воспаления и биологически активными веществами (субстанция Р, нейрокинин А, кальцитонин-ген-связанный пептид), приводящая к снижению порога возбуждения ноцицепторов и повышению уровня их активности, что клинически проявляется в гипералгезии и аллодинии.
3. Аномальная эктопическая спонтанная активность поврежденных нервов, источниками которой являются зоны демиелинизации и регенерации нерва, что может быть причиной колющих, стреляющих, жгучих болей и парестезий. Она развивается в результате нестабильности мембранного потенциала за счет увеличения количества и перераспределения тетродотоксин-резистентных натриевых каналов. Избыточной активностью первичных С-афферентов объясняют спонтанную стимулонезависимую НБ.
4. Перекрестное возбуждение соседних волокон за счет эфаптической передачи электрического импульса. В месте электрического контакта могут взаимодействовать волокна разного диаметра, при этом сигнал распространяется в обоих направлениях. Полагают, что этот механизм лежит в основе стимулозависимых симптомов боли и объясняет ненормальное восприятие безвредной стимуляции при аллодинии и гиперпатии.
5. Повышение активности адренорецепторов на мембранах аксонов, что делает их чувствительными к катехоламинам и норадреналину, выделяющимся из окончаний постганглионарных симпатических волокон. Этот механизм может объяснять зависимость нейрогенной боли от эмоционального стресса и изменения общего состояния организма.
6. «Спрутинг-процесс», в результате которого симпатические волокна прорастают в спинномозговой узел и оплетают в виде корзинок тела чувствительных нейронов, создавая таким образом возможность передачи симпатического возбуждения на проводники соматической чувствительности.
К центральным механизмам нейропатической боли относят центральную сенситизацию, деафферентацию, дезингибицию, активацию дополнительных афферентных путей. Считается, что в центральных отделах нервной системы в условиях НБ происходят нейропластические процессы, в результате которых развивается состояние нарушенного баланса между возбуждающими и ингибиторными процессами. Это состояние описывается под общим названием «центральная сенситизация». Она происходит, когда нейроны задних рогов получают мощный «залп» импульсов от ноцицепторов, и характеризуется тремя основными признаками: избыточным ответом центральных нейронов на надпороговые стимулы, появлением ответов на подпороговую стимуляцию, расширением площади гипералгезии за пределы иннервации поврежденного нерва. При этом в нейронах задних рогов (ядрах спинномозговых нервов) могут развиваться следующие нейрофизиологические феномены:
- временная и пространственная суммация возбуждения;
- нарастающая потенциация (феномен «взвинчивания»), при которой нейроны становятся более чувствительными к последующим импульсам. Этот феномен опосредован NMDA-рецепторами;
- ответ нейронов на раздражения, наносимые вне зоны их иннервации;
- длительная потенциация;
- длительное центральное облегчение;
- устойчивая деполяризация;
- редукция порога возбуждения, когда неболевые стимулы активируют ноцицепторы.
Повышенную спонтанную активность нейронов считают основным механизмом стимулонезависимой боли. Возникновение стимулозависимых феноменов (аллодинии, гипералгезии) связывают с аномальной активацией нейронов задних рогов A-волокнами за счет их прорастания в наружные пластины заднего рога (спрутинг-процесс), изменений нейрохимического состава и нарушения центральных тормозных влияний.
Все описанные выше изменения нейрональной активности характерны не только для клеток заднего рога спинного мозга, но также и для супрасегментарных структур болевой чувствительности, включая кору головного мозга.
Деафферентация возникает при повреждении соматосенсорных путей, например, нерва, и заключается в растормаживании нейронов и усилении передачи болевых импульсов к вышележащим структурам ЦНС. То есть нейрональная активность генерируется не в поврежденном нейроне, а в нейронах высшего порядка. Примерами такого типа НБ являются диабетическая полинейропатия (ДПН) и постгерпетическая невралгия.
Дезингибиция представляет собой дефицит процессов, ингибирующих передачу ноцицептивной информации. Функциональная недостаточность нисходящих антиноцицептивных систем околоводопроводного серого вещества, ядер шва, диффузного ноцицептивного ингибирующего контроля (за счет опиатной, серотонинергической, норадренергической медиации) может определять окончательные характеристики болевого синдрома (интенсивность, длительность и т.д.).
Активация дополнительных (или так называемых замаскированных, интактных у здорового человека) афферентных путей происходит вследствие «блокады» восходящего болевого потока (повреждения соматосенсорной системы). Указанный механизм имеет в определенной мере компенсаторный характер, поскольку для нормальной работы антиноцицептивных систем необходимо сохранение потока болевой афферентации.
4. Передача болевых сигналов в центральную нервную систему
Существуют два направления, по которым происходит передача сигналов в головной мозг. Это неоспинобугорный путь (для быстрой боли) и палеоспинобугорный путь (для медленной боли).
Неоспиннобугорный путь
Быстрая боль направляется через Aδ-волокна, которые заканчиваются в сегменте I заднего рога спинного мозга. Здесь вторые по порядку в этом пути, передаточные нейроны вступают в дальнейший контакт и поднимают сигнал через позвоночные столбы. Эти волокна затем пересылают сигнал в вентролатеральные ядра таламуса. Оттуда третьи нейроны связываются с соматосенсорными полями коры головного мозга. Быстрая боль легко локализуется, если Aδ-волокна стимулируются совместно с тактильными рецепторами.
Палеоспиннобугорный путь
Медленная боль передаётся через медленный тип С-волокон к сегментам II и III заднего рога спинного мозга, также именуемым студенистым веществом. Здесь вторые по порядку в этом пути нейроны контактируют и пересылают сигнал в сегмент V заднего рога спинного мозга. Затем третьи нейроны присоединяются к волокнам быстрого пути, и направляются через переднелатеральный путь. Эти нейроны широко распространены в стволе мозга, одна десятая часть которых завершается в таламусе, а остальные — в продолговатом мозге, мосту и среднем мозгу. Медленную боль сложно локализовать.

5. Современные теории боли
В середине XX в. эволюция идей о боли развивалась по нескольким концептуальным направлениям. Был выдвинут ряд теорий, которые подвергались острой критике по мере накопления фактов по их основным положениям.
5.1. Теория входных ворот
В 1965 г. R.Melzack, Р.Wall предложили теорию входных ворот, которая, несмотря на определенные недостатки, в настоящее время принята большинством исследователей. Авторы теории сделали попытку объяснить с позиций современных нейрофизиологии, нейроанатомии, психологии и клиники боли высокую специализацию рецепторов и сенсорных проводящих путей в мозге, роль временной и пространственной суммации в функциях нервных структур, участвующих в процессе восприятия и переработки информации о боли, влияние различных психических процессов на восприятие боли и формирование ответа на нее, различные клинические проявления острой и хронической боли. Основные положения и механизмы этой теории изложены R. Melzack в 1973 г. (Р.Мелзак, 1981).
Основные положения теории "воротного контроля" заключались в следующем

Первое положение теории входных ворот заключается в том, что передача нервных импульсов от афферентных волокон к нейронам спинного мозга, передающим сигналы в головной мозг, модулируется спинальным воротным механизмом - системой интернейронов, локализованных в желатинозной субстанции (вторая и третья пластины заднего рога) спинного мозга. Установлено, что нейроны этих пластин получают аксонные терминали от множества афферентных волокон большого и малого диаметра, в эту же область входят дендриты более глубоких пластин задних рогов спинного мозга. Это дало основание полагать, что желатинозная субстанция действует как спинальные ворота, модулируя проведение нервных импульсов от периферических рецепторов к нейронам спинного мозга, дающим проекции в головной мозг, - релейным нейронам. Исследователи установили, что релейные нейроны спинного мозга лежат в третьей пластине заднего рога, и предполагают, что они играют важную роль в восприятии болевого сигнала и формировании ответной реакции на боль. В экспериментах показано, что эти клетки реагируют на афферентные импульсы широкого диапазона и частота их разрядов возрастает прямо пропорционально увеличению интенсивности стимуляции.
Согласно второму положению теории входных ворот, спинальный воротный механизм регулируется относительным количеством импульсов, поступающих по афферентным волокнам большого и малого диаметра. Воротный механизм ограничивает передачу нервных импульсов к релейным нейронам при высокой интенсивности импульсации по афферентным волокнам большого диаметра (закрывает ворота) и, наоборот, облегчает прохождение нервных импульсов к релейным нейронам в случаях, когда возрастает афферентный поток по афферентным волокнам малого диаметра (открывает ворота). Такая функция воротного механизма обусловлена изменением потоков импульсации, поступающих по А - и С -волокнам. В соответствии с теорией Р.Melzack, Р.Wall, волокна группы А, или волокна большого диаметра, оказывают короткое возбуждающее действие на нейроны вентролатеральной области серого вещества спинного мозга. После этого воротный механизм закрывается и через него прекращается передача от A - альфа-, А - сигма- и С -волокон. Весь этот процесс происходит в желатинозной субстанции. Возрастание потока импульсов в волокнах малого диаметра (А - бета- и С - волокнах) предотвращает развитие вышеописанного пресинаптического торможения путем угнетения активности интернейронов, осуществляющих это торможение. Таким образом, волокна, по которым передается ноцицептивная информация в мозг, облегчают работу воротного механизма и увеличивают возбуждающее действие на нейроны вентролатеральной области серого вещества спинного мозга (К.Casey, 1973).
Третье положение теории R.Melzack и Р.Wall заключается в том, что спинальный воротный механизм находится под влиянием нервных импульсов, которые передаются по волокнам нисходящих систем из коры большого мозга и ствола мозга. Такие когнитивные (оценивающие) факторы, как внимание, тревога и др., оказывают мощное влияние на процесс восприятия боли. Контроль за передачей сенсорной информации спинным мозгом головной мозг осуществляет через несколько систем. Ретикулярная формация ствола мозга, например, контролирует деятельность спинальных релейных нейронов, а также интернейронов, связанных с волокнами малого диаметра. Волокна из разных областей коры большого мозга проецируются в ретикулярную формацию, и вследствие этого когнитивные процессы могут влиять на активность ретикулоспинальных систем Когнитивные процессы действуют также на спинальный воротный механизм через системы кортикоспинальных волокон.
Четвертое положение теории состоит в том, что специализированная система волокон большого диаметра, обладающая высокой скоростью проведения, является триггером (пусковым устройством) центрального контроля, который активирует избирательные когнитивные процессы влияющие через нисходящие волокна на модулирующие свойства спинального воротного механизма. Функция триггера центрального контроля, по мнению R.Melzack, Р.Wall несут система задние столбы - медиальная петля и дорсолатеральная система.
Пятое положение теории следующее: когда возбуждение релейных нейронов спинного мозга превышает критический уровень, то их импульсация приводит к возбуждению системы действия. Эта система образована теми нервными структурами, которые обеспечивают сложно организованные и развивающиеся в определенном порядке образцы поведения индивидуума и вызывают ощущения, характерные для боли. При достижении критического уровня возбуждения в релейных нейронах поток импульсов передается в мозг, главным образом через антеролатеральную восходящую систему: волокнами неоспиноталамического пути в вентробазальный таламус и далее в соматосенсорную кору большого мозга, а также волокнами палеоспиноталамического пути в ретикулярную формацию, медиальный интраламинарный таламус и структуры лимбической системы.. Активация этих структур мозга является основой сенсорнодискриминативных, мотивационных и когнитивных компонентов общей реакции на боль. Эти три компонента, взаимодействуя между собой, обеспечивают перцептуальную информацию (положение, величина и пространственно-временные характеристики болевого стимула), мотивационные тенденции (уход от болевого стимула или агрессивное поведение) и когнитивную информацию (тревога, опыт прошлого). Все три компонента влияют на моторные механизмы, создающие видимые проявления ответа организма на боль.
Таким образом, основные принципы теории входных ворот учитывают специфичность рецепторов, физиологические механизмы конвергенции, суммации, облегчения и торможения, роль восходящих и нисходящих систем головного и спинного мозга. Тем не менее ряд экспериментальных данных, связанных с эффектами действия тонких, болевых афферентов на передачу информации в головной мозг, не укладывается в различные варианты схем воротной системы..
Теория входных ворот постоянно усовершенствуется с получением новых экспериментальных данных. Так, в положение о спинальном воротном механизме, действующем на интенсивность афферентного потока путем пресинаптической регуляции, внесено дополнение (L.Vyklicky, 1981), согласно которому в модуляции передачи импульсов на сегментарном уровне важную роль играют постсинаптическое торможение, увеличение концентрации ионов калия во внеклеточной среде мозга, а также серотонинергические нисходящие пути из ствола мозга. В настоящее время накоплено большое количество экспериментальных доказательств того, что модуляция передачи сенсорных, в том числе болевых, сигналов происходит не только на уровне входа афферентных волокон в спинной мозг, но и на других уровнях головного мозга, в частности в его высших отделах (коре большого мозга, таламусе). Подавляющий объем таких модулирующих влияний на сенсорные потоки осуществляется с помощью нейромодуляторов, принадлежащих к классам моноаминов, нейропептидов, а также аминокислот.
Открытие противоболевых систем ствола мозга существенно изменило ряд - представлений об организации и значении афферентных систем боли. Мысль о том, что боль является состоянием, противоположным состоянию удовольствия, была широко распространена до начала XIX в. Появившиеся затем новые теории боли, основанные на экспериментальных данных, вытеснили эту точку зрения, но, как оказалось, лишь на время. Изучая развитие и течение боли, наблюдаемой при повреждении органов, Р.Wall (1979) установил, что боль слабо связана с повреждением, но существенно с состоянием организма..
В связи с этим в состоянии организма после получения им повреждения автор выделил три фазы: ближайшую, острую и хроническую. В ближайшей фазе боль иногда не возникает совсем, но обязательно отмечаются некоторые формы активности (борьба, защита, поиски безопасного места и помощи). В острой фазе, которая возникает после того, как организм обезопасит себя от источника повреждения, формируется поведение организма, которое позволяет начать выздоровление. В этой фазе всегда есть боль, сигнализирующая о необходимости начала такого поведения. Существенной особенностью переходного периода от ближайшей к острой фазе, от повреждения к началу выздоровления является тревога. Это состояние направлено на достижение безопасности от угрозы повреждения, обеспечение лучших условий для начала лечения и выздоровления, а также на устранение возможных будущих последствий повреждения. Хроническая фаза характеризуется полным отсутствием активности, что является оптимальным условием выздоровления. Эта фаза сопровождается болью и депрессией и нередко длится дольше необходимого для выздоровления периода. В связи с этим Р.Wall (1979) полагает, что рассматривать боль как обычное сенсорное ощущение, сигнализирующее о повреждении тканей, нельзя, так как в случаях внезапного или очень медленного повреждения ока возникает значительно позже повреждения, и последнее как предвестник боли слабо связано с ее возникновением и интенсивностью. Отрицая роль боли как полезной предохранительной меры, Р.Wall предлагает считать ее сигналом о необходимости перехода организма в состояние отдыха и восстановления. Это ставит, по мнению Р.Wall, боль в класс тех общих чувств (жажда, голод), которые называются мотивационными состояниями (драйвами) и которые побуждают организм устранять причины, вызывающие общие чувства.
5.2. Теория специфичности боли.
Теория специфичности боли. Современные гипотезы о происхождении боли в тканях исходят из того, что это независимое ощущение со своим собственным специализированным нервным аппаратом из рецепторов, проводящих путей и центров. Согласно такому представлению, подкрепленному многими экспериментальными данными, все люди и практически все животные обладают особыми рецепторами с очень высоким порогом, которые возбуждаются только стимулами, повреждающими или грозящими повредить окружающую ткань. Рецепторы, реагирующие на такие «вредные» стимулы, названы ноцицепторами, а активируемые ими нейронные структуры ноцицептивной системой. Соответственно рецепция, проведение и центральная нервная обработка вредоносных сигналов составляют иоцицепцию; тем самым проводится грань между «объективными» нейронными процессами и «субъективным» ощущением боли. С такой точки зрения «теория специфичности боли» становится просто теорией специфичности ноцицепции. Это лишь один пример иногда еще встречающегося смешения терминов «ноцицепция» и «боль». Однако их следует различать: ноцицептивные нейронные структуры и происходящие в них электрические и химические процессы отнюдь не эквивалентны субъективно испытываемой боли. Одним из первых экспериментальных подтверждений теории специфичности было наблюдение: болевая чувствительность не распределена по коже равномерно; как и в случае механо- и терморецепции, болевые стимулы воспринимаются только в дискретных болевых точках. Их гораздо больше, чем точек давления. Холодовых и тепловых точек на коже еще меньше, чем последних. Уже по этой причине представлялось вероятным, что ноцицепция обслуживается особыми, специализированными ноцицепторами, а не механо- и терморецепторами, как требовали бы описанные ниже теории интенсивности и распределения импульсов.
5.3. Ноцицептивные теории интенсивности и распределения импульсов
Долгое время эти теории конкурировали с теорией специфичности. Они исходили из того, что огромное разнообразие вредных стимулов (т. е. отсутствие единственного адекватного стимула) как будто несовместимо с существованием специализированных ноцицепторов. Согласно этим концепциям, боль возникает всегда, когда интенсивность стимуляции низкопороговых механо- и терморецепторов превышает определенный уровень. По теории интенсивности ноцицептивные стимулы вызывают особо высокочастотные вспышки нмпульсацни низкопороговых рецепторов, а теория распределения импульсов предполагала особый характер нмпульсацни, отличный от возникающего в ответ на безвредные стимулы. Эти теории привлекали главным образом своей кажущейся простотой, поскольку связывали ноцицепцию со специфическими нейронными структурами. В наше время они уже не представляются такими простыми, как прежде; кодирование разной сенсорной информации в одной нервной сети считается сейчас значительно более сложной проблемой, чем ее обработка в разных системах.
6. Механизм возникновения болевых ощущений
Существует 2 теории механизма возникновения болевых ощущений:
- теория Фрея (1895г) - теория специфичности - болевые ощущения возникают при возбуждении специфических рецепторов (ноцицепторов).
- теория Гольдшейдера (1894г) - теория интенсивности - болевые ощущения могут возникать в любых рецепторах, но при действии на них очень сильных раздражителей.
В настоящее время обе теории приняты, т. е. возникшие болевые ощущения возможны при возбуждении и ноцицепторов и обычных рецепторов.
Ноцицепторы - специфические рецепторы, при возбуждении которых возникают болевые ощущения. Это свободные нервные окончания, которые могут быть расположены в любых органах и тканях и связаны с проводниками болевой чувствительности. Эти нервные окончания + проводники болевой чувствительности = сенсорная болевая единица. Большинство ноцицепторов имеет двойной механизм возбуждения, т. е. могут возбуждаться под действием повреждающих и неповреждающих агентов.
Ноцицепторы делятся на механо- и хеморецепторы.
Механорецепторы:
- располагаются в коже, слизистых оболочках, эпидермисе, мышцах, суставах;
- возбуждаются механическими раздражителями (или повреждающими факторами), тепловыми раздражителями (до 40 оС);
- импульсы поступают в центральную нервную систему по волокнам группы А, лишь от рецепторов эпидермиса - по волокнам группы С;
- обеспечивает целостность покровов (оболочек).
Хеморецепторы:
- располагаются в коже, подкожножировой клетчатке, внутренних органах, наружной стенке сосудов, мышцах;
- возбуждаются под действием механических раздражителей охлаждения и нагревания (14 оС и выше), растяжение полых органов;
- импульсы поступают в центральную нервную систему по волокнам группы С;
- регулируют процессы тканевого дыхания.
В организме выделены вещества, которые являются адекватными (специфическими) раздражителями для хеморецепторов - алгогены (тканевые, плазменные, нейропептиды).
Нейропептиды - вещество Р (медиатор боли). При различных раздражениях на терминальных нервных волокнах выделяется вещество Р, которое взаимодействует с хеморецепторами и генерирует болевые импульсы.
Тканевые - освобождаются при травме ткани. Это серотонин, гистамин, некоторые простагландины, М+, Са2+. Эта группа веществ может воздействовать на хемоноцицепторы и инервировать нервные болевые импульсы.
Плазменные - находятся в плазме крови в неактивном состоянии. Активируются при травме ткани и повышают действие основного медиатора боли - вещества Р (т. е. сами боль не вызывают). Это кинины (брадикинин), каллидин, XII плазменный фактор.
7. TRP ионные каналы
семейство катионных каналов с транзиторным рецепторным потенциалом (TRP) участвуют в восприятии температуры, механических и химических стимулов. При превышении порога возникает боль.
TRPC (каноническое) - связаны с фокальным сегментарным гломерулосклерозом.
TRPV (ваниллоидных) - TRPV1 опосредует едкий запах и боль / горячие ощущения, вызванные капсаицином и пиперином.
TRPA (анкириновых) - стресс (механическое) рецептора. Предположительно могут быть чувствительны к температуре; активируется изотиоцианатами (жгучими химическими веществами например горчичное масло и васаби).
TRPM (melastatin) - ассоциированы с гипомагнезиемией со вторичным гипокальциемии
TRPP (polycystin) - ассоциированы с поликистозом почек
TRPML (mucolipin) - ассоциированы с сиалолипидоз
TRPN (NOMPC) - не механорецепторных потенциал C - не найдены у млекопитающих

Большинство каналов TRP состоят из 6 трансмембранных спиралей с внутриклеточными N- и С-концами. У млекопитающих каналы TRP активируются и регулируются широким спектром разнообразных стимулов, в том числе многими посттранскрипционными механизмами, такими как фосфорилирование, ассоциацией рецепторов с G-белками, лиганд-регуляция и убихитинизация. Рецепторы обнаружены почти во всех типах клеток и в основном локализованы в клеточной мембране, модулирующий вход ионов.

8. Медиаторы воспаления и ноцицепторы
Повреждение тканей приводит к высвобождению медиаторов воспаления активированными ноцицепторами или не-нейрональными клетками, которые находятся в очаге или мигрируют в поврежденную обласьи, в их числе тучные клетки, базофилы, тромбоциты, макрофаги, нейтрофилы, эндотелиальные клетки, кератиноциты и фибробласты. Этот 'воспалительный суп' сигнальных молекул, включает в себя серотонин, гистамин, глутамат, АТФ, аденозин, вещество Р, кальцитонин-ген родственный пептид (КГП), брадикинин, эйкозаноиды, тромбоксаны, лейкотриены, эндоканнабиноиды, факторы роста нервов (ФРН), ФНО-альфа, интерлейкин 1β (IL-1β), внеклеточных протеазы и протоны.
Эти факторы действуют непосредственно на ноцицепторы путем связывания с одним или несколькими рецепторами на поверхности клетки, в том числе G белками рецепторов (GPCR), Trp каналы, кислотно-чувствительных ионных каналов (ASIC), калиевые двух поровые каналы (K2P) и тирозинкиназные рецепторы (TKR).
Биохимические механизмы боли: опиоидный, серотонинергический и адренергический
Возникновение центральной боли можно объяснить с позиции теории Г. Н. Крыжановского (1976) о генераторных механизмах нейропатологических синдромов. В любом отделе ноцицептивной системы может возникнуть генератор патологически усиленного возбуждения, который по принципу доминанты подчиняет себе различные функционально связанные церебральные и спинальные структуры и является причиной длительных болей таламического, тригеминального, спинального и другого характера. Появление генераторов возбуждения в антиноцицептивной системе способствует избавлению от боли.
К настоящему времени хорошо изучены некоторые биохимические механизмы антиноцицептивной системы - опиоидный, серотонинергический и адренергический.
Опиоидная антиноцицептивная система
К опиоидной антиноцицептивной системе относятся те участки головного и спинного мозга, которые связывают (адсорбируют) морфий и другие опиаты (опиатные рецепторы). Они находятся в области задних рогов спинного мозга, зрительном бугре, гипоталамусе, центральном околоводопроводном веществе, ретикулярной формации. Эти рецепторы весьма чувствительны не только к опиатам, но и к отдельным олигопептидам (эндорфин, энкефалин), которые существенно уменьшают проведение болевой импульсации и ее влияние на нервные клетки, имеющие отношение к боли.
Опиоидная система играет роль ограничителя ноцицептивного возбуждения и не допускает его нарастания выше пределов выносливости организма.
Серотонинергическая антиноцицептивная система
Серотонинергическая антиноцицептивная система представляет собой ряд восходящих и нисходящих путей, начинающихся от нейронов ядер шва ствола мозга и центрального околоводопроводного вещества, медиатором которых является серотонин. Раздражение серотонинергических нейронов вызывает противоболевой эффект. При хроническом болевом синдроме уменьшается содержание серотонина в церебральных структурах, цереброспинальной жидкости и крови.
На основании этих данных при болевых синдромах могут использоваться электрофорез серотонина и препараты, ингибирующие ферменты, которые разрушают серотонин, например ниаламид.
Адренергическая антиноцицептивная система
Адренергический антиноцицептивный механизм связан с функционированием эмоциональных зон мозга (переднесрединная и пограничные области гипоталамуса и др.), раздражение которых вызывает положительные или отрицательные эмоции. При воздействии болевого раздражителя под влиянием адренергических механизмов наступает антиноцицептивный, а в отдельных случаях - ноцицептивный эффект в зависимости от биологической значимости болей для организма.
Антиноцицептивным действием обладают также нейротензин, окситоцин, глицин, ангиотензин, ацетилхолин и др.
Существует и корковый противоболевой механизм, на что указывает уменьшение боли под влиянием гипноза, однако его морфологический и биохимический субстрат изучены недостаточно.
8.1. Брадикинин
Брадикинин — пептид, расширяющий кровеносные сосуды и потому снижающий артериальное давление. Ингибиторы АПФ[1], которые используются для снижения артериального давления, повышают уровень брадикинина. Брадикинин воздействует на кровеносные сосуды, высвобождая простациклин, оксид азота(II).
Состав брадикинина: Apг-Про-Про-Гли-Фен-Сер-Про-Фен-Apг.
Брадикинин — это физиологически и фармакологически активный пептид из кининовой группы белков, состоящий из девяти аминокислот.
Считается, что брадикинин является основным фактором, обеспечивающим болевую чувствительность, являясь плазменным алгогеном.

Брадикининовый рецептор
Есть два брадикинина рецепторов: рецептор В1 и В2 рецептора.
Брадикинина рецептор В1 (В1) является G-белком рецептор, кодируемый геном BDKRB1 в организме человека. Его основной лиганд является брадикинин, который генерируется в патофизиологических условиях, таких как воспаление, травмы, ожоги, шок, и аллергии. Рецептор В1 является одним из двух G-белковых рецепторов, которые были обнаружены, которые связывают брадикинин и опосредуют ответы на эти патофизиологических условиях. В1 белок синтезируется заново после повреждения ткани он участвует вгенезе к хронических и острых воспалительных реакций (рис).

Действия системы калликреин-кининовой на эндотелиальных клетках. Плазма PK) и ткани (ТК) форма калликреин брадикинин взаимодействующей с рецептором, В2. Дальнейшее метаболизм карбоксипептидазы М (CPM) или N (CPN) генерирует B1 агонист дез-Arg9 брадикинина. Ангиотензин-превращающий фермент (АПФ) деградирует эти активные пептиды кинины. Аппаратура передачи сигналов 2 кининовых рецепторов непосредственно, а также путем повышения VEGF / VEGFR2 путь активирует Енос, и связанное с этим увеличение NO является сильным проангиогенные стимул индукции проницаемость, миграцию и пролиферацию эндотелиальных клеток. Кроме того, ТК активирует про-ММР-9, который, в свою очередь, также способствует миграции
Рецептор В2 является G-белком рецептор, соединенный с Gq и Gi. Он стимулирует фосфолипазу С, чтобы увеличить количество внутриклеточного свободного кальция и Gi ингибирует аденилатциклазу. Кроме того, рецептор стимулирует митоген-активируемой протеинкиназы пути. Он Повсеместно и экспрессирован в здоровых тканях. Рецептор В2 образует комплекс с ангиотензин превращающим ферментом (АПФ), и это, как полагают, играют определенную роль в перекрестных отношениях между ренин-ангиотензиновой системы (РАС) и кининово-калликреиновой системы (ККС). Гептапептидный ангиотензина 1-7 (A1-7) также потенцирует действие брадикинина на В2-рецепторов. Icatibant является антагонист рецепторов второго поколения В2, проходит клинические испытания как аналгетик и НПВС. FR 173657 еще один пероральный активный антагонист B2 непептидная, подвергшийся испытаниям в качестве обезболивающего и противовоспалительного препарата. Каллидин также активирует рецептор В2.
Биологические эффекты, типы рецепторов, сигнальные механизмы влияния брадикинина на ноцицепцию и гиперальгезию
| Sensitized Response | Receptor Type | Signaling Mechanism | Membrane Target | Reference Nos. |
|---|---|---|---|---|
| Heat sensitization | ||||
| Heat-induced pain in human skin | Sympathetic system | 465, 492 | ||
| Heat-induced paw withdrawal in rats | B2 | COX 12-LOX | 245, 644 653 | |
| Heat-induced paw withdrawal in mice | Sympathetic system | TRPV1 TRPA1 Nav1.9 | 22, 45, 110 | |
| Heat-induced discharge of cat or monkey cutaneous noiceptors | 46, 350 | |||
| Heat-induced discharge of rat cutaneous nociceptors in vitro | B2 | Nonneuronal COX-1 and COX-2 Sympathetic system | 258, 375, 403,431, 478, 576,630, 631 | |
| Heat-induced discharge of dog testicular nociceptors in vitro | B2 | COX PKC | 392, 497 | |
| Heat response in the rat spinal cord–tail preparation in vitro | COX, LOX | 616 | ||
| Heat-induced CGRP release from isolated rat skin | 348 | |||
| Heat-induced CGRP release from isolated mouse trachea | TRPV1 | 356 | ||
| Heat-induced CGRP release from isolated mouse sciatic nerve | PKC | 200 | ||
| Heat-induced current in rat DRG neurons | PKCε | 94, 95 | ||
| Heat-induced TRPV1 activation in HEK cells and rat DRG neurons | PKC | TRPV1 | 685 | |
| Mechanical sensitization | ||||
| Mechanically-induced hindpaw withdrawal in the rat (Randall-Selitto method) | B2 | Sympathetic postganglionic fibers PLA2-COX-PGE2 NO-cGMP-PKG | P2X3/P2X2/3 | 142, 354, 423,424, 525, 674,695-697 |
| The same response after CFA treatment | B2 B1 | PKA | 354 | |
| Mechanically-induced hindpaw withdrawal in the rat (modified Randall-Selitto method) | B2 B2 B1 | TNF-α/IL-6/IL-1β/prostanoids TNF-α/CINC-1 (CXCL1)/sympathetic amines Leukocyte infiltration | β1adrenoceptor | 127, 189, 192,581 |
| Mechanically-induced hindpaw withdrawal in the mouse | B2 | COX + sympathetic amines (TNF-α, IL-1β) | TRPA1 Nav1.9 | 22, 126, 400 |
| The above response after LPS treatment | B1 | TNF-α/IL-1β/prostanoids KC (CXCL1)/prostanoids + sympathetic amines | 126 | |
| Articular mechanical hyperalgesia in the rat | B2 | 132, 133 | ||
| Mechanically-induced spike discharge in cat muscle afferents, cat or rat knee joint afferents, rat ankle joint nociceptors, rat cardiac vagal polymodal nociceptors, dog testicular nociceptors in vitro | 54, 247, 285,370, 487, 533,564 | |||
| Mechanically-induced spike discharge in guinea pig esophagal vagal C-fibers ex vivo | TRPA1 | 791 | ||
| Mechanically-induced spike discharge in mouse splanchnic colonic afferents in vitro | TRPA1 | 67, 68 | ||
| Chemical sensitization | ||||
| Capsaicin-induced response in the rat spinal cord–tail preparation in vitro | COX, LOX | 616 | ||
| Capsaicin-induced firing of vagal tracheal C-fibers in the guinea pig | 208 | |||
| Capsaicin- or low pH-induced nocifensive reaction in the mouse | 186 | |||
| Capsaicin-induced Ca2+ uptake in rat DRG neurons | B2 | PLC, PKC, COX-1 (COX-2) | 85, 711 | |
| Anandamide-induced cobalt uptake in rat DRG neurons | 658 | |||
| Capsaicin-induced SP release from rat DRG neurons | IP3-dependent Ca2+release COX-2 | 552, 709 | ||
| Incidence of capsaicin or proton responsiveness among rat DRG neurons | COX, LOX | 679 | ||
| Capsaicin- or low pH-induced TRPV1 gating | 110 | |||
| Capsaicin-induced current in TRPV1-transfected cells and rat DRG neurons | B2 | PKC-AKAP | TRPV1 | 436, 794 |
| Low pH-induced current in DRG neurons | 386 | |||
| Formalin-induced nocifensive reaction in the mouse | B2 B1 | 140 | ||
| Mustard oil-induced nocifensive reaction in the rat | 762 | |||
| Histamine-induced spike discharge in rat cutaneous nociceptors in vitro | 380, 381 | |||
| Histamine response in the human skin | 381 | |||
| Histamine or TXA2 analog-induced spike discharge in cat cardiac C-fibers | COX | 213, 214 | ||
| Histamine-induced CGRP release in the guinea pig lung | COX | 645 | ||
| Noradrenaline-evoked spike discharge in rat cutaneous nociceptors in vitro following CFA treatment | 40 | |||
| Recruitment of noradrenaline-evoked spike discharge in rat cutaneous nociceptors | 629 | |||
| Serotonin-evoked inward current in rat trigeminal neurons | PKC | 296 | ||

Рис. Схематическое изображение наиболее важных механизмов передачи сигнала брадикинина (БК) в ноцицептивных сенсорных нейронах. Синяя стрелка: активация мишени или стимуляция синтеза вещества; Красная линия: торможение цели; Пунктирная черная стрелка: расщепление вещества. Не показаны второстепенные внешние токи K + в случае каналов TRPV1, TRPM8 и TRPA1. Также не показаны активация ферментов MAPK и роль пути GC-NO-cGMP-PKG в тахифилаксии. VGCC, управляемые напряжением Ca2 + каналы; CACC, кальци-активированный Cl- канал; KCNQ, M-тип K + канал (Kv7); CAKC, кальций-активированный K + канал; ER, эндоплазматический ретикулум; IP3R, IP3 рецептор. Другие сокращения см. В тексте. АКАП показан только тогда, когда его участие было открыто выявлено.
http://physrev.physiology.org/content/92/4/1699

http://physrev.physiology.org/content/92/4/1699
8.2. Эйкозаноиды
История
Впервые простагландин был выделен в 1935 году шведским физиологом Ульфом фон Эйлером из семенной жидкости, поэтому термин «простагландин» происходит от латинского названия предстательной железы (лат. glandula prostatica). Позже оказалось, что простагландины синтезируются во многих тканях и органах. В 1971 году Джон Вейн обнаружил, что аспирин является ингибитором синтеза простагландинов. За исследование простагландинов он и шведские биохимики Суне Бергстрём и Бенгт Самуэльсон получили в 1982 Нобелевскую премию по физиологии и медицине.
Биохимия
Биосинтез[править | править вики-текст]
Простагландины находятся практически во всех тканях и органах. Они являются аутокринными и паракринными липидными медиаторами, которые воздействуют на тромбоциты, эндотелий, матку, тучные клетки и другие клетки и органы. Простагландины синтезируются из незаменимых жирных кислот (НЖК).
| Жирная кислота | Тип НЖК | Тип |
| Гамма-линоленовая кислота (GLA) через ДГЛК | ω-6 | Тип 1 |
| Арахидоновая кислота (AA) | ω-6 | Тип 2 |
| Эйкозапентаеновая кислота (ЭПК) | ω-3 | Тип 3 |
Промежуточный продукт образуется под действием фосфолипазы A2, который затем преобразуется либо по циклооксигеназному, либо по липоксигеназному пути. Циклооксигеназный путь синтезирует тромбоксаны, простациклин и простагландины D, E и F. Липоксигеназный путь синтеза, который активен в лейкоцитах и макрофагах, образует лейкотриены.
Секреция из клетки
Ранее считалось, что после синтеза простагландины выходят из клетки за счёт пассивной диффузии, так как они обладают значительной липофильностью. Однако, позже был обнаружен белок-переносчик простагландина (PGT, SLCO2A1), который опосредует клеточный захват простагландинов. Секреция же осуществляется другими белками: multidrug resistance protein 4 (MRP4, ABCC4) из семейства ATP-binding cassette transporter и, возможно, другими переносчиками, которые пока неизвестны.
Циклооксигеназы
Синтез простагландинов осуществляется в два этапа: окисление под действием циклоксигеназы и конечной простагландинсинтазы. Существует два типа циклооксигеназ: ЦОГ-1 и ЦОГ-2. Считается, что ЦОГ-1 определяет базальный уровень простагландинов, а ЦОГ-2 запускает синтез простагландинов при стимуляции (например, при воспалении).
Простагландин E-синтаза
Простагландин E2 (ПГE2) образуется простагландин E-синтазой из простагландина H2 (ПГH2). Обнаружено несколько простагландин E-синтаз. Считается, что микросомальная простагландин E-синтаза-1 является ключевой формой фермента, синтезирующего ПГE2.
Сравнение различных типов простагландинов простациклина, простагландина E2 (динопростон) и простагландина F2α.
| Тип | Рецептор | Функция |
|---|---|---|
| Простациклин | IP |
|
| Простагландин E2 | EP1 |
|
| EP2 |
| |
| EP3 |
| |
| неспец |
| |
| Простагландин F2α | FP |
|
| Full name | shortened name | activating prostanoids | classification[5] | G protein linkage[2] | pathways[2] |
|---|---|---|---|---|---|
| Prostaglandin DP1 receptor | DP1 | PGD2>>PGE2>PGF2α>PGI2=TXA2[6] | relaxant | Gs alpha subunit | activates AC, increases cAMP, raises Ca2+ |
| Prostaglandin DP2 receptor | DP2 | PGD2>>PGF2α=PGE2>PGI2=TXA2[7] | ? | Gi alpha subunit | inhibits AC to depress cAMP levels |
| Prostaglandin EP1 receptor | EP1 | PGE2>PGF2α=PGI2>PGD2=TXA2[8] | contractile | Gq alpha subunit | stimulates PLC, IP3, PKC, ERK, p38 Mpk, and CREB |
| Prostaglandin EP2 receptor | EP2 | PGE2>PGF2α=PGI2>PGD2=TXA2[9] | relaxant | Gi alpha subunit | stimulates AC, raises cAMP, stimulates beta catenin and Glycogen synthase kinase 3 |
| Prostaglandin EP3 receptor | EP3 | PGE2>PGF2α,PGI2>PGD2=TXA2[10] | inhibitory | Gi & G12 subunit | inhibits AC, decreases cAMP, stimulates PLC & IP3, raises Ca2+ |
| Prostaglandin EP4 receptor | EP4 | PGE2>PGF2α=PGI2>PGD2=TXA2[11] | relaxant | Gs alpha subunit | stimulates AC, PKA, PI3K, AKT, ERK, p38 Mpk, & CREB; raises cAMP |
| Prostaglandin F2α receptor | FP | PGF2α>PGD2>PGE2>PGI2=TXA2[12] | contractile | Gq alpha subunit | stimulates PLC, IP3, & PKC; raises Ca2+ |
| Prostacyclin I2 receptor | IP | PGI2>>PGD2=PGE2=PGF2α>TXA2[13] | relaxant | Gs alpha subunit | stimulates AC & PKA; raises cAMP |
| Thromboxane A2 receptor | TP | TXA=PGH2>>PGD2=PGE2=PGF2α=PGI2[14] | contractile | Gq alpha subunit | stimulates PLC & IP3; raises Ca2+ |
Схематическое представление наиболее важных механизмов передачи сигнала простагландинами (PG) в ноцицептивных сенсорных нейронах.
Синие стрелки: активация мишени или стимуляция синтеза вещества; красные линии: ингибирование мишени (пунктирная линия указывает на вероятное тормозящее действие); пунктирная черная стрелка: расщепление вещества. Чтобы избежать путаницы, подтип (ы) простаноидных рецепторов не показаны. Также не показаны незначительные внешние K + токи в случае TRPV1, TRPM8, TRPA1, HCN2 и SAAC каналов. VGCC, потенциалзависимыми Са2 + каналы; ТТХ-R, тетродотоксин-устойчивые Na + каналы (NAV1 8, 9 NAV1..); HCN2, гиперполяризации активированный циклических нуклеотидов закрытого канала; SACC, стретч-активированный катионом канал; CAKC, кальций-активируемых K + каналов; TREK, механочувствительных K + канал; VGKC, K + каналы напряжения закрытого; ER, эндоплазматической сети; IP3R, IP3-рецептор. Для других сокращений см текст. AKAP показан только тогда, когда его участие было выявлено непосредственно

| Prostanoid | Sensitized Response | Receptor Type | Signaling Mechanism | Membrane Target | Reference Nos. |
|---|---|---|---|---|---|
| Heat sensitization | |||||
| PGE2, PGI2, PGE1, PGF2α | Heat response in the rat spinal cord-tail preparation in vitro | 616 | |||
| PGE2, PGI2 | Heat-induced spike discharge in dog testicular and rat cutaneous nociceptors in vitro | EP2(dog) | cAMP (dog) | 146, 389,391, 496,499 | |
| PGE2, PGE2-G | Heat-induced hindpaw withdrawal in rats | PKA-AKAP | 176, 295,318, 644 | ||
| 8-iso PGE2 | |||||
| PGE2 PGI2 | Heat-induced hindpaw withdrawal in mice | EP1 IP | PKA-AKAP | TRPV1 Nav1.9 Nav1.8 | 22, 202,323, 347,463, 511,643, 787 |
| PGE2 | Prolongation of heat hyperalgesia | EP4 | cAMP–Epac–Rap1-PKCε; ERK | 171 | |
| PGE2 | Heat-induced tail withdrawal in the monkey | 531 | |||
| PGE2 | Heat threshold in human skin (1°C decrease) | 618 | |||
| PGE2 | Heat-induced TRPV1 activation in HEK cells and mouse DRG neurons | EP1 EP4 | PKC-AKAP PKA-AKAP | TRPV1 | 511, 643 |
| PGI2 | IP IP | PKC PKA | |||
| PGE2 | Reduction of cooling-induced Ca2+ transients in rat DRG neurons | cAMP-PKA | TRPM8 | 435 | |
| PGE2 | Heat-induced CGRP release from isolated mouse sciatic axons | cAMP-PKA | TRPV1 | 200 | |
| Mechanical sensitization | |||||
| PGE1 | Mechanically-induced vocalization in the rat | 593 | |||
| PGE2, PGI2PGE2-G, 8-iso PGE2, 8-iso GF2α | Mechanically-induced hindpaw withdrawal in the rat (Randall-Selitto test) | Gs–cAMP–PKA–5-LOX | Nav1.8 | 14, 15, 176, 295, 351, 355, 423, 553, 694, 695, 697–700 | |
| NO | |||||
| PGE2 | The above response in carrageenan-induced primed state in the rat skin | PKCε; ERK | 16, 154,325, 558,559 | ||
| PGE2 | The above response in carrageenan- or vibration-induced primed state in rat skeletal muscle | PKCε | 151, 153 | ||
| PGE2, PGI2 | Mechanically-induced hindpaw withdrawal in the rat (modified Randall-Selitto test) | cAMP-PKA-PDE4 | 124, 193, 194, 202, 278, 623, 751 | ||
| PKCε | |||||
| PGE2(repeated) | Mechanically-induced hindpaw withdrawal in the rat (modified Randall-Selitto test): persistent hyperalgesia | PKA | Nav1.8 | 190, 748–750 | |
| PKCε | |||||
| PGE2 | Mechanically-induced hindpaw withdrawal in the mouse | EP3 | cAMP-PKA PKC(ε) ERK,ERKCXCR2 receptor | Nav1.9 | 22, 336,464, 748 |
| PGE2 | Mechanically-induced spike discharge in rat cutaneous nociceptors | Gs-cAMP-PKA NO | 1, 101,760, 773100 | ||
| PGE2and/or PGI2 | Mechanically-induced spike discharge in cat (knee joint) or rat (ankle, knee, tarsal joint) articular or meningeal nociceptors or pulmonary C-fibers, in canine testicular nociceptors in vitro | cAMP (dog) | 53, 54,247, 287,370, 564,636, 638,796 | ||
| PGE2 | Hyposmotic stimulation-induced spike discharge in rat cutaneous C-fibers | TRPV4 | 10 | ||
| PGE2 | Hyperosmotic or hyposmotic stimulation-induced nocifensive reaction in the rat or mouse | TRPV4 TREK-1 | 9, 10, 18 | ||
| Chemical sensitization | |||||
| PGE2, PGE1 | Bradykinin-induced pain in human skin and veins, low pH-induced pain in human skin and muscle | 195, 366,618 | |||
| PGE1 | Bradykinin, histamine or serotonin-induced spike discharge and reflex hypotension in the isolated perfused rabbit ear | 326 | |||
| PGE2 | Bradykinin, capsaicin or phenyl-biguanide-induced cardiorespiratory reflex in dogs or rats | 114, 409 | |||
| PGE2, PGI2 | Bradykinin or acetate-induced writhing in the mouse, formalin (both phases), capsaicin, α,β-methylene-ATP or acetaldehyde-induced nocifensive reaction in rat or mouse paw | 38, 49,104, 262,634, 757 | |||
| PGE2, PGI2, PGE1, PGF2α | Bradykinin or capsaicin-induced reflex response in the rat spinal cord-tail preparation in vitro | cAMP | 162, 616,786 | ||
| PGE2, PGE1, PGI2 | Bradykinin-induced spike discharge in cat and rat cutaneous, cat muscle, cat knee joint, rat ankle joint, cat cardiac, rat jejunal (in vitro), dog testicular (in vitro) nociceptors | EP3 (dog testis) | 54, 55,70, 96,213, 247,265, 389,390, 490,502, 636,638, | ||
| TXA2analog | |||||
| PGE2 | Bradykinin-induced spike discharge in rat DRG neurons K+-induced spike discharge in rat trigeminal and DRG neurons | cAMP-PKA | 34, 123,534 | ||
| PGE2, PGI2 | Bradykinin-induced increase in Ca2+ in rat DRG neurons | cAMP-PKA | 663, 680 | ||
| PGE2, PGD2, PGI2 | Bradykinin or kallidin-induced SP and/or CGRP release from rat DRG neurons, bovine dental pulp or rat skin (in vitro) | cAMP-PKA | L, N, P-type Ca2+channels | 29, 177,240, 280,282, 524,663, 742 | |
| 8-iso PGE2 | 176 | ||||
| PGE2 | Capsaicin-, lactate- or adenosine-induced spike discharge in rat pulmonary C-fibers | 287 | |||
| PGE2, PGI2 | Capsaicin-induced membrane current in rat DRG neurons | EP4 | cAMP–PKA AKAP | TRPV1 | 433, 441,442, 578,794 |
| PGE2 | Capsaicin or phenylbiguanide induced membrane current in rat vagal sensory neurons | EP2 | TRPV1 | 401 | |
| PGE2 | Anandamide-induced cobalt uptake in rat DRG neurons | TRPV1 | 658 | ||
| PGE2(short) | Capsaicin- or proton-induced TRPV1 activation in HEK cells and mouse DRG neurons | EP1 | PKC | TRPV1 | 511, 643 |
| PGE2(long) | EP4 | PKA-AKAP | TRPV1 | ||
| PGI2(short) | IP | PKC | TRPV1 | ||
| PGI2(long) | IP | PKA | TRPV1 | ||
| PGE2, PGI2 | Capsaicin-induced SP and CGRP release from rat DRG neurons | EP3C EP4 | cAMP–PKA | L, N, P-type Ca2+channels | 177, 280,282, 668 |
| 8-iso PGE2 | 176 | ||||
| PGE2, PGI2 | Capsaicin- or anandamide-induced CGRP release in rat trigeminal, capsaicin, ATP, K+-induced SP release from rat DRG neurons, proton-induced CGRP release in rat dura mater (in vitro) | EP2(trig.) | TRPV1 | 523, 563,587, 804 | |
| PGE2 | Acetaldehyde-induced Ca2+ accumulation in mouse trigeminal neurons | EP1 | PLC–PKC cAMP-PKA | TRPA1 | 38 |
| PGE2 | α,β-Methylene-ATP-induced mechanical and heat hyperalgesia in rats | cAMP–PKA | 759 | ||
| PGE2 | ATP-induced membrane current in rat DRG neurons The same response in neurons from CFA-treated rats | EP3 | cAMP–PKA PKA + PKCε | 759 758 | |
| PGE2 | Capsaicin, ATP, phenylbiguanide, histamine, SP or K+-induced increase of Ca2+ in rat vagal sensory or DRG neurons | cAMP–PKA–Ca2+entry | 248, 537,649 | ||
Предположительные механизмы передачи сигналов брадикинина и простагландинов в периферических окончаний ноцицептивных сенсорных нейронов, основанные на исследованиях, использующих запись одноволоконного, высвобождение нейропептидов или поведенческие тесты, отражающие активность периферических ноцицепторов. Синяя стрелка: активация мишени или стимуляции синтеза вещества; красная линия: ингибирование мишени (пунктирная линия указывает на вероятное тормозящее действие); пунктирная черная стрелка: расщепление вещества. Не показаны незначительные внешние K + токи в случае TRPV1, TRPA1 и HCN2 каналов. VGCC, потенциалзависимыми Са2 + каналы; CACC, кальций-активируемых Cl- канал; HCN2, гиперполяризации активированный циклических нуклеотидов закрытого канала; TREK, механочувствительных K + канал. AKAP показан только тогда, когда его участие было непосредственно обнаружено.

9. Потенциа́л де́йствия
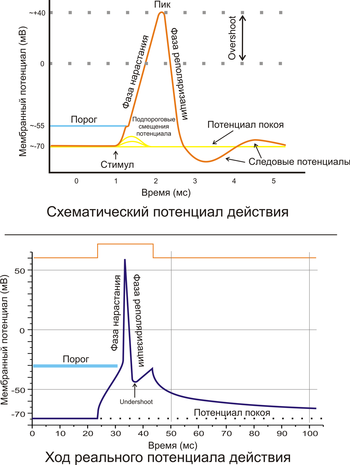
Потенциа́л де́йствия — волна возбуждения, перемещающаяся по мембране живой клетки в виде кратковременного изменения мембранного потенциала на небольшом участке возбудимой клетки (нейрона или кардиомиоцита), в результате которого наружная поверхность этого участка становится отрицательно заряженной по отношению к внутренней поверхности мембраны, в то время, как в покое она заряжена положительно. Потенциал действия является физиологической основой нервного импульса.
Благодаря работе «натрий-калиевого насоса» концентрация ионов натрия в цитоплазме клетки очень мала по сравнению с окружающей средой. При проведении потенциала действия открываются потенциал-зависимые натриевые каналы и положительно заряженные ионы натрия поступают в цитоплазму по градиенту концентрации, пока он не будет уравновешен положительным электрическим зарядом. Вслед за этим потенциал-зависимые каналы инактивируются и отрицательный потенциал покоя восстанавливается за счёт диффузии из клетки положительно заряженных ионов калия, концентрация которых в окружающей среде также значительно ниже внутриклеточной.

9.1. Генерация потенциалов
Поляризация мембраны живой клетки обусловлена отличием ионного состава с её внутренней и наружной стороны. Когда клетка находится в спокойном (невозбуждённом) состоянии, ионы по разные стороны мембраны создают относительно стабильную разность потенциалов, называемую потенциалом покоя. Если ввести внутрь живой клетки электрод и измерить мембранный потенциал покоя, он будет иметь отрицательное значение (порядка −70 — −90 мВ). Это объясняется тем, что суммарный заряд на внутренней стороне мембраны существенно меньше, чем на внешней, хотя с обеих сторон содержатся и катионы, и анионы. Снаружи — на порядок больше ионов натрия, кальция и хлора, внутри — ионов калия и отрицательно заряженных белковых молекул, аминокислот, органических кислот, фосфатов, сульфатов. Надо понимать, что речь идёт именно о заряде поверхности мембраны — в целом среда и внутри, и снаружи клетки заряжена нейтрально.
Потенциал мембраны может изменяться под действием различных стимулов. Искусственным стимулом может служить электрический ток, подаваемый на внешнюю или внутреннюю сторону мембраны через электрод. В естественных условиях стимулом часто служит химический сигнал от соседних клеток, поступающий черезсинапс или путём диффузной передачи через межклеточную среду. Смещение мембранного потенциала может происходить в отрицательную (гиперполяризация) или положительную (деполяризация) сторону.
В нервной ткани потенциал действия, как правило, возникает при деполяризации — если деполяризация мембраны нейрона достигает некоторого порогового уровня или превышает его, клетка возбуждается, и от её тела к аксонам и дендритам распространяется волна электрического сигнала. (В реальных условиях на теле нейрона обычно возникают постсинаптические потенциалы, которые сильно отличаются от потенциала действия по своей природе — например, они не подчиняются принципу «всё или ничего». Эти потенциалы преобразуются в потенциал действия на особом участке мембраны — аксонном холмике, так что потенциал действия не распространяется на дендриты).
Это обусловлено тем, что на мембране клетки находятся ионные каналы — белковые молекулы, образующие в мембране поры, через которые ионы могут проходить с внутренней стороны мембраны на наружную и наоборот. Большинство каналов ионо-специфичны — натриевый канал пропускает практически только ионы натрия и не пропускает другие (это явление называют селективностью). Мембрана клеток возбудимых тканей (нервной и мышечной) содержит большое количество потенциал-зависимых ионных каналов, способных быстро реагировать на смещение мембранного потенциала. Деполяризация мембраны в первую очередь вызывает открытие потенциал-зависимых натриевых каналов. Когда одновременно открывается достаточно много натриевых каналов, положительно заряженные ионы натрия устремляются через них на внутреннюю сторону мембраны. Движущая сила в данном случае обеспечивается градиентомконцентрации (с внешней стороны мембраны находится намного больше положительно заряженных ионов натрия, чем внутри клетки) и отрицательным зарядом внутренней стороны мембраны (см. Рис. 2). Поток ионов натрия вызывает ещё бо́льшее и очень быстрое изменение мембранного потенциала, которое и называют потенциалом действия (в специальной литературе обозначается ПД).
Согласно закону «всё-или-ничего» мембрана клетки возбудимой ткани либо не отвечает на стимул совсем, либо отвечает с максимально возможной для неё на данный момент силой. То есть, если стимул слишком слаб и порог не достигнут, потенциал действия не возникает совсем; в то же время, пороговый стимул вызовет потенциал действия такой же амплитуды, как и стимул, превышающий пороговый. Это отнюдь не означает, что амплитуда потенциала действия всегда одинакова — один и тот же участок мембраны, находясь в разных состояниях, может генерировать потенциалы действия разной амплитуды.
После возбуждения нейрон на некоторое время оказывается в состоянии абсолютной рефрактерности, когда никакие сигналы не могут его возбудить снова, затем входит в фазу относительной рефрактерности, когда его могут возбудить исключительно сильные сигналы (при этом амплитуда ПД будет ниже, чем обычно). Рефрактерный период возникает из-за инактивации быстрого натриевого тока, то есть инактивации натриевых каналов (см. ниже).
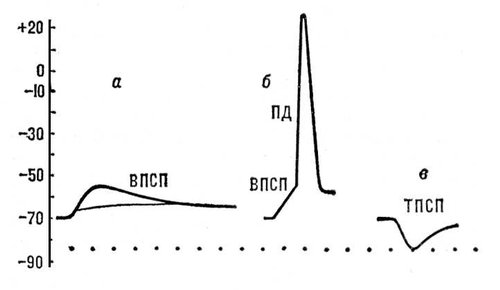
Постсинаптические потенциалы (ПСП) возникают в участках мембраны нервных или мышечных клеток, непосредственно граничащих с синаптическими окончаниями. Они имеют амплитуду порядка нескольких мв и длительность 10—15 мсек. ПСП подразделяются на возбуждающие (ВПСП) и тормозные (ТПСП). ВПСП представляют собой местную деполяризацию постсинаптической мембраны, обусловленную действием соответствующего медиатора (например, ацетилхолина в нервно-мышечном соединении). При достижении ВПСП некоторого порогового (критического) значения в клетке возникает распространяющийся ПД (рис. 5, а, б). ТПСП выражается местной гиперполяризацией мембраны, обусловленной действием тормозного медиатора (рис. 5, в). В отличие от ПД, амплитуда ПСП постепенно увеличивается с увеличением количества выделившегося из нервного окончания медиатора. ВПСП и ТПСП суммируются друг с другом при одновременном или последовательном поступлении нервных импульсов к окончаниям, расположенным на мембране одной и той же клетки.
9.2. Потенциал-зависимые ионные каналы
Ионные потенциал-зависимые каналы - это каналы, которые открываются и закрываются в ответ на изменение мембранного потенциала , например, натриевые каналы , ответственные за потенциал действия . Механизм действия потенциал-зависимых каналов изучают в системе фиксации потенциала. Если мембранный потенциал поддерживать на уровне потенциала покоя , натриевый ток практически отсутствует, что означает, что натриевые каналы закрыты. Если теперь сдвинуть мембранный потенциал в положительную сторону и удерживать его на постоянном уровне, то потенциал-зависимые натриевые каналы откроются и ионы натрия начнут передвигаться в клетку по градиенту концентрации. Этот натриевый ток достигнет максимума примерно через 0,5 мс после того, как установится новое значение потенциала. Через несколько миллисекунд ток падает почти до нуля, даже если клеточная мембрана остается деполяризованной, что означает, что каналы, открывшиеся на какой- то момент, снова закрылись. Закрывшись, каналы переходят в инактивированное состояние, отличающееся от первоначального закрытого состояния, при котором они были способны открыться в ответ на деполяризацию мембраны. Каналы остаются инактивированными до тех пор, пока мембранный потенциал не вернется к исходному отрицательному значению и не закончится восстановительный период длительностью в несколько миллисекунд.
При изучении трансмембранного тока было замечено, что наблюдаются небольшие непредсказуемые колебания тока, которые, видимо, отражают открывание и закрывание отдельных каналов.
При регистрации токов в очень малых участках мембраны было обнаружено, что канал открывается по принципу "все или ничего". Открытые каналы обладают одинаковой проводимостью, но открываются и закрываются независимо друг от друга, поэтому суммарный ток через мембрану всей клетки с ее многочисленными каналами определяется не степенью открытости каналов, а вероятностью быть открытым для каждого отдельного канала.
Предполагают, что потенциал-зависимые каналы состоят из белков, которые могут принимать несколько альтернативных конформаций, каждая из которых стабильна при воздействии небольших сил, но может смениться другой конформацией, если белок подвергнется достаточно сильному удару в результате теплового движения окружающих молекул. Для того, чтобы белок прошел через ряд нестабильных промежуточных конформаций, отделяющих одну квазистабильную конформацию от другой, требуется энергия. Чем выше этот энергетический барьер, тем реже осуществляется переход. Каналы будут очень редко принимать квазистабильные конформации с высокой энергией, обычно они находятся в низкоэнергетических состояниях. Если альтернативные конформации различаются распределением заряда, то при изменении электрического поля будут изменяться относительные энергии этих конформаций, а вместе с тем и вероятность принятия каналом той или иной конформации.
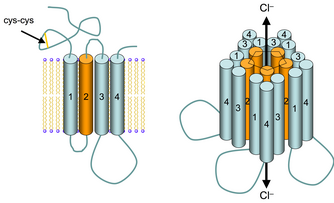
9.3. V-зависимые натриевые каналы
Структура Na+-канала была объектом интенсивных исследований и к настоящему времени хорошо известна (схематически показана на рис. 1 ). Это - массивный полипептид (1820 аминокислот), как показано на рис. 1.12, состоит из четырех последовательных гомологичных друг другу доменов, каждый из которых образует шесть трансмембранных спиралей. Четвертая из них (S4) в каждом домене содержит множество положительно заряженных аминокислотных остатков (особенно, аргинина и лизина), что и образует, как полагают, <сенсор потенциала>, чувствительный к изменениям потенциала на мембране. Предполагается, что между пятой (S5) и шестой (S6) трансмембранной спиралями в каждом домене полипептидной цепи формируется <шпилька> (Н5), входящая в мембрану. Если представить трехмерную форму белка как полого цилиндра, <шпилька> выстилает пору и обеспечивает ионную селективность. Наконец, внутриклеточный сегмент полипептида между гомологичными доменами III и IV ответственны за инактивацию канала.
Физиология Na+-канала также глубоко исследована. Показано, что, когда разность потенциала на мембране падает ниже определенного порога, канал открывается на прибл. 1 мс и пропускает ток порядка 2 пА. По прошествии 1 мс времени открывания канал закрывается и не откроется больше, пока мембрана остается деполяризованной. Инактивация, как говорилось выше, связана с сегментом полипептида между доменами III и IV, блокирующим канал. Таким образом, канал существует в трех основных конформациях: закрытой, открытой и инактивированной. Этот цикл показан на рис. 2 . Точное время открывания и закрытия канала точно непредсказуемо, иными словами - это стохастический процесс. Кроме того, каждый участок возбудимой мембраны обладает большой популяцией Na+-каналов, и порог открывания каждого из них несколько варьирует. По мере того, как возбудимая мембрана деполяризуется, открывается все больше Na+-каналов. Входящий поток ионов Na+ деполяризует и, в конце концов, даже реполяризует мембрану, образуя то, что электрофизиологи называют потенциалом действия (спайк).
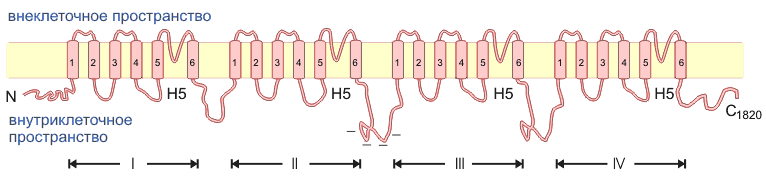
рис.1 Схема V зависимого натриевого канала
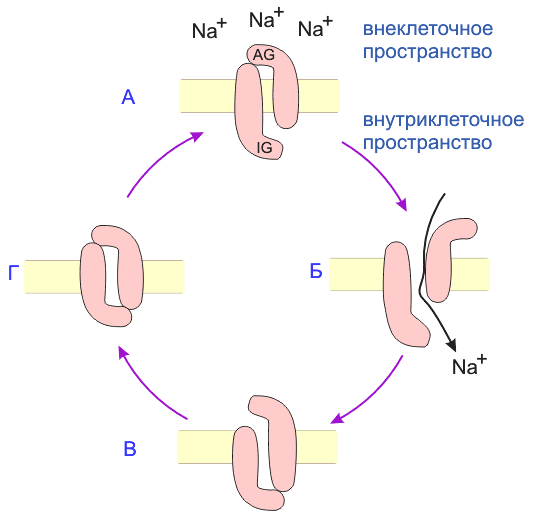
Рис.2 Цикл конформаций V-зависимого натриевого канала
(а) В покоящейся мембране натриевый канал закрыт. Активирующий воротный механизм (AG) закрыт, инактивирующий (IG) - открыт. (б) Когда мембрана деполяризуется, изменение потенциала детектируется "сенсором потенциала", и активирующий механизм открывается. Ионы натрия двигаются по электрохимическому градиенту. Они перепрыгивают с одного сайта в канале на другой (как показано на рисунке) и, таким образом, "двигаются колонной". (в) Через 1 мс инактивирующий механизм закрывается. (г) Когда мембрана возвращается к уровню потенциала покоя, активирующий механизм закрывается, а инактивирующий - открывается снова.
10. Общие принципы фармакологии боли
Последовательность действий при назначении обезболивающих препаратов:
1 Прежде всего, необходим тщательный сбор анамнеза и внимательный осмотр пациента с выяснением эффективности и длительности ранее принимаемых препаратов, наличия сопутствующих заболеваний и лекарственных осложнений. Необходимо определить ведущий периферический компонент боли (сухожильно-мышечный, нейрогенный и др.), выяснить присутствие психосоциальных и эмоционально-стрессовых предикторов хронизации болевого синдрома. Анализ полученных данных позволит выбрать основную, специфическую для этого пациента, лекарственную группу (НПВС, блокаторы натриевых или кальциевых каналов, ингибиторы обратного захвата моноаминов и др.) и составить схему лечения.
2 Во-вторых, следует соблюдать принцип последовательности в назначении болеутоляющих средств, что означает следующее:
• иметь в наличии несколько лекарственных средств, поддерживающих аналгезию,
• использовать адекватный период времени для оценки эффективности препарата (возможно несколько недель),
• применять комбинации препаратов,
• насколько возможно, ограничить их побочное действие.
3 В-третьих, необходимо применять лекарственные средства только как компонент комплексной терапии боли, т.е. сочетать их с физиотерапией, поведенческой терапией, блокадами и, возможно, нейрохирургическими методами.
11. Ионные каналы
Ио́нные кана́лы — порообразующие белки (одиночные либо целые комплексы), поддерживающие разность потенциалов, которая существует между внешней и внутренней сторонами клеточной мембраны всех живых клеток. Относятся к транспортным белкам. С их помощью ионы перемещаются согласно их электрохимическим градиентамсквозь мембрану. Такие комплексы представляют собой набор идентичных или гомологичных белков, плотно упакованных в липидном бислое мембраны вокруг водной поры. Каналы расположены в плазмалемме и некоторых внутренних мембранах клетки.
Через ионные каналы проходят ионы Na+ (натрия), K+ (калия), Cl− (хлора) и Ca2+ (кальция). Из-за открывания и закрывания ионных каналов меняется концентрация ионов по разные стороны мембраны и происходит сдвиг мембранного потенциала.
Канальные белки состоят из субъединиц, образующих структуру со сложной пространственной конфигурацией, в которой кроме поры обычно имеются молекулярные системы открытия, закрытия, избирательности, инактивации,рецепции и регуляции. Ионные каналы могут иметь несколько участков (сайтов) для связывания с управляющими веществами.
Согласно функциональной классификации, ионные каналы группируются по способам управления их состоянием на следующие виды:
- Неуправляемые (независимые).
- Потенциал-управляемые (потенциал-чувствительные, потенциал-зависимые, voltage-gated).
- Лиганд-управляемые (хемо-управляемые, хемочувствительные, хемозависимые, лиганд-зависимые, рецептор-активируемые).
- Опосредованно-управляемые (вторично-управляемые, ион-активируемые, ион-зависимые, мессенджер-управляемые, управляемые метаботропными рецепторами).
- Совместно-управляемые (NMDA-рецепторно-канальный комплекс). Они открываются одновременно как лигандами, так и определённым электрическим потенциалом мембраны. Можно сказать, что у них двойное управление. Пример: NMDA-рецепторно-канальный комплекс, имеющий сложную систему управления, включающую в себя 8 рецепторных участков-сайтов, с которыми могут связываться различные лиганды.
- Стимул-управляемые (механочувствительные, механосенситивные, активируемые растяжением (stretch) липидного бислоя, протон-активируемые, температурно-чувствительные).
- Актин-управляемые (актин-регулируемые, actin-regulated, actin-gated channels).
- Коннексоны (двойные поры).
Наиболее часто встречаются два типа каналов: ионные каналы с лиганд-зависимыми воротами (находятся, в частности, в постсинаптической мембране нервно-мышечных соединений) и ионные каналы с потенциал-зависимыми воротами. Лиганд-зависимые каналы превращают химические сигналы, приходящие к клетке, в электрические; они необходимы, в частности, для работы химических синапсов. Потенциал-зависимые каналы нужны для распространения потенциала действия.
Потенциал-зависимые ионные каналы
Эти каналы отвечают за распространение потенциала действия, они открываются и закрываются в ответ на изменение мембранного потенциала. Например, натриевые каналы. Если мембранный потенциал поддерживается на уровне потенциала покоя, натриевые каналы закрыты и натриевый ток отсутствует. Если мембранный потенциал сдвигается в положительную сторону, то натриевые каналы откроются, и в клетку начнут входить ионы натрия по градиенту концентрации. Через 0,5 мс после установления нового значения мембранного потенциала, этот натриевый ток достигнет максимума. А еще через несколько миллисекунд падает почти до 12. Во время покоя мембранного потенциала, внутриклеточная концентрация ионов натрия 12 ммоль/литр, а внеклеточная концентрация 145 ммоль/литр. Это значит, что каналы через некоторое время закрываются вследствие инактивации, даже если клеточная мембрана остается деполяризованной. Но закрывшись, они отличаются от состояния, в котором находились до открытия, теперь они не могут открываться в ответ на деполяризацию мембраны, то есть они инактивированны. В таком состоянии они останутся до тех пор, пока мембранный потенциал не вернется к исходному значению и не пройдет восстановительный период, занимающий несколько миллисекунд.
Лиганд-зависимые ионные каналы
Эти каналы открываются, когда медиатор, связываясь с их наружными рецепторными участками, меняет их конформацию. Открываясь, они впускают ионы, изменяя этим мембранный потенциал. Лиганд-зависимые каналы почти нечувствительны к изменению мембранного потенциала. Они генерируют электрический потенциал, сила которого зависит от количества медиатора, поступающего в синаптическую щель и времени, которое он там находится.
11.1. Лиганд чувствительные ионные каналы или ионнотропные рецепторы
классификация по структуре (строению) и происхождению от однотипных генов.
По этому принципу, например, выделяют три семейства лиганд-активируемых ионных каналов[1]:
- с пуриновыми рецепторами (АТФ-активируемые);
- с никотиновыми АХ-рецепторами, ГАМК-, глицин- и серотонин-рецепторами;
- с глутаматными рецепторами.
При этом в одно и то же семейство попадают ионные каналы с разной ионной селективностью, а также с рецепторами к разным лигандам. Но зато образующие эти каналы белки имеют большое сходство в строении и происхождении.
Ионные каналы также можно классифицировать по селективности в зависимости от проходящих через них ионов: натриевые, калиевые, кальциевые, хлорные,протонные (водородные).
Анионные хемочувсвительные каналы
|
Тип |
Класс |
IUPHAR-рекомендованное имя |
Ген |
Синонимы |
|
GABAA |
alpha |
EJM, ECA4 |
||
|
beta |
|
|||
|
gamma |
CAE2, ECA2, GEFSP3 |
|||
|
delta |
||||
|
epsilon |
||||
|
pi |
||||
|
theta |
||||
|
rho |
GABAC[7] |
|||
|
Glycine |
alpha |
STHE |
||
|
beta |
Катионные cys-петлевые рецепторы
|
Тип |
Класс |
IUPHAR-рекомендованное имя |
Ген |
Синонимы |
|
Serotonin |
5-HT3A |
|||
|
Nicotinic
acetylcholine |
alpha |
CHRNA1 |
ACHRA, ACHRD, CHRNA, CMS2A, FCCMS, SCCMS |
|
|
beta |
CMS2A, SCCMS, ACHRB, CHRNB, CMS1D |
|||
|
gamma |
ACHRG |
|||
|
delta |
ACHRD, CMS2A, FCCMS, SCCMS |
|||
|
epsilon |
ACHRE, CMS1D, CMS1E, CMS2A, FCCMS, SCCMS |
|||
|
ZAC |
ZAC1, L2m LGICZ, LGICZ1 |
Ионотропные рецепторы глутамата образуют тетрамеры с каждой субъединицей, состоящей из внеклеточного домена аминоконцевой (ATD, который участвует тетрамера в сборе), внеклеточный лиганд-связывающий домен (LBD, которая связывает глутамат) и трансмембранный домен (TMD, который образует ионный канал). Трансмембранный домен каждой субъединицы содержит три трансмембранных спирали, а также половину мембранной спирали с возвратной петлей. Структура белка начинается с ATD на N-конце, за которым следует первая половина LBD, которая пересекается спиралями 1,2 и 3 TMD перед продолжением заключительной половины LBD, а затем заканчивая спиралью 4 ТВД на с-конце. Это означает, что есть три связи между ТВД и внеклеточных доменов. Каждая субъединица тетрамер имеет сайт связывания для глутамата, образованного двумя LBD участками, образующими раскладную форму. Только две из этих сайтов в тетрамере должны быть заняты, чтобы открыть ионный канал. Пора в основном формируется половинной спирали 2 таким образом, который напоминает перевернутую калиевый канал.

|
Тип |
Класс |
IUPHAR-рекомендованное имя |
Ген |
Синонимы |
|
GluA |
GLUA1, GluR1, GluRA,
GluR-A, GluR-K1, HBGR1 |
|||
|
GluK |
GLUK5, GluR5, GluR-5,
EAA3 |
|||
|
GluN |
GLUN1, NMDA-R1, NR1,
GluRξ1 |
|||
|
GLUN2A, NMDA-R2A, NR2A,
GluRε1 |
||||
|
GLUN3A, NMDA-R3A,
NMDAR-L, chi-1 |
||||
|
‘Orphan’ |
(GluD) |
GluRδ1 |
||
АТФ-зависимые каналы открываются в ответ на связывание нуклеотида АТФ. Они образуют тримеры с двумя трансмембранных спиралей на субъединицу при этом C и N концы в цитозоле.
|
Тип |
Класс |
IUPHAR-recommended |
Ген |
Синонимы | |
|
N/A |
P2X1 |  |
12. Глутамат
Глутамат — наиболее распространенный возбуждающий нейротрансмиттер в нервной системе позвоночных. В химических синапсах глутамат запасается в пресинаптических пузырьках (везикулах). Нервный импульс запускает высвобождение глутамата из пресинаптического нейрона. На постсинаптическом нейроне глутамат связывается с постсинаптическими рецепторами, такими, как, например, NMDA-рецепторы, и активирует их. Благодаря участию последних в синаптической пластичности глутамат вовлечен в такие когнитивные функции, как обучение и память. Одна из форм синаптической пластичности, называемая долговременной потенциацией, имеет место в глутаматергических синапсах гиппокампа, неокортекса и в других частях головного мозга. Глутамат участвует не только в классическом проведении нервного импульса от нейрона к нейрону, но и в объемной нейротрансмиссии, когда сигнал передается в соседние синапсы путём суммации глутамата, высвобожденного в соседних синапсах (так называемая экстрасинаптическая или объемная нейротрансмиссия) В дополнение к этому, глутамат играет важную роль в регуляции конусов роста и синаптогенеза в процессе развития головного мозга, как это было описано Марком Мэтсоном.
Транспортёры глутамата обнаружены на нейрональных мембранах и мембранах нейроглии. Они быстро удаляют глутамат из внеклеточного пространства. При повреждении мозга или заболеваниях они могут работать в противоположном направлении, вследствие чего глутамат может накапливаться снаружи клетки. Этот процесс приводит к поступлению большого количества ионов кальция в клетку через каналы NMDA-рецепторов, что, в свою очередь, вызывает повреждение и даже гибель клетки — что получило название эксайтотоксичности. Механизмы клеточной смерти при этом включают:
повреждение митохондрий избыточно высоким внутриклеточным кальцием,
Glu/Ca2+-опосредованной промоцией факторов транскрипции проапоптотических генов или снижением транскрипции анти-апоптотических генов.
Эксайтотоксичность, обусловленная повышенным высвобождением глутамата или его сниженным обратным захватом, возникает при ишемическом каскаде и ассоциирована с инсультом, а также наблюдается при таких заболеваниях, как боковой амиотрофический склероз, латиризм, аутизм, некоторые формы умственной отсталости, болезнь Альцгеймера. В противоположность этому, снижение высвобождения глутамата наблюдается при классической фенилкетонурии, приводящей к нарушению экспрессии глутаматных рецепторов[8] Глутаминовая кислота участвует в реализации эпилептического припадка. Микроинъекция глутаминовой кислоты в нейроны вызывает спонтанную деполяризацию, и этот паттерн напоминает пароксизмальную деполяризацию во время судорог. Эти изменения в эпилептическом очаге приводят к открытию вольтаж-зависимых кальциевых каналов, что снова стимулирует выброс глутамата и дальнейшую деполяризацию. Роли глутаматной системы в настоящее время отводится большое место в патогенезе таких психических расстройств, как шизофрения и депрессия. Одной из наиболее активно изучаемых теорий этиопатогенеза шизофрении в настоящее время является гипотеза NMDA-рецепторной гипофункции: при применении антагонистов NMDA-рецепторов, таких, как фенциклиин, у здоровых добровольцев в эксперименте появляются симптомы шизофрении. В связи с этим предполагается, что гипофункция NMDA-рецепторов является одной из причин нарушений в дофаминергической передаче у больных шизофренией. Были также получены данные о том, что поражение NMDA-рецепторов иммунно-воспалительным механизмом («антиNMDA-рецепторный энцефалит») имеет клинику острой шизофрении. В этиопатогенезе эндогенной депрессии, считается, играет роль избыточная глутаматергическая нейротрансмиссия, подтверждением чему является эффективность диссоциативного анестетика кетамина при однократном применении при резистентной к лечению депрессии в эксперименте
12.1. NMDA-рецептор
NMDA-рецептор (NMDAR; НМДА-рецептор) — ионотропный рецептор глутамата, селективно связывающий N-метил-D-аспартат (NMDA).
Структурно NMDA-рецептор представляет собой гетеротетрамер двух субъединиц — NR1 и NR2. В неактивированной форме канал рецептора закрыт ионом магния.
Ион магния удаляется при деполяризации постсинаптической мембраны, на которой находится рецептор. Одновременно с этим для функционирования рецептора должен поступить в синаптическую щель глутамат. Такая активация рецептора вызывает открытие ионного канала, селективного к катионам, что ведёт к притоку в клетку Na+ и, в небольшом объёме, Ca+2, а K+ покидает клетку. Ионы кальция, вошедшие через канал, активируют протеинкиназу CaMK-II. Происходит её аутофосфорилирование и фосфорилирование ряда белков нейрона-реципиента.
Этот процесс играет ключевую роль в синаптической пластичности, а следовательно и в процессах обучения и памяти. В отличие от других рецепторов, NMDAR одновременно восприимчив к эндогенным лигандам-агонистам иантагонистам и к изменению мембранного потенциала (англ. voltage-dependent).
Альтернативный сплайсинг порождает множественные изоформы NR1, что вкупе с неоднородной экспрессией NR2 обусловливает различную структуру рецепторов в разных областях нервной системы.
В период эмбрионального и постнатального развития мозга отмечается изменение конструкции рецептора, в нём снижается число субъединиц NR2B, NR2D, NR3A, растёт число единиц NR2A и NR2C. Эти изменения различаются в разных областях мозга и подтипах нейронов, и происходят под действием разных факторов: так, в гранулярных клетках мозжечка замена NR2B на NR2C предположительно происходит под воздействием нейрегулинов. Множество работ посвящено возрастной смене преобладания NR2B на NR2A при созревании возбуждающих синапсов. Возможно, это изменение связано с действием рилина
13. ГАМК
γ-Аминомасляная кислота (ГАМК, GABA) — аминокислота, важнейший тормозной нейромедиатор центральной нервной системы человека и других млекопитающих. Аминомасляная кислота является биогенным веществом. Содержится в ЦНС и принимает участие в нейромедиаторных и метаболических процессах в мозге
Биологическая роль
γ-Аминомасляная кислота выполняет в организме функцию ингибирующего медиатора центральной нервной системы. При выбросе ГАМК в синаптическую щель происходит активация ионных каналов ГАМКA- и ГАМКC-рецепторов, приводящая к ингибированию нервного импульса. Лиганды рецепторов ГАМК рассматриваются как потенциальные средства для лечения различных расстройств психики и центральной нервной системы, к которым относятся болезни Паркинсона и Альцгеймера, расстройства сна (бессонница, нарколепсия), эпилепсия.
Установлено, что ГАМК является основным нейромедиатором, участвующим в процессах центрального торможения.
Под влиянием ГАМК активируются также энергетические процессы мозга, повышается дыхательная активность тканей, улучшается утилизация мозгом глюкозы, улучшается кровоснабжение.
Действие ГАМК в ЦНС осуществляется путём её взаимодействия со специфическими ГАМКергическими рецепторами, которые в последнее время подразделяют на ГАМК-А- и ГАМК-Б-рецепторы и др. В механизме действия целого ряда центральных нейротропных веществ (снотворных, противосудорожных, судорожных и др.) существенную роль играет их агонистическое или антагонистическое взаимодействие с ГАМК-рецепторами. Бензодиазепины потенцируют действие ГАМК.
Наличие ГАМК в ЦНС было обнаружено в середине 50-х годов, в 1963 г. осуществлен её синтез (Krnjević K., Phillis J. W.). В конце 60-х годов под названием «Гаммалон» ГАМК была предложена для применения в качестве лекарственного средства за рубежом, затем — под названием «Аминалон» — в России.
По экспериментальным данным, ГАМК при введении в организм плохо проникает через гематоэнцефалический барьер, однако есть свидетельства того, что ГАМК транспортируется в мозг с помощью специфических мембранных транспортеров GAT2 и BGT-1 (PMID: 1159850).
13.1. ГАМК А рецептор
Рецептор ГАМКA
ГАМКА-рецептор — лиганд-зависимый ионный канал в химических синапсах нервной системы, который тормозит передачу нервного возбуждения и управляется с помощью ГАМК (основного нейротрансмиттера мозга). Это, наряду сГАМКС-рецептором, один из двух ионотропных ГАМК-рецепторов, отвечающий за реакцию организма на гамма-аминомасляную кислоту. Помимо места, связывающего ГАМК, рецепторный комплекс содержит аллостерические сегменты, способные связывать бензодиазепины, барбитураты, этанол, фуросемид, нейростероиды и пикротоксин.
Морфология
Ионотропные ГАМКА-рецепторы впервые были выделены из бычьего мозга в 1987 году, и их структура тогда была определена как состоящая из двух субъединиц. Но позже, благодаря методикам молекулярного клонированиябыло выделено большое количество разных субъединиц, которые могут входить в состав этого рецептора. Перечень субъединиц включает семь различных семей, многие из которых насчитывают более чем один вид белка. Это семьи, α (6 изоформ), β (три изоформы), γ (три изоформы), а также δ, ε, π и θ (одна изоформа в каждой). Гомология (сходство) в последовательностях аминокислот между изоформами одной семьи достигает по меньшей мере 70 %, в то время как между представителями разных семей — меньше чем 40 %; подробнее о свойствах рецепторов, которые образуются различными комбинациями субъединиц, см. в таблице 1.
Каждый функционирующий ГАМКА-рецептор представляет собой гетеропентамер, где все пять субъединиц имеют одинаковую третичную структуру. Эта структура состоит в наличии большого N-терминального домена, характеристическим признаком которого для этого типа рецепторов является дисульфидный мостик между двумя остатками цистеина (так называемая «cys-cys-петля») — черта, присущая всем ионно-канальным рецепторам. Также на N-терминальном домене находятся многочисленные места связывания различных лигандов и участок, который активирует рецептор при связывании с ним молекул ГАМК.
За N-терминальным доменом идут четыре трансмембранных домена (ТМ1-4), среди которых ТМ2 вводит внутреннюю выстилку просвета ионного канала. Между доменами ТМ3 и ТМ4 находится большой внутриклеточный регион, который содержит сегменты, применяемые для фосфорилирования с помощью протеин-киназ, а также места присоединения многочисленных фиксирующих и проводящих протеинов. За доменом ТМ4 расположен очень короткий С-терминал. В целом, количество аминокислотных остатков, которые составляют третичную структуру одной субъединицы, равно примерно 400.
Большое количество типов субъединиц ГАМКА-рецептора (всего 16) приводит к большому количеству структурно отличных ГАМКА-рецепторов, которые могут быть теоретически ими сформированы. Но практически in vivoуровень многообразия функциональных ГАМКА-рецепторов является намного меньшим. Благодаря комплексным молекулярно-биологическим исследованиям было установлено, какие именно комбинации субъединиц могут формировать функциональные ГАМКА-рецепторы — см. Таблицу 1. При этом надо заметить, что не все искусственно синтезированные нормально функционирующие формы рецепторов, приведенные в таблице, в настоящее время найдены в мозге.
Функциональные свойства
Исследования рекомбинантных ГАМКА-рецепторов показали, что функциональные свойства ГАМКА-рецепторов во многом определяются составом субъединиц рецептора. В целом, доказанными могут считаться следующие закономерности:
- Отсутствие β-субъединицы в составе рецептора заметно уменьшает или даже полностью блокирует чувствительность к ГАМК;
- Создание комбинаций α-β увеличивает чувствительность к ГАМК, но полученные таким образом каналы имеют относительно низкую проводимость (12-18 pS). Также эти рецепторы нечувствительны к бенздиазепинам и могут быть ингибированы с помощью низких концентраций Zn2+ (~100-200 нМ);
- Привлечение γ-субъединицы, что приводит к формированию комбинаций α-β-γ, незначительно снижает чувствительность ГАМК сравнению с α-β-рецепторами; также таким рецепторам присуща аллостерическая модуляция бенздиазепинами и заметно меньшая чувствительность к ионам Zn2+ (Около 200—500 μМ). Проводимость ионного канала у рецепторов с таким составом субъединиц примерно на 30 % выше (28-31 pS), чем у форм α-β. Наличие субъединицы γ2, кроме того, стимулирует формирование кластеров (тесных групп) рецепторов на постсинаптической мембране химических синапсов.
Место связывания ГАМК
В настоящее время считается, что в состав сегмента связывания ГАМК на ГАМКА-рецепторе входят аминокислотные остатки как от α-, так и β-субъединицы. При этом в составе β-субъединицы для формирования участка связывания ГАМК критическими являются два домена, содержащие аминокислоты YGYT (однобуквенный код, см. статью «аминокислота») — остатки 157—160 субъединицы β2 (здесь и далее буква обозначает однобуквенный код аминокислоты, цифра — номер остатка в цепи молекулы, начиная с N-конца); и, также,YGSY — остатки 202—205. Однако, согласно некоторым теориям, последний домен может быть ассоциирован с механизмом конформационной передачи в процессе открытия ионного канала, а не собственно с участком связывания ГАМК. Перечисленные выше остатки взаимодействуют с остатками F64, R66, S68, R120 субъединицы α1 — таким образом, сегмент связывания ГАМК сформирован на поверхности контакта α- и α-субъединиц.
Аллостерическая модуляция: бензодиазепиновый участок
Исследования рекомбинантных рецепторов показали, что одновременное наличие α- и γ-субъединиц является необходимым для возможности аллостерического регулирования[en] ГАМКА-рецептора с помощьюбензодиазепинов. При этом были идентифицированы несколько критически важных аминокислотных остатков —Н101 у α1-субъединицы и F77 γ2-субъединицы — которые влияют на активность связывания.
Кроме того, важную роль играет остаток Т142 у субъединицы γ2, который влияет на эффективность бензодиазепинов. Интересно, что остаток F77 у субъединицы γ2 гомологичен F64 субъединицы α1, что имеет активное влияние на эффект ГАМК. Таким образом, сегмент связывания бензодиазепинов, локализованный на поверхности между субъединицами α и γ, возможно, эволюционно возник из участка связывания агониста (то есть ГАМК).
Набор субъединиц, который формирует нативный рецептор, особенно что касается различных изоформ γ и α субъединиц, может оказывать влияние и на фармакологию бенздиазепинов. Лиганды бенздиазепинового ряда могут действовать как частичные или полные агонисты, потенцирующие действие ГАМК; как антагонисты, которые не имеют никакого влияния на действие ГАМК, но предотвращают действие агонистов-бензодиазепинов; и как частичные или полные обратные агонисты, которые ингибируют активацию рецептора с помощью ГАМК, действуя на бенздиазепиновый участок. Эффекты обратных агонистов могут быть ингибированы антагонистами бензодиазепинового ряда. Рецепторы, которые включают α1- и βіγ2 субъединицы (где i=1-3), имеют высокое родство к бензодиазепинам, диазепаму, CL218872, изолпидему (часто называются рецепторами или лигандами первого типа). CL218872 и золпидем имеют гораздо более низкое сродство с рецепторами, содержащими α2-α3 и α5βіγ2 субъединицы (рецепторы второго типа). Следующая группа рецепторов, α4- и α6βіγ2 — рецепторы, является диазепам-нечувствительной, но способной связывать частичный обратный агонист, Ro-15-4513. В субъединицах α4 и α6 отсутствует критически важный для α1 аминокислотный остаток Н101, который заменен наагринин. Такие диазепам-чувствительные рецепторы называются рецепторами третьего типа.
β-субъединицы и ионный канал
β-субъединицы рецептора сначала считались фармакологически пассивными; тем не менее, недавние исследования показали, что их наличие в составе нативного рецептора является критически необходимым условием для его функционирования, а различные конформации β-субъединиц могут влиять на эффект лигандов, которые с этими субъединицами непосредственно не связаны (например, на эффекты лореклезола). Во всех известных на настоящее время случаях воздействия на эффекты лигандов ГАМКA-рецептора со стороны его β-субъединиц разница в рецепторном ответе обусловлена мутациями (то есть заменами) одного и того же аминокислотного остатка — на позиции 290 в сегменте ТМ2. В случае β1-субъединицы это место занимает серин, и эффект лореклезола при этом не меняется или ингибируется; в случае β2-субъединицы на этом месте находится аспарагин, который заметно потенцирует (увеличивает) эффект лореклезола и ряда других соединений.
Другой остаток, который сильно влияет на чувствительность αβ-вмещающих ГАМКA-рецепторов — это Н267, который находится на внешней части домена ТМ2. Этот остаток гистидина формирует часть сегмента связывания Zn2+, делая рецептор чувствительным к ингибированию ионами цинка в концентрации около 100 нМ. Локализация этого аминокислотного остатка внутри хлорного канала рецептора и тот факт, что двувалентный катион цинка может проникать в канал, приспособленный для прохождения одновалентных анионов, независимо от того, активирован рецептор или нет, являются признаками локализации ион-селектирующей части рецепторной молекулы и механизма открытия канала на противоположном конце рецептора.
Таблицы
- Таблица 1. Формы ГАМКA-рецепторов, найденные в нервной системе
| Комбинация субъединиц | Распространение и свойства |
| α1βγ2 | Самая обыкновенная изоформа, ~40% всех ГАМКА-рецепторов; широко распространена в химических синапсах нервной системы. |
| α2βγ2 | Довольно обычная, также широко распространена. |
| α3βγ2 | Не такая обычная, как две предыдущие, широко распространена. |
| α4βγ2/δ | Относительно редкая, найдена в гиппокампе и таламусе. Возможно, является внесинаптическим рецептором. |
| α5βγ2 | Относительно редкая, найдена в гиппокампе. |
| α6βγ2/δ | Найдена лишь в гранулярном слое мозжечка и в нервных клетках улитке уха. Возможно, является внесинаптическим рецептором. |
| α1α2-6βγ2 | Рецепторы, которые содержат две разные формы α-субъединицы, вероятно, являются очень редкими, если вообще такая комбинация способна формировать функциональный рецептор. Об их существовании можно утверждать, основываясь на результатах иммунных реакций с использованием селективных сывороток. |
| α2α3-6βγ2 | Относительно редкая, если вообще способна формировать функциональные рецепторы. |
| α3α4-6βγ2 | Относительно редкая, если вообще способна формировать функциональные рецепторы. |
- Таблица 2. Свойства ГАМКA-рецепторов
| Природный агонист | ГАМК |
| Селективный агонист | Изогувацин |
| Антагонист | Пикротоксин |
| Селективный антагонист | Бикукуллин |
| Модуляторы: бенздиазепины | Потенцирование |
| Барбитураты | Потенцирование |
| Zn2+ (IC50) | Ингибирование (αβ — 100-500nM; αβγ — 100-500mM) |
| Нейростероиды | Потенцирование/ингибирование |
| Эффективность ГАМК (ЕС50) | 2-30μM |
| Ионы, проходящие через канал | Cl- та НСО3- |
| Активация рецептора | Быстрая (миллисекунды) |
| Десенситизация | Быстрая и глубокая |
| Проводимость канала | 25-32pS |
Субъединицы ГАМК-А рецептора человека
Существуют следующие субъединицы[1]:
- Шесть α субъединиц (GABRA1, GABRA2, GABRA3, GABRA4, GABRA5, GABRA6)
- Три β субъединицы (GABRB1, GABRB2, GABRB3)
- Три γ субъединицы (GABRG1, GABRG2, GABRG3)
- δ-субъединица (GABRD), ε-субъединица (GABRE), π-субъединица (GABRP), θ-субъединица (GABRQ)
Примечания
- ↑ Martin IL and Dunn SMJ. GABA receptors A review of GABA and the receptors to which it binds. Tocris Cookson LTD.
Литература
- Bormann J (2000): The «ABC» of GABA receptors. Trends Pharmacol Sci 21:16-19.
- Feigenspan A, Wassle H, Bormann J (1993): Pharmacology of GABA receptor Cl- channels in rat retinal bipolar cells. Nature 361:159-162.
- Fritschy J-M, Mohler H (1995): GABAA receptor heterogeneity in the adult rat brain: differential regional and cellular distribution of seven major subunits. J Comp Neurol359:154-194.
- Hosie AM, Aronstein K, Sattelle DB, Ffrench-Constant RH (1997): Molecular biology of insect neuronal GABA receptors. Trends Neurosci. 20:578-583.
- Jones A, Korpi ER, McKernan RM, Pelz R, et al. (1997): Ligand-gated ion channel subunit partnerships: GABAA receptor 6 subunit gene inactivation inhibits delta subunit expression. J Neurosci 17:1350-1362.
- Korpi ER, Grunder G, Luddens H (2002): Drug interactions at GABAA receptors. Prog Neurobiol 67:113-159.
- Moss SJ, Smart TG (1996): Modulation of amino acid-gated ion channels by protein phosphorylation. Int Rev Neurobiol 39:1-52.
- Rabow LE, Russek SJ, Farb DH (1996): From ion currents to genomic analysis: Recent advances in GABAA receptor research. Synapse 21:189-274.
- Rudolph U, Crestani F, Benke D, Brunig I, et al. (1999): Benzodiazepine actions mediated by specific γ-aminobutyric acid (A) receptor subtypes. Nature 401:796-800.
- Smith GB, Olsen RW (1995): Functional domains of GABAA receptors. Trends Pharmacol Sci 16:162-168.
- Whiting PJ, McKernan RM, Wafford KA (1995): Structure and pharmacology of vertebrate GABAA receptor subtypes. Int Rev Neurobiol 38:95-138.
13.2. ГАМК С рецептор
ГАМКC-рецептор — ионотропный рецептор γ-аминомасляной кислоты, связанный с хлоридным каналом. При активации рецептора молекулами ГАМК начинается транспорт ионов хлора во внутриклеточное пространство, который приводит к ингибированию нервного импульса.
Строение рецептора
ГАМКC-рецептор относится к никотиноидному подсемейству лиганд-зависимых ионных каналов (ЛЗИК). ЛЗИК передают нервный импульс с помощью прямого транспорта ионов K+, Na+, Ca2+, Cl− через мембрану. Ионы транспортируются через канал, открытие которого регулируется различными нейротрансмиттерами, такими, как ацетилхолин, глицин, серотонин или ГАМК. Помимо ГАМКC-рецептора, к никотиноидному подсемейству относятся также никотиновый ацетилхолиновый рецептор(nAChR), серотониновый рецептор 5-HT3, ГАМКA-рецептор, стрихнин-чувствительный глициновый рецептор. Важно также упомянуть ацетилхолин-связывающий белок, который отсутствует у человека. Этот транспортный белок является структурным гомологом лиганд-связывающих доменов всех рецепторов никотиноидного подсемейства. К другим подсемействам семейства ЛЗИК относятся глутаматные рецепторы и рецепторы АТФ.
Различные рецепторы никотиноидного подсемейства ЛЗИК структурно сходны. Они представляют собой пентамеры, собранные из родственных друг другу субъединиц. Возможно, что эти субъединицы имеют эволюционное родство. Каждая субъединица состоит из большого внеклеточного N-концевого домена, четырёх трансмембранных доменов (М1-4) и вариабельной внутриклеточной петли между третьим и четвёртым трансмембранными доменами. Цепь укладывается таким образом, что стенка поры канала образована вторым трансмембранным доменом М2. Таким образом, суммарный заряд боковых цепей аминокислот М2-домена, обращённых в канал, определяет, будет ли канал пропускать катионы или анионы. Внутриклеточная петля служит для прикрепления рецептора к цитоскелету, а также является мишенью некоторых модуляторов данного подкласса рецепторов. Внеклеточный домен содержит сайт связывания лиганда. ГАМКС-рецепторы состоят из ρ-субъединиц. На основании филогенетического родства среди них выделяют три подтипа (ρ1-3). В геноме человека найдены гены всех трёх подтипов, однако клонированы и экспрессированы in vitro лишь ρ1 и ρ2. Отличительной особенностью ρ-субъединиц является их способность к образованию гомомерных рецепторов при экспрессии in vitro, в то время как у субъединиц ГАМКA рецептора (α, β, γ, δ, ε) такая способность выражена в малой степени. Кроме того, ρ1- и ρ2- субъединицы могут совместно образовывать псевдогетеропентамеры различного состава. Имеются сведения об образовании комплексов между γ2 и ρ2-субъединицами. Тем не менее, на сегодняшний день наиболее изученными среди ГАМКС-рецепторов являются гомопентамерные рецепторы подтипа ρ1. Гораздо меньше информации имеется относительно фармакологии ρ2-рецепторов. О ГАМКС-рецепторах других подтипов имеются лишь отдельные сведения.
Важнейшее отличие между рецепторами ГАМКA и ГАМКС состоит в следующем: в то время как ГАМКA-рецептор быстро активируется и так же быстро десенситизируется, ГАМКС-рецептор активируется медленно, но значительно менее склонен к десенситизации. В то же время активация ГАМКС-рецептора происходит при значительно меньших концентрациях ГАМК, чем в случае ГАМКA рецептора. С этим связаны различия в фармакологическом профиле рецепторов.
Фармакология рецептора
ГАМКС-рецепторы экспрессируются в различных областях мозга. Они обнаружены в сетчатке, зрительных путях, таламусе, гиппокампе и некоторых других отделах мозга. ГАМКС-рецепторы расположены в глубинных слоях сетчатки и опосредуют взаимодействие соседних светочувствительных клеток. Благодаря этому, в частности, они отвечают за повышение чёткости границ зрительного образа. При селективном блокировании ГАМКС-рецепторов повышается возбудимость клеток сетчатки, расположенных рядом с теми, которые непосредственно подвержены воздействию светового сигнала. За счёт этого образы становятся более расплывчатыми, чёткость зрения понижается. Однако связь этого эффекта с какими-либо заболеваниями зрительного аппарата недостаточно изучена. Очевидной причиной этого является отсутствие инструментов для данного исследования — высокоселективных лигандов ГАМКС-рецепторов, поскольку в сетчатке также обильно экспрессированы ГАМКA-рецепторы, а также рецепторы глутаматэргической системы, обладающие действием, противоположным действию рецепторов ГАМК. ГАМКС-рецепторы, локализованные в таламусе, гиппокампе и других областях мозга, отвечают за процессы, связанные с регуляцией сна и памятью.
Основным инструментом исследования в данном случае является селективный антагонист рецептора 1,2,5,6-тетрагидропирид-4-илметилфосфиновая кислота (TPMPA). Её вводят путём инъекции непосредственно в четвёртый желудочек мозга, поскольку это вещество плохо проникает через гематоэнцефалический барьер, что заставляет исследователей искать более липофильные аналоги этого вещества, смиряясь с их низкой селективностью.
Примером такого вещества является CGP36742, антагонист ГАМКB и ГАМКС-рецепторов. При исследовании влияния TPMPA на память были выявлены заметные улучшения памяти и обучаемости крыс и цыплят — снижение времени обучения и более надёжное запоминание выученного. Воздействие CGP36742 снижает возрастной дефицит памяти у крыс и усиливает когнитивные способности обезьян. Этот эффект не связан с ГАМКB-рецепторами, поскольку другие антагонисты этих рецепторов таким действием не обладают. При исследовании влияния TPMPA на сон было обнаружено, что при применении этого вещества увеличивается продолжительность бодрствования крыс, при этом продолжительность как медленной, так и парадоксальной фазы сна снижается. Кроме того, TPMPA ингибирует апоптоз нейронов гиппокампа, индуцированный аммиаком, и регулирует выброс гормонов в толстом кишечнике.
Лиганды рецептора
Антагонисты ГАМКС-рецептора усиливают когнитивные способности мозга и стимулируют память. Главная проблема при исследовании рецепторов ГАМК и, в частности, ГАМКС-рецептора — отсутствие лигандов, сочетающих в себе селективность по отношению к конкретному подтипу рецепторов и высокую активность
13.3. ГАМК В рецептор
Рецептор ГАМК-B
ГАМКB-рецептор (GABABR) — метаботропный трансмембранный G-белок-связанный подтип ГАМК-рецепторов, воздействующий через G-белки на калиевые ионные каналы клетки. Рецептор был открыт в 1981 году благодаря детальному фармакологическому анализу эффектов ГАМК в мозгу. Встречается во всех отделах вегетативной нервной системы ицентральной нервной системы. Существует версия, что опьянение объясняется активацией этанолом ГАМКB2 рецептора.
Строение[править | править вики-текст]
Структурно ГАМКB-рецептор входит в одно суперсемейство с метаботропными рецепторами глутамата. Две субъединицы, R1 и R2, судя по всему, образуютгетеродимеры, сцепляясь внутриклеточными С-концами. Первичная структура субъединиц схожа на 35 %. Каждая из субъединиц ГАМКB-рецептора имеет большой внеклеточный N-конец, за которым последовательно расположены семь трансмембранных доменов и внутриклеточный С-конец, который отвечает за гетеродимеризацию. Рецептор становится полностью функциональным только после гетеродимеризации. Более того, если указанные субъединицы экспрессируются раздельно, R1 неспособна достичь внешней клеточной мембраны, оставаясь на эндоплазматическом ретикулуме, но R2 неспособна связывать ГАМК. Несмотря на открытый полностью функциональный С-домен одиночной субъединицы R2, до сих пор не было получено свидетельств о возможности её сочетания со свободными субъединицами других аналогичных GPCR-рецепторов.
Механизм связывания с лигандом
Всем представителям данного класса GPCR-рецепторов присущ сходный механизм активации, который известен под названием «Модель венериной мухоловки». Построенные функциональные модели этой структуры предполагают, что лиганд попадает к N-концевому участку сайта связывания на субъединице R1, проходя между двух больших лопастей, способных к вращению благодаря специальному «шарнирному» участку (см. рисунок)
После того как агонист попадает в щель между подвижными частями субъединиц R1, эти части смыкаются и блокируют его. Аналогичная блокирующая структура «венериной мухоловки» присутствует и в R2-субъединице, но при этом у данной субъединицы отсутствуют аминокислотные остатки, необходимые для формирования места связывания агониста и/или антагониста. Возможно, субъединица R2 может быть активированной ещё не идентифицированным агонистом (неизвестно, эндогенным или экзогенным) — но несмотря на все опыты, такое активирующее вещество (агонист) до сих пор не найдено.
Функции[править | править вики-текст]
Благодаря активации ГАМКB-рецептора осуществляется регулирование нескольких комплексных процессов внутри нервной системы: сюда входит ингибирование аденилатциклазы; редукция агонист-стимулированного синтеза инозитол-1,4,5-трифосфат; ингибирование потенциал-зависимых Са2+-каналов, а также, по последним данным, активация К+-каналов. Передача эффекта с ГАМКB-рецепторов на аденилатциклазы осуществляется комплексом G-белков, а именно субъединицами Gαi и Gαo. Агонист-зависимое G-белковое связывание обеспечивается благодаря взаимодействию с одним (или более) внутриклеточным доменом субъединицы R2, как обычно полагают, второй и третьей внутриклеточными петлями (но все данные в пользу этого, пока, есть лишь косвенные). Калиевые каналы, действие которых регулируется ГАМКB-рецепторами, испытывают в данном случае воздействия через активацию βγ-комплекса G-белков (Gβγ). Этот же самый G-белковый комплекс функционально объединяет ГАМКB-рецепторы с пресинаптическими кальциевыми каналами N-, Р- и Т-типа. Это препятствует выделениюнейромедиатора в синаптическую щель. Таким образом ГАМКB-рецептор является рецептором, тормозящим нейрон.
Локализация
С помощью иммуногистохимических методов достоверно установлено, что как субъединица R1, так и субъединица R2 коэкспрессируются (то есть синтезируются совместно) практически во всех регионах мозга, хотя в распределении функциональных субъединиц наблюдаются некоторые различия. Например, субъединицы типа R1а преобладают в гипоталамусе, зрительной коре, стволе головного мозга и в гранулярном слое коры мозжечка. В то же время субъединицы типа R1b могут быть найдены в приповерхностных слоях коры больших полушарий, в спинном мозге и в молекулярном слое коры мозжечка.
Субъединица R2 найдена практически везде: в гиппокампе, коре больших полушарий, в клетках Пуркинье мозжечка и в спинном мозге — в соответствии с тем, что ГАМКB-рецепторы везде представлены гетеродимерами. Тем не менее, в некоторых пробах в опыте экспрессировалась только одна субъединица рецептора при отсутствии R2. R1-субъединица рецептора не может формировать функциональный рецептор; но, возможно, другие, ещё не идентифицированы субъединицы ГАМКB-рецептора могут связываться с ней при отсутствии R2 и формировать функционирующую рецепторную структуру.
Локализация ГАМКB-рецепторов в отдельном нейроне преимущественно внесинаптическая (за пределами синаптических структур). Это является признаком выполнения ингибиторной роли этими рецепторами только при очень интенсивном высвобождении ГАМК, когда она диффундирует за пределы синаптических щелей; также это хорошо согласуется с назначением ГАМКB-рецепторов, как одного из механизмов долговременной медленной модуляции синаптического ингибирования.
Лиганды
Агонисты[править | править вики-текст]
Модуляторы ГАМКb-рецепторов
- CGP-7930
- BHFF
- BHF-177
- BSPP
- GS-39783
Антагонисты
- Фенилэтиламин
- Факлофен
- Саклофен
- SCH-50911
- CGP-52432
- CGP-55845
- SGS-742
14. Нейропептиды
Нейропепти́ды — пептиды (разновидность молекул белка), образующиеся в центральной или периферической нервной системе и регулирующие физиологическиефункции организма человека и животных.
Структура
Нейропептиды содержат от 2 до 50-60 аминокислотных остатков. Более крупные полипептиды со схожей функцией относят к регуляторным белкам. Большинство нейропептидов имеет линейную структуру, но встречаются среди них и кольцевые молекулы (например, соматостатин). Циклизация осуществляется путём образования дисульфидных связей между остатками цистеина, находящихся на разных концах пептида.
Синтез
Вначале на рибосомах синтезируются более длинные полипептидные цепи — предшественники. Они обязательно начинаются с сигнальной последовательности, которая необходима для проникновения полипептида во внутреннее пространство эндоплазматической сети. Далее белки-предшественники транспортируются в мембранных пузырьках к нервным окончаниям и расщепляются протеазами в определенных местах.
Нередко при этом высвобождается сразу несколько активных пептидов. В промежуточной доле гипофиза при расщеплении единого белка-предшественникапроопиомеланокортина образуются, в зависимости от способа протеолиза,
- типичные гормоны (МСГ, липотропин и АКТГ), которые являются также нейромодуляторами;
- пептиды с исключительно нейромодуляторной функцией (эндорфины и близкий им мет-энкефалин).
Готовые нейромодуляторы выделяются в синаптическую щель или окружающее межклеточное пространство. В синаптической щели и в нервных окончаниях нейропептиды могут подвергаться дальнейшему протеолизу. Часто при этом образуются новые нейропетиды — с похожей или даже совсем иной активностью. Например, при протеолизе β-липотропина могут появляться МСГ, мет-энкефалин и разные эндорфины, а при протеолизе β-эндорфина α- и γ-эндорфины.
Действие
Несмотря на возможность протеолиза, нейропептиды, в отличие от типичных нейромедиаторов, существуют в организме относительно долго (часы). Это позволяет им достигать достаточно удаленных синапсов и длительное время оказывать на них своё действие. При этом нередко на одну и ту же мишень действуют сразу несколько нейропептидов, а один и тот же нейропептид — сразу на несколько мишеней. Благодаря этому могут создаваться различные комбинации модуляторов и клеток мишеней. Каждой комбинации соответствует определенное функциональное состояние нервной системы и организма в целом. Причем, в силу многочисленности нейропептидов, все эти состояния образуют как бы непрерывное множество - так называемый функциональный континуум, где одно состояние плавно переходит в другое. В этом, как считают, и состоит биологический смысл существования такого большого количества нейромодуляторов.
Классификация
По своей функции, месту синтеза и структуре все нейропептиды, включая медиаторы и гормоны, подразделяются на 18 семейств. В некоторых из этих семейств по 20-30 различных нейропептидов. Эти вещества отнесены к нейропептидам потому, что все они образуются также определенными нейронами головного мозга или (как эндорфины) в гипофизе. И, выступая затем в качестве нейромодуляторов, оказывают то или иное нейротропное или даже психотропное действие.
Примеры
Эффекты некоторых нейропептидов на нервную деятельность приведены в таблице.
| Природа | Действие | |
|---|---|---|
| мет-Энкефалин | 5 остатков аминокислот | Кратковременное обезболивающее действие |
| β-эндорфин | 30 остатков АК |
|
| γ-эндорфины | Первые 17 остатков β-эндорфина | Нейролептическое действие (торможение эмоциональной сферы). Обезболивающий эффект выражен слабо. |
| α-эндорфин | Первые 16 остатков β-эндорфина | Психостимулирующее:
|
Всего в данном семействе — свыше 30 пептидов. В организме могут также образовываться и непептидные опиоиды (то есть вещества. действующие на опиоидные рецепторы): сальсолинол и карболины (особенно при алкоголизме), и даже классические наркотические средства (кодеин и морфин), причем вне связи с употреблением наркотиков. Место синтеза этих веществ пока не известно.
Представители других семейств
| Природа | Действие | |
|---|---|---|
| Вазопрессин | Циклические нонапептиды | Способствует формированию долгосрочной памяти |
| Окситоцин | Циклические нонапептиды | Умеренно препятствует формированию долгосрочной памяти |
| Холецисто-кинин-8 | Декапептид | Очень мощный ингибитор пищедобывательного поведения |
| Нейротензин | 13 остатков АК | Подобно анальгину, вызывает эффекты: обезболивающий (не через опиатные рецепторы), гипотермический и гипотензивный |
| Эндозепин-6 | Гексапептид | Ингибирует ГАМКА — рецепторы. Вызывает беспокойство и проконфликтное поведение |
| Пептид дельта сна | Не входит ни в одно из 18 семейств | Сильный снотворный эффект, облегчение стрессовых состояний |
Рецепторы
Для каждого нейромодулятора на плазматической мембране клеток-мишеней имеются рецепторы. В случае эндозепинов рецептором является часть ГАМКА- рецептора; при этом связывание эндозепина блокирует связывание ГАМК и последующее открытие каналов для ионов Cl-.
Рецепторы эндорфинов (опиоидные рецепторы) также не отличаются абсолютной специфичностью: кроме соответствующих неиропептидов, с ними могут связываться наркотические вещества (морфин, кодеин и прочие непептидные опиоиды). Об этом свидетельствует само название данных рецепторов. Опиоидные рецепторы прочно встроены в плазмалемму и контактируют с определенным трансмиттерным белком, передающим сигнал на внутреннюю поверхность плазмалеммы. Иными словами, механизм действия эндорфинов соответствует той же схеме, по которой действует подавляющее большинство гидрофильных сигнальных молекул. То же, видимо, можно сказать и о прочих нейромодуляторах[1].
Примечания
- ↑ Н. Н. Мушкамбаров, С. Л. Кузнецов Молекулярная биология, М. 2008
15. Опиоидные рецепторы
Опио́идные реце́пторы (опиатные рецепторы) — разновидность рецепторов нервной системы, относящихся к рецепторам, сопряжённым с G белком. Основная их функция в организме — регулирование болевых ощущений. В настоящее время различают четыре основные группы опиоидных рецепторов: μ- (мю), δ- (дельта), κ- (каппа) и ноцицептиновые (ORL1) рецепторы. Они связываются как с эндогенными (вырабатываемые в организме), так и с экзогенными (поступающими извне) опиоидными лигандами. Опиатные рецепторы широко распространены в головном, спинном мозге, а также в желудочно-кишечном тракте и других органах.
15.1. История
К середине 1960-х годов, анализируя результаты фармакологических исследований, учёные стали предполагать, что опиоиды, вероятно, действуют на специфические рецепторы. Рецепторы были впервые определены как специфические молекулы при проведении исследований, в которых было обнаружено, что опиаты, меченные радиоизотопами, связываются с субклеточными фракциями головного мозга. Первое такое исследование было опубликовано в 1971 году с использованием 3H-леворфанола и его антагониста налоксона. В 1973 году, Кэндис Перт и и Соломон Снайдер опубликовали результаты первого подробного радиоизотопного исследования опиоидных рецепторов с использованием 3H-налоксона. Это исследование было признано как первое точное обнаружение опиоидных рецепторов, хотя вскоре после него в этом же году были проведены два других подобных исследования. В 1976 году Мартин и коллеги по результатам исследованийin vivo на собаках пришли к выводам о существовании нескольких типов опиоидных рецепторов. Для подтверждения их существования предпринимались попытки выделения очищенного белка опиоидных рецепторов, но они были безуспешными. В начале 1990-х годов, в молекулярно-биологических исследованиях выяснили структуру и механизм действия опиоидных рецепторов. Четыре различные кДНК были выделены как представители семейства опиоидных рецепторов. Три из них соответствуют µ-, δ- и κ-рецепторам, а четвёртая — новому типу рецепторов — ноцицептивным или ORL-1 (англ. opioid-receptor-like 1), который отнесён также к опиоидным, хотя он не обладает высоким сродством с опиоидными лигандами.
15.2. Механизм действия
При активации опиоидного рецептора ингибируется аденилатциклаза, которая играет важную роль при синтезе вторичного посредника цАМФ (cAMP), а также осуществляется регулирование ионных каналов. Закрытие потенциал-зависимых кальциевых каналов в пресинаптическом нейроне приводит к уменьшению выброса возбуждающих нейромедиаторов (таких как глутаминовая кислота), а активация калиевых каналов в постсинаптическом нейроне приводит к гиперполяризации мембраны, что уменьшает чувствительность нейрона к возбуждающим нейромедиаторам
15.3. Виды опиоидных рецепторов
Номенклатура.
Опиоидные рецепторы были названы по первой букве лиганда, с которым впервые обнаружена их связь. Так, морфин был первым веществом, у которого была обнаружена способность связываться с μ-рецепторами, а κ-рецепторы названы в честь обнаружения их связывания с кетоциклазоцином. Также рецептор с высоким сродством к энкефалинам был обнаружен в семявыносящих протоках мышей и назван δ-рецептором. Позднее другой опиоидный рецептор был обнаружен и клонирован на основе гомологичности с кДНК. Этот рецептор известен как ноцицептиновый рецептор или ORL 1-рецептор.
Предположено существование отдельных подтипов опиоидных рецепторов в тканях человека, однако исследователям пока не удалось получить генетических или молекулярных доказательств их существования и считают, что они возникают в результате посттрансляционной модификации клонированных типов рецепторов илидимеризации.
Подкомитет IUPHAR допускает применение общепринятой греческой классификации, но рекомендует 3 классических рецептора (μ-, δ-, κ-) и ноцицептиновый рецептор обозначать как MOP, DOP, KOP и NOP соответственно.
| Рецептор | Подтип | Расположение [18][19] | Функция [18][19] |
|---|---|---|---|
| мю (μ) MOP | μ1, μ2, μ3 |
| μ1: μ2:
μ3:
|
| дельта (δ) DOP | δ1, δ2 |
| |
| каппа (κ) KOP | κ1, κ2, κ3 |
| |
| Ноцицептиновый рецептор NOP (ORL1) | - |
|
|
Лиганды
Эндогенные
Эндогенные опиоидные пептиды вырабатываются в самом организме и реализуют свои опиоидные эффекты. Обнаружение опиоидных рецепторов привело к открытию их эндогенных лигандов. Вначале были обнаружены три семейства опиоидных рецепторов (эндорфины, энкефалины и динорфины) в различных областях ЦНС, желудочно-кишечном тракте и других периферических тканях. Позднее были обнаружены ноцицептины, эндоморфины и другие опиоидные пептиды. При этом эндорфины, эндоморфины проявляют максимальное сродство к рецепторам типа μ, энкефалины — типа δ, динорфины — типа κ
Экзогенные[править | править вики-текст]
Экзогенные опиоиды поступают в организм извне и связываются с опиоидными рецепторами. Первым открытым опиоидом был морфин, алкалоид опийного мака, выделенный Фридрихом Сертюрнером из опиума в 1804 г. В настоящее время известно большое количество соединений (как производных морфина, так и веществ другой структуры), являющихся лигандами к опиоидным рецепторам. По происхождению различают естественные, синтетические и полусинтетические опиоиды. Многие из них используются в медицине в качестве анальгетиков и средств против кашля.
Агонисты μ-опиоидных рецепторов обладают большим потенциалом злоупотребления, в краткосрочном периоде вызывая эйфорию, а при систематическом употреблении — сильную физическую и психическую зависимость. По этой причине оборот опиоидов в большинстве стран контролируется.
Некоторые экзогенные лиганды и их сродство к различным типам опиоидных рецепторов[28][29]:
| Вещество | Сродство к рецепторам | ||
|---|---|---|---|
| μ | δ | κ | |
| Морфин | + + | + | + |
| Героин*, Метадон, Фентанил | + + | ||
| Сальвинорин А | + | ||
| Кодеин, Оксикодон, Гидрокодон, Декстропропоксифен | ± | ||
| Буторфанол | − − | + + | |
| Пентазоцин | ± | + | |
| Бупренорфин | ± | − − | − − |
| Налорфин | − | + | |
| Нальбуфин | − − | + + | |
| Налоксон и Налтрексон | − − | − | − |
| Обозначения: ++: сильный агонист, +: агонист, ±: частичный агонист, −: антагонист, − −: сильный антагонист. | |||
*Сам героин обладает довольно слабым сродством к μ-рецепторам, но легко проникает через гемато-энцефалический барьер, где преобразуется в 6-моноацетилморфин —
16. Субста́нция Р
Вещество P ( Substance P ) - один из наиболее известных пептидов, открытый в 1931 году ( Euler L.L.S. & Gaddum J.H., 1931 )
Субста́нция Р (англ. substance P; синоним вещество́ Р) — нейропептид из семейства тахикининов. Близка по структуре и свойствам нейрокинину А.
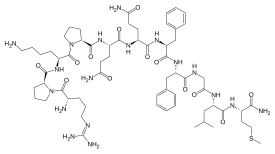
Субстанция Р состоит из 11 аминокислотных остатков. Её структура: Arg-Pro-Lys-Pro-Gln-Gln-Phe-Phe-Gly-Leu-Met
Обнаруживается в головном и спинном мозге, энтеральной нервной системе, щитовидной железе, в коже и мышцах. Присутствует в энтерохромаффиноподобных (ECL-) клетках и нейронах желудочно-кишечного тракта: в пищеводе, толстой кишке, проксимальной части тощей кишки и, в особенно большом количестве, в двенадцатиперстной кишке
Вещество Р обладает широким спектром биологической активности: оказывает сосудорасширяющее действие, способствует дегрануляции тучных клеток, является хемоаттрактантом для лейкоцитов, активирует синтез и высвобождение медиаторов воспаления. Показано, что снижение концентрации вещества Р в синовиальной жидкости уменьшает тяжесть экспериментального артрита.
Обладает широким спектром физиологической активности: изменение артериального давления крови , капиллярной проницаемости , сокращение гладкой мускулатуры , секретогенное действие, высвобождение пролактина и пищеварительных гормонов . В последнее время интенсивно изучается роль вещества Р и его аналогов в регуляции центральных процессов - порога болевого воздействия , обучения , сна , устойчивости к стрессу . На базе основной структуры вещества Р получено большое число химических производных, которые обладают свойствами сионистов или антагонистов тахикининовых рецепторов . ( Maggi C. & Manzini S., 1994 )
Является наиболее известным пептидом. По многим функциональным признакам вещество Р следует отнести к группе тахикининов: сходный спектр физиологических функций, общая система рецепторов, родственные признаки структуры предшественников. Обладает широким спектром физиологической активности: изменение артериального давления крови, капиллярной проницаемости, сокращение гладкой мускулатуры, секретогенное действие, высвобождение пролактина и пищеварительных гормонов. В последнее время интенсивно изучается роль вещества Р и его аналогов в регуляции центральных процессов – порога болевого воздействия, обучения, сна, устойчивости к стрессу. В головном мозге вещество Р участвует в процессах, связанных с функцией другого нейрорегулятора – допамина. При повреждении допаминэргических волокон выявлено снижение экспресии мРНК, кодирующих образование вещества Р, энкефалинов, динорфина.
В синовиальной жидкости при артрите отмечается высокий уровень вещества Р. Повышенный уровень вещества Р в синовиальной жидкости вызывает усиление продукции синовиоцитами коллагеназы и свободных радикалов кислорода. Такое местное выделение может быть достаточно интенсивным и приводить к локальному уменьшению вещества Р в нервных терминалях. Кроме того, микроокружение в синовиальной ткани содержит много молекул, способных стимулировать хемочувствительные нервы. К таким непосредственно стимулирующим агентам относят брадикинин, гистамин, серотонин. Их действие усиливается веществом Р и воспалением. Эти прямые химические стимуляторы, возможно, ответственны за возникновение боли в покое. Воспалительные медиаторы (ИЛ-1, ФНО-α) приводят к выделению нейропептидов из сенсорных окончаний (увеличивается уровень субстанции Р) и ускоряется деградация хряща. Вещество Р стимулирует тучные клетки, которые в результате могут выделять вазоактивный интестинальный пептид и фактор роста нервов.
16.1. Рецептор SP
Эндогенный рецептор вещества Р (SP) - рецептор нейрокинина 1 (NK1-рецептор, NK1R). Он принадлежит к семейству Тахикининовых рецепторов подсемейству GPCRs. Другие подтипы нейрокинина и нейрокининовых рецепторов, которые взаимодействуют с SP были так же зарегистрированы. Аминокислотные остатки, которые ответственны за связывание SP и его антагонистов присутствуют во внеклеточных петлях и трансмембранном участке NK-1. Связывание SP с NK-1 приводит к интернализации с помощью клатрин-зависимого механизма к подкисленной эндосомами где комплексные разъединяет. Впоследствии СП деградирует и NK-1 повторно экспрессируется на поверхности клетки. [10] Вещество Р и рецепторов NK1 широко распространены в мозге и обнаруживаются в областях мозга, которые являются специфическими для регуляции эмоций (гипоталамус, миндалевидное тело и околоводопроводного серого вещества). [11] Они находятся в тесной связи с серотонина (5-HT) и нейронов, содержащих норадреналин, которые являются мишенью используемых в настоящее время антидепрессантами. [12] промотор рецептора SP содержит области, которые чувствительны к цАМФ, AP-1, AP-4, CEBPB, [13] и эпидермальный фактор роста. Поскольку эти области связаны с закомплексованных путей передачи сигнала, опосредованных цитокинами, было высказано предположение, что цитокины и нейротропные факторы могут индуцировать NK-1. Кроме того, СП может индуцировать цитокины, которые способны индуцировать NK-1 факторы транскрипции. [14]
17. Клинико-фармакологические аспекты терапии болевого синдрома
В настоящее время в терапии боли применяют ненаркотические и наркотические анальгетики по трехступенчатой схеме, состоящей из последовательного применения анальгетиков с возрастающей силой действия в сочетании с адъювантной терапией по мере увеличения интенсивности боли.
Наибольшее распространение в лечении болевого синдрома получили препараты из группы нестероидных противовоспалительных средств (НПВС) [3]. Более 30 млн людей в мире ежедневно принимают НПВС. Около 20% больных в стационаре назначаются препараты этой группы.
В то же время применение лекарственных средств из группы НПВС может сопровождаться развитием целого ряда нежелательных лекарственных реакций (НЛР).
Наиболее изученной проблемой при назначении НПВС является их гастротоксичность. Известно, что неблагоприятные побочные реакции со стороны желудочно-кишечного тракта (ЖКТ) в виде диспепсии могут развиваться у 15- 20% пациентов, регулярно принимающих НПВС. При длительном приеме язвенное поражение желудка может развиться у 5- 8%, двенадцатиперстной кишки — у 3- 5% пациентов. Кровотечение, перфорация язвы, нарушение проходимости ЖКТ отмечаются у 1- 1,5% больных. Большие желудочно-кишечные кровотечения и перфорации желудка наблюдаются у лиц, принимающих НПВС, примерно в 5 раз чаще, чем у лиц, не принимающих лекарственные средства этой группы. Данные ряда исследований подтверждают, что даже незначительное повышение доз в рамках рекомендуемых терапевтических сопровождается заметным увеличением риска гастротоксических осложнений в случае применения традиционных НПВС (диклофенака) [2].
Более чем у 10% пациентов, получающих НПВС, отмечается изменение агрегационных свойств тромбоцитов, у 1% больных выявляются побочные эффекты со стороны ЦНС, гепатотоксичность, сыпь, почечная недостаточность и бронхоспазм [4].
Не менее значимыми являются кардиоваскулярные эффекты НПВС. В настоящее время установлено, что длительное применение препаратов данной группы у лиц старше 60 лет — независимый предиктор возникновения артериальной гипертензии (АГ) (относительный риск составляет 1,4), а у больных с АГ достоверно на 29% ухудшает возможности контроля уровня артериального давления (АД). Риск развития хронической сердечной недостаточности (ХСН) возрастает в 2,2 раза, каждое пятое обострение у пациентов с декомпенсацией ХСН связано с НПВС.
В октябре 2004 г. с мирового фармацевтического рынка в связи с выявленной кардиотоксичностью был отозван препарат рофекоксиб.
По данным ряда исследований применение диклофенака и индометацина также ассоциируется с повышением риска развития сердечно-сосудистых событий (суммарный показатель относительного риска для индометацина — 1,3, для диклофенака — 1,4).
В октябре 2006 г. Европейским медицинским агентством был подготовлен пресс-релиз, в котором указывалось, что в настоящее время стали доступными новые данные, указывающие на увеличение риска развития тромбозов (в виде инфаркта миокарда или инсульта) при применении неселективных ингибиторов циклооксигеназы (ЦОГ), особенно когда они применяются длительно в высоких дозах.
В США 103 тыс. госпитализаций и 16,5 тыс. летальных исходов в 2004 г. были связаны с приемом НПВС, причем было установлено, что чем выше доза НПВС, тем больше риск развития НЛР [1].
Комитет по медицинским продуктам, использующимся у человека, Европейского медицинского агентства рекомендовал использование НПВС, в т. ч. и неселективных, в наименьших эффективных дозах, с наименьшей возможной продолжительностью лечения, достаточной для контроля симптомов заболевания.
17.1. "Лестница" обезболивания ВОЗ
В 1986 году Всемирной организацией здравоохранения (ВОЗ) были установлены первые рекомендации по началу лечения онкологической боли. Эти рекомендации, которые были недостаточными, основывались на "лестнице обезболивания" ВОЗ, ступенчатом подходе к использованию анальгетиков в зависимости от выраженности боли. Режим рассматривается с учетом как тяжести боли, так и предполагаемой эффективности анальгетиков. ВОЗ стратифицировала три шага в отношении выбора анальгетических препаратов при данном подходе: Шаг 1 – использование неопиоидных анальгетиков (ацетаминофен или нестероидные противовоспалительные препараты – НПВП), шаг 2 – применение "слабых" опиоидов (гидрокодон, кодеин или трамадол), шаг 3 – применение сильных опиоидов (морфин, гидроморфон, оксикодон, фентанил или метадон). Дополнительные препараты (вспомогательные) необходимо использовать для снижения тревожности. Данный терапевтический пошаговый подход привел, прежде всего, к выдвижению предположения о назначении неопиоидных анальгетиков пациентам с легкой болью, слабых опиоидов пациентам с умеренной болью и сильных опиоидов пациентам с сильной болью. В рекомендациях ВОЗ предложено предписание анальгетиков шага 2 в том случае, если лечение анальгетиками, указанными в шаге 1, оказалось неэффективным, а предписание анальгетиков шага 3 в случаях наличия боли даже при приеме анальгетиков, указанных в шаге 2. Данный подход затем был экстраполирован на неонкологическую боль, в том числе, боль в суставах. При острой суставной боли, интенсивность которой может быстро нарастать, можно сразу начать с назначения сильного опиоида в течение недели для быстрого облегчения боли и затем переключиться на неопиоидные анальгетики, если боль уменьшилась. В 2015 г. научное общество обсудило данный подход и предложило другие классификации, основанные на клинической эффективности или механизмах боли. Подход, основанный на механизме действия, вероятно, более целесообразен. Дэвид Люсьер (David Lussier) и Пьер Бьюлью (Pierre Beaulieu) в книге Фармакология боли (Pharmacology of Pain) (IASP, 2010) предложили новую рациональную классификацию, в основе которой лежат и механизмы боли, и молекулярные цели анальгетиков. Что касается хронической боли, ноцицептивную боль воспалительного происхождения можно лечить уменьшением воспаления с помощью стероидов или НПВП, невоспалительную ноцицептивную боль – опиоидами и неопиоидными анальгетиками, нейропатическую боль – антидепрессантами или антиконвульсантами, включая специфические лекарственные препараты при определенных клинических ревматологических случаях, в частности, колхицин для лечения подагры. Другой подход от лестницы обезболивания ВОЗ позволяет врачам лечить боль в соответствии с клиническими реалиями и избегать пребывания в рамках терапевтического повышения к более сильным лекарственным препаратам. Остеоартроз является основной причиной боли у пожилых пациентов, которые часть принимают многочисленные лекарственные препараты при распространенных сопутствующих заболеваниях, которые необходимо учитывать при выборе анальгетиков. В ранее опубликованных руководствах и недавно вышедшие рекомендациях OARSI (Международное сообщество по изучению остеоартроза) надлежащее лечение определялось в виде приема ацетаминофена, НПВП и дулоксетина, в зависимости от сопутствующей патологии. Виды лечения, которые рассматривались как ненадлежащие, включали опиоидные анальгетики. Опиоидные анальгетики должны предписываться только пациентам с болью, трудно поддающейся лечению, с наличием противопоказаний к рекомендованным видам лечения или пациентам, ожидающим ортопедической хирургии или в случае невозможности хирургического вмешательства. Боль при остеоартрите имеет ряд характеристик, указывающих на разные механизмы, лежащие в ее основе. Некоторые пациенты описывают свою боль как нейропатическую с предположительной периферической или центральной сенситизацией. У пациентов с данным фенотипом лечение может быть нацелено либо на уменьшение периферической или центральной сенситизации, либо на усиление нисходящей ингибирующей активности (например, антиконвульсанты, антидепрессанты или капсаицин). При воспалительных ревматических заболеваниях оптимальным видом лечения боли являются НПВП или кортикостероиды. Опиоиды и неопиоидные анальгетики назначаются, преимущественно, при механической боли, индуцированной разрушением сустава. В настоящее время лечение биопрепаратами также является частью терапевтического подхода, направленного на лечение боли при воспалительных ревматических заболеваниях и может рассматриваться наряду с антиноцицептивными анальгетиками. В отношении микрокристаллического артрита для оптимального лечения необходимы НПВП, колхицин или кортикостероиды, согласно рекомендациям EULAR (Европейская противоревматическая лига) при накоплении кальция пирофосфата и третьего составляющего для развития подагры. При фибромиалгии неопиоидные и слабые опиоидные анальгетики приводят только к небольшому облегчению боли. Несмотря на то, что интенсивность боли у этих пациентов высока и теоретически должна приводить к назначению сильных опиоидов, согласно лестнице ВОЗ, доказательство эффективности отсутствует, и врачи должны рассматривать другие варианты лечения. Рекомендованным видом лечения чаще всего являются модуляторы нисходящего ингибирования. В заключении, лестница обезболивания ВОЗ не является подходящей для лечения острой или хронической боли в суставах. Дальнейшей перспективой является более углубленная характеристика разных механизмов боли в суставах и применение лекарственных препаратов в соответствии с их молекулярными целями
17.2. Принципы терапии нейропатической боли
В руководстве Канадской ассоциации по изучению боли предлагается ступенчатый фармакологический подход к лечению нейропатической боли.
Нефармакологические вмешательства, включая физиотерапию, и
психотерапевтические методики являются важными аспектами оптимизации лечения
нейропатической боли. Препаратами первой линии в терапии нейропатической боли
яляются трициклические антидепрессанты, габапентин и прегабалин. Разумно начать лечение с трициклического антидепрессанта или
противосудорожных препаратов - габапентина, прегабалина. Вторичные амины трициклических антидепрессантов
(нортриптилин и дезипрамин) обладают лучшей переносимостью, чем третичные
(амитриптилин и имизин), и имеют сопоставимую болеутоляющую эффективность. Амитриптилин не рекомендуется назначать лицам пожилого
возраста вследствие его седативного действия и таких побочных эффектов, как
констипация и задержка мочи. При приеме антидепрессантов достижение
анальгезирующего эффекта занимает около двух недель, о чем необходимо сообщать
пациентам для оптимизации комплаенса. Габапентин и прегабалин, имеющие, по-видимому, сходные
механизмы действия, эффективность и профили безопасности, позволяют более
быстрое титрование, чем антидепрессанты. Прегабалин, близкий по фармакокинетике
к габапентину, назначается двукратно в течение суток. Если трициклические антидепрессанты неэффективны, переходят
на прием противосудорожных препаратов (или наоборот). Если трициклические
антидепрессанты обеспечивают лишь частичный эффект, целесообразно дополнить
терапию антиконвульсантами. Препараты второй линии после трициклических антидепрессантов
- селетивные ингибиторы обратного захвата серотонина и норадреналина (СИОЗСН),
поскольку трициклические антидепрессанты обладают более доказанной
эффективностью и экономически доступнее. Однако трициклические антидепрессанты имеют более выраженные
побочные эффекты и противопоказаны лицам с тяжелыми сердечно-сосудистыми
заболеваниями. Ввиду благоприятного профиля переносимости лидокаин является
препаратом выбора для лиц пожилого возраста с локальной нейропатической боли,
такой как постгерпетическая невралгия. Препараты третьей линии - трамадола или анальгетиков
опиоидного ряда при неэффективности препаратов первой и второй линии. В периоде
титрации препаратов первой и второй линии для достижения адекватного
обезболивания может быть полезным использование комбинации опиатов короткого
действия, таких как оксикодон и ацетоминофен. В случае получения неадекватной
реакции на проводимую терапию начальная поддерживающая доза анальгезирующего
средства может быть рассчитана на основании суточной дозы опиатов короткого
действия. Выраженный болевой синдром может требовать назначения
комбинированной терапии: •антидепрессант •антиконвульсант •наркотический анальгетик Целесообразность такого подхода подтверждает исследование,
сообщающее об усилении анальгезирующего эффекта при использовании комбинации
морфин – габапептин, относительно монотерапии этими анальгетиками. Очевидно, что при назначении наркотических анальгетиков
необходимо принять во внимание обязательное наблюдение за пациентами с целью
выявления риска развития привыкания, а также некоторые сложности, связанные с
ведением документации, касающейся выписывания наркотических анальгетиков Препараты четвертой линии терапии включают каннабиноиды
(дронабинола, тетрагидроканнабинол), метадон и противосудорожные средства с
менее выраженными анальгезирующими свойствами, такие как ламотриджин, топирамат
и вальпроевая кислота. Их применяют в случае неэффективности или невозможности
применения вышеперечисленных средств. Данные препараты можно рассматривать в
качестве средств дополнительной терапии при отсутствии нежелательных эффектов
лекарственного взаимодействия и полипрагмазии.ПРЕПАРАТЫ ПЕРВОЙ ЛИНИИ
ПРЕПАРАТЫ ВТОРОЙ ЛИНИИ
ПРЕПАРАТЫ ТРЕТЬЕЙ ЛИНИИ
ПРЕПАРАТЫ ЧЕТВЕРТОЙ ЛИНИИ