Введение в цитологию
Читать обязательно!
| Сайт: | Электронный информационно- образовательный портал ВолгГМУ |
| Курс: | Дисциплина Экспериментальная патобиохимия клетки |
| Книга: | Введение в цитологию |
| Напечатано:: | Гость |
| Дата: | Четверг, 23 Май 2024, 12:05 |
Оглавление
- 1. Цитологиия наука о клетке
- 2. Основные цитоморфологические признаки злокачественности
- 3. Получение и обработка материала для цитологического исследования
- 4. Приготовление,фиксация, окрашивание мазков
- 5. Цитологические особенности эпителиальных клеток шейки матки
- 6. Цитологические классификации поражений шейки матки
- 7. Цитограмма в пределах нормы
- 8. Молекулярные механизмы развития дисплазии шейки матки
- 9. Дисплазия шейки матки
1. Цитологиия наука о клетке
Цитоло́гия (греч. κύτος «клетка» и λόγος — «учение», «наука») — раздел биологии, изучающий живые клетки, их органоиды, их строение, функционирование, процессы клеточного размножения, старения и смерти.
Также используются термины клеточная биология, биология клетки (англ. Cell Biology)
Клиническая цитология является разделом лабораторной диагностики и носит описательный характер. В частности, важным разделом клинической цитологии является онкоцитология, перед которой ставится задача диагностики новообразований
2. Основные цитоморфологические признаки злокачественности
- Резко или значительно выраженный полиморфизм по величине и форме как самих клеток, так и их ядер, доходящих иногда до гигантских размеров.
- Удельно большие (по отношению к слою протоплазмы), ядра клеток.
- Молодость ядер, проявляющаяся нежностью структуры хроматиновой сети и наличием в ядрах ядрышек (нуклеол), окрашенных в голубой или синий цвет.
- Множественность и полиморфизм нуклеол.
- Наличие в некоторых клетках фигур митотического деления (ядро распадается на отдельные хромосомы, располагающиеся в некоторых фазах деления звездообразно).
- Наличие признаков амитотического деления (клетки имеют два, три и больше часто не одинаковой величины ядра и иногда достигают очень больших размеров).
- Базофилия протоплазмы, иногда резкая.
- Вакуолизация ядра и протоплазмы (клетка как бы прострелена дробинами).
- Химическая анаплазия протоплазмы, выражающаяся различной окраской ее в отдельных клетках одной и той же группы или комплекса из атипических клеток.
- Фагоцитоз атипической клеткой клеток иного типа, обломков клеток, тканевого распада.
- Аутофагия — захват одной атипической клеткой другой такой же, причем ядро фагоцитирующей клетки оттеснено к периферии, сжато и изменено по форме.
- Образование из атипических клеток групп или комплексов округлой, а иногда правильно шаровидной формы
3. Получение и обработка материала для цитологического исследования
Характер и способ получения материала для цитологического исследования определяется локализацией патологического процесса в том или ином органе (ткани).
При заболеваниях кожи с помощью цитологического исследования изучают соскобы и отпечатки с изъязвленной поверхности, пунктаты из патологических образований.
При поражениях мягких тканей и костей, заболеваниях щитовидной железы и органов кроветворенияобъектом цитологического исследования являются пунктаты из участков поражения. При заболеваниях нервной системы цитологическому исследованию подвергают цереброспинальную жидкость, при заболеваниях глаза – соскобы с поверхности конъюнктивы, пунктаты из стекловидного тела.
При диагностике заболеваний органов дыхания цитологическому исследованию подлежит мокрота, в том числе и мокрота, выделение которой индуцировано ингаляцией трипсина; материал, полученный путём соскоба, аспирации, смыва, пункции, в том числе лимфатических узлов средостения, во время бронхоскопии и трансторакальной пункции.
С целью цитологической диагностики заболеваний органов пищеварения исследуют смывы из пищевода, желудка, двенадцатиперстной кишки, сигмовидной и прямой кишки («слепой» способ); смывы, полученные под визуальным контролем через катетер, подведённый к участку поражения; соскобы с помощью нейлоновой щетки во время эзофагоскопии, гастроскопии, дуоденоскопии, сигмоскопии, ректоскопии; соскобы и аспирируемый материал из общего желчного и главного панкреатического протоков во время ретроградной эндоскопической панкреатохолангиографии, пунктаты из слюнных желез, печени; пунктаты, соскобы и отпечатки из различных органов брюшной полости при лапароскопии, асцитическая жидкость, полученная при лапароцентезе.
При диагностике заболеваний молочной железы изучают выделения из соска и пунктаты пальпируемых и выявленных с помощью маммографии и термографии не пальпируемых образований.
При диагностике заболеваний мужских половых органов цитологическому исследованию подвергают пунктаты из яичка и предстательной железы.
Цитологическая диагностика заболеваний органов мочевыделения основана на исследовании выделившейся мочи; остаточной мочи, полученной из мочевого пузыря катетером; смывов, соскобов, аспирируемого материала, полученных при цистоскопии и ретроградной катетеризации мочеточника и почечной лоханки, пунктата из почки.
Методы обработки материала и окраски цитологических препаратов разнообразны и зависят от цели исследования. Поскольку результат исследования часто основывается на выявлении тонких повреждений ядерных и цитоплазматических структур, необходима уверенность, что эти изменения не являются артефактами, связанными с нарушением методики обработки и окраски материала. На основании исследования адекватного и репрезентативного материала устанавливают цитологический диагноз. При этом учитывают общую картину, обнаруженную в цитологическом препарате, а не только изменения отдельных клеток, принимают во внимание анамнестические, рентгенологические, эндоскопические и другие данные.
Цитологическое исследование в акушерстве и гинекологии проводится с целью изучения клеток эпителия влагалища (кольпоцитологическое исследование), влагалищной части шейки матки, капала шейки матки и слизистой оболочки тела матки, исследования пунктата (или аспирированного материала) из опухолей женских половых органов с целью выявления особенностей гормонального статуса, предопухолевых заболеваний и рака женских половых органов.
Материалом для цитологического исследования служат влагалищные мазки, мазки-отпечатки, смывы из влагалища, поверхностные соскобы со слизистой оболочки женских половых органов, аспирированный материал из эндометрия и тканевые пунктаты (из опухолей яичников и др.). Чаще всего используют кольпоцитологическое исследование влагалищных мазков (метод Папаниколау).
4. Приготовление,фиксация, окрашивание мазков
Правила приготовления препаратов едины вне зависимости от того, делается мазок специалистом, получившим материал, или готовится в лаборатории.
Стекла для препаратов нужно использовать новые, стандартного размера, чистые, обезжиренные и сухие.
Хороший мазок должен быть максимально тонким (максимально приближающимся к однослойному), равномерной толщины (не волнообразным) на всем протяжении. Материал распределяется по стеклу краем шлифованного стекла или ребром иглы.
Мазок должен начинаться на 1 см от узкого края предметного стекла и заканчиваться примерно в 1,5 см от другого края; мазок не должен достигать широкого края стекла, между мазком и широким краем предметного стекла должно оставаться расстояние не менее 0,3 см.
Жидкости, полученные при пункции, тут же центрифугируют, сливают верхний слой центрифугата, а из осадка делают мазки с помощью специального шлифованного стекла или пластинки (методика приготовления препаратов аналогична мазкам крови). При этом получаются тонкие препараты со щеточкой по краю для цитологического исследования.
Жидкостная цитология
- Лучшим способом обработки материала для цитологического исследования является жидкостная цитология. Препараты, приготовленные на цитоцентрифуге, однослойные, материал распределен равномерно на определенной поверхности.
- Препараты удобно просматривать, так как материал распределен равномерно.
- При необходимости проведения иммуноци-тохимических исследований экономятся дорогостоящие реактивы, результаты удобно интерпретировать
Фиксация и окрашивание препаратов
Мазки можно окрашивать любым из красителей, используемых в цитологической диагностике, однако наилучшие результаты получаются при использовании различных модификаций метода Романовского (по Паппенгейму, Лейшману и др.). После приготовления мазков предварительной их фиксации не требуется, они высушиваются на воздухе.
Схема окрашивания мазков по методу Паппенгейма (модификация)
- Высушить мазок на воздухе.
- Опустить в фиксатор-краситель Мая-Грюнвальда на 3 минуты.
- Промыть водопроводной водой.
- Стряхнуть избыток воды.
- Докрашивание азур-эозином: 2 части 0,1% раствора азура, 1 часть 0,1% раствора водно-растворимого эозина и 3 части дистиллированной воды pH 6,8-7,2, окрашивание 20 минут. Смесь красителей готовят перед работой (ех tempore). Мазки окрашиваются от 20 до 30 минут. (Время необходимо устанавливать опытным путем в зависимости от свойств красителей, температуры воздуха, характера материала и других факторов.)
- Промыть водопроводной водой.
- Высушить на воздухе.
Методика окрашивания по Лейшману
- Высушить мазок на воздухе.
- Опустить в фиксатор-краситель Лейшмана на 3 минуты.
- Промыть водопроводной водой.
- Стряхнуть избыток воды.
- Опустить в краску (или залить краской) 40 мл 0,1% красителя азур II, 30 мл 0,1% воднорастворимого эозина, 70 мл дистиллированной воды. Смесь красителей готовят перед работой (ех tempore). Мазки окрашиваются от 20 до 40 минут.
5. Цитологические особенности эпителиальных клеток шейки матки
Клетки плоского эпителия
Мазки для цитологического исследования получают с поверхности слизистой оболочки, поэтому их клеточный состав представлен слущенными клетками, находящимися на поверхности эпителиального пласта. Чем лучше выражена способность эпителия к созреванию, тем более зрелые клетки попадают в мазок; при атрофических изменениях на поверхности эпителиального пласта располагаются менее зрелые клетки.
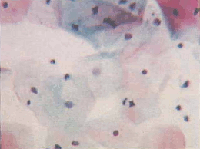
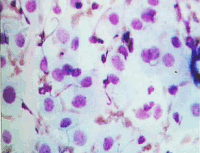
Поверхностные клетки – крупные плоские полигональные, около 50 мкм в диаметре. Ядра овальные или округлые, бесструктурные, пикнотические с максимальным диаметром 5 – 6 мкм. Зрелые клетки располагаются преимущественно разрозненно, цитоплазма при окрашивании по Папаниколау розовато-желтая, эозинофильная, нежная. Прозрачная, в части клеток определяются липидные гранулы и гранулы гликогена (рис.1,а). Менее зрелые клетки могут располагаться пластами, нагромождаться друг на друга. Цитоплазма цианофильная, нежная, прозрачная, со складками, контуры ее четкие, неровные.
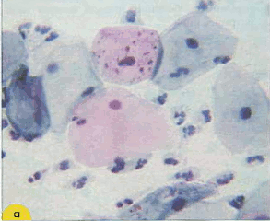 |  | |
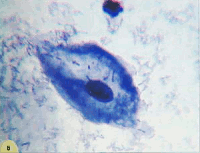
Рис. 1. Мазок из эктоцервикса: а) - поверхностные клетки плоского эпителия. Ядра мелкие, пикнотичные, цитоплазма обильная. В части клеток цитоплазма зрелая, эозинофильная, с гранулами. Менее зрелые клетки с голубой цитоплазмой. Немного лейкоцитов с сохранившимися ядрами и цитоплазмой. Окрашивание по Папаниколау. х 250; б) - промежуточная клетка плоского эпителия полигональной формы. Характерно округлое, "пузырьковидное" ядро. Цитоплазма обильная, складчатая. Окрашивание по Папенгейму. х 1000 | ||
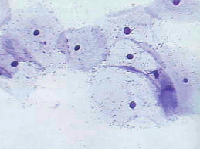
Промежуточные клетки – сравнительно крупные, обычно полигональные. Ядра пузырьковидные, с четкой структурой хроматина, диаметром более 6 мкм (рис.2, б). Цитоплазма может быть эозинофильной, цианофильной, характерна складчатость (рис.3, а, б). Зрелые промежуточные клетки (препикнотичные) отличаются от поверхностных размером и структурой ядра.
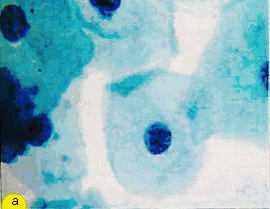 | 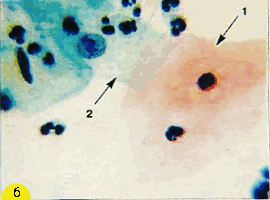 | |
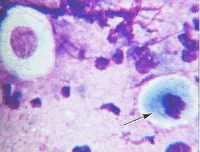
Рис. 3. Клетки плоского эпителия: а) - зрелые промежуточные клетки с овальными и округлыми пузырьковидными ядрами. Цитоплазма обильная, полигональная, окрашена в зеленые тона. Ядра округлые, хорошо видна равномерно-зернистая структура хроматина. Окрашивание по Папаниколау. х 500; б) - поверхностнаяклетка с оранжевой цитоплазмой и пикнотичным ядром (1) и промежуточная клетка с пузырьковидным ядром, светлой цианофильной цитоплазмой (2), немного лейкоцитов. Мазок из эктоцервикса. Окрашивание по Папаниколау. х 500 | ||
Менее зрелые промежуточные клетки (навикулярные, ладьевидные) овальной формы, меньших размеров, цитоплазма их более плотная. Лактобациллы способны вызывать лизис промежуточных клеток: этот пептический эффект редко распространяется на поверхностные клетки.
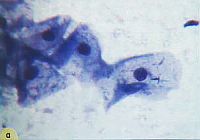
Парабазальные клетки – мелкие, овальные или округлые. Ядро относительно крупное, пузырьковидное, реже дегенеративное, пикнотичное. Цитоплазма обычно окрашивается цианофильно. Клетки не подвержены бактериальному цитолизу, однако в них могут развиваться аутолитические процессы (рис.4. а, б)
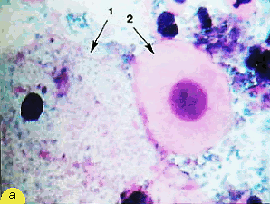 | 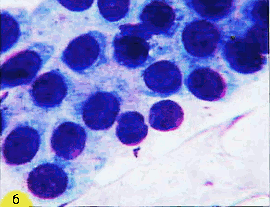 | |
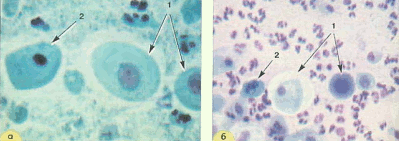
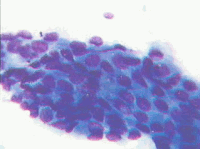
Рис. 4. Клетки плоского эпителия: а) - клетка поверхностного слоя: крупная, полигональная, ядро пикнотичное (1), клетка парабазального слоя: округлой формы, ядро крупное (2). Гематоксилин-эозин. х 600; б) - группа из клеток парабазального слоя. Клетки небольших размеров, ядра округлые, контуры ровные, четкие, цитоплазма скудная, границы клеток "размыты". Мазок из эктоцервикса. Окрашивание по Романовскому-Гимзе. х 400 | ||
Клетки цилиндрического эпителия
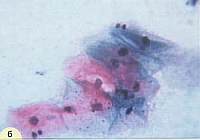
Клетки цилиндрического эпителия в норме располагаются небольшими группами, в виде полосок, сотоподобных структур. Клетки вытянутой формы, ядра располагаются эксцентрически. Могут встречаться "бокаловидные" клетки, цитоплазма в которых растянута слизью, иногда в клетках обнаруживаются гранулы секрета (рис.5 – 7).
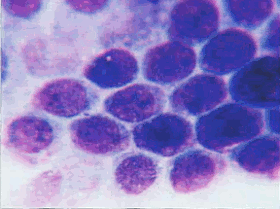 | 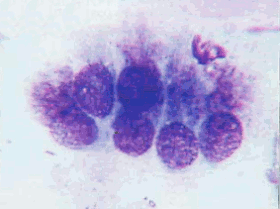 | |
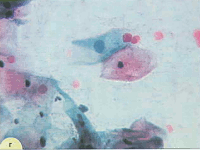
Рис. 5. Клетки цилиндрического эпителия в виде сотоподобной структуры. Ядра округлые или овальные, контуры ровные, хроматин распределен равномерно, встречаются мелкие мономорфные ядрышки. Цитоплазма вакуолизированная. Мазок из цервикального канала. Окрашивание по Романовскому. х 1000 | Рис. 6. Небольшая группа из клеток цилиндрического эпителия. Ядра овальные, контуры ровные, хроматин зернистый, распределен равномерно. В цитоплазме мелкие гранулы секрета. Мазок из шейки матки. Окрашивание по Романовскому. х 1000 | |
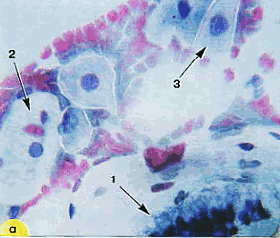 |  | |
Рис. 7. Мазок из эндоцервикса: а) - небольшая структура из клеток цилиндрического эпителия в виде полоски (1), клетки плоского эпителия поверхностного (2) и промежуточного (3) слоев, эритроциты. Окрашивание по Папаниколау. х 400 б) - небольшая группа из клеток цилиндрического эпителия. Окрашивание по Романовскому. х 400 | ||
Клетки метаплазированного эпителия
Клетки незрелого метаплазированного эпителия напоминают парабазальные, располагаются преимущественно разрозненно, реже в неплотных скоплениях (рис.8). Ядра несколько гиперхромные, хроматин распределен равномерно. Размер ядер составляет более половины диаметра клеток. Цитоплазма окрашена интенсивно. По мере созревания клеток (созревающая плоскоклеточная метаплазия) появляются клетки с отростками цитоплазмы (клетки – «паучки»). Иногда в цитоплазме определяется зона просветления вокруг ядра или вакуоли. Границы клеток четкие, иногда ровные с одной из сторон.
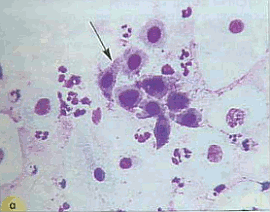 | 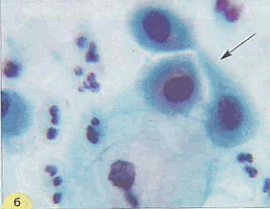 | |
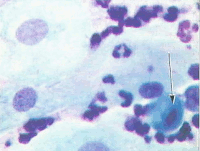
Рис. 8. Плоскоклеточная метаплазия (созревающая). "Клетки-паучки" (помечены струлочками). В связи с тем, что цитоплазма клеток очень нежная, при приготовлении препаратов образуются отростки, выросты. Ядра небольших размеров, округлые и овальные, хроматин распределен равномерно: а - окрашивание по Романовскому. х 400; б - окрашивание по Папаниколау. х 1000 | ||
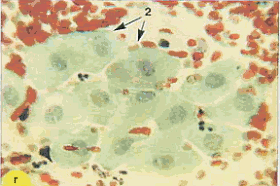
По мере созревания цитоплазма становится все более светлой, иногда вакуолизированной. Форма клеток приближается к овальной. Отмечается деление цитоплазмы на более светлую внутреннюю и более интенсивно окрашенную наружную часть. Зрелые метаплазированные клетки практически неотличимы от естественного плоского эпителия (рис.9)
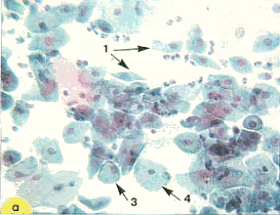 | 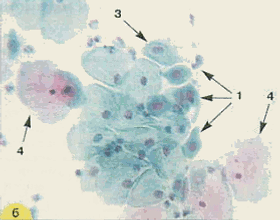 | |
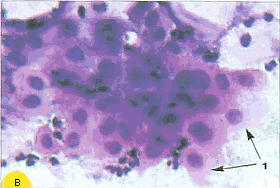 |  | |
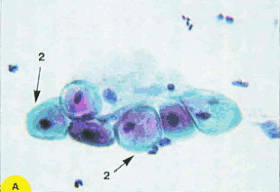 | 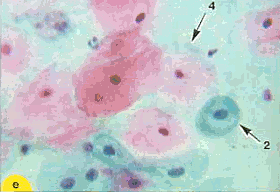 | |
Рис. 9. Незрелые и зрелые метаплазированные клетки: 1 - клетки-"паучки"; 2 - зрелые метаплазированные клетки, напоминающие парабазальные. Форма округлая, ядра округлые, овальные, околоядерная зона просветленная; 3 - зрелые метаплазированные клетки, сходные с промежуточными, цитоплазма объемная, форма цитоплазмы приближается к полигональной; 4 - поверхностные клетки. Окрашивание по Папаниколау: а, б - х 250; г-е - х 400; в-окрашивание гематоксилин-эозином, х 400 | ||
6. Цитологические классификации поражений шейки матки
В последние годы появились цитологические классификации, включающие широкий спектр патологичсеких изменений шейки. Наиболее распространенной является терминология, разработанная в г. Бетесда (США) (The Bethesda System (TBS) (1988 г., 1991 г.)
BETHESDA | ТЕРМИНОЛОГИЯ, РАСПРОСТРАНЕННАЯ В РОССИИ |
ОЦЕНКА КАЧЕСТВА МАЗКА | |
В пределах нормы |
Цитограмма в пределах нормы (цитограмма без особенностей) |
ДОБРОКАЧЕСТВЕННЫЕ ИЗМЕНЕНИЯ КЛЕТОК | |
Инфекции | |
|
|
|
|
|
|
|
|
|
|
Реактивные изменения | |
|
|
|
|
|
|
| |
ПАТОЛОГИЧЕСКИЕ ИЗМЕНЕНИЯ ЭПИТЕЛИЯ | |
<*>При возможности ASCUS должны быть определены как сходные с реактивными, репаративными или предраковыми процессами |
|
Изменения плоского эпителия (неопухолевые, но достойные динамического наблюдения) | |
<*> Изменения, связанные с папилломавирусом, ранее обозначаемые койлоцитоз, койлоцитарная атипия, кондиломатозная атипия, включены в категорию слабо выраженных изменений клеток плоского эпителия |
|
|
|
Инвазивный рак | |
|
|
Изменения железистого эпителия | |
| |
Клетки эндометрия цитологически доброкачественные (у женщин в менопаузе и т.д.) | |
| |
|
|
|
|
Другие злокачественные опухоли (по возможности определить нозологическую форму) | |
| Оценка гормонального статуса (производитеся только по вагинальным мазкам) | |
| Гормональный тип мазка соответствует возрасту и клиническим данным Гормональный тип мазка не соответствует возрасту и клиническим данным:………… (расшифровать) Гормональная оценка невозможна в связи с: ……………………..(указать причину) | |
Цитологические термины обычно основаны на гистологических классификациях. Однако на протяжении долгих лет во многих странах для формулировки результатов цитологического исследования использовалась, а в некоторых странах используется и по настоящее время классификация по Папаниколау.
В ней выделяют 5 классов:
- норма
- доброкачественная атипия
- дисплазия
- cr in situ, подозрение на рак
- рак
Затем все большее распространение получили классификации, основанные на гистологических (ВОЗ и другие).
В последние годы появились цитологические классификации, включающие широкий спектр патологических изменений шейки. Наиболее распространенной из них является классификация, разработанная в г.Бетесда (США), в которую вносилось несколько изменений. Сходной с ней является терминология, разработанная странами Европейского Содружества. Основные разделы включают поражения плоского и железистого эпителия. Оценивается качество мазка, изменения разделяются на доброкачественные, неясного генеза, предопухолевые и опухоли. В этой классификации имеются также указания на специфические инфекционные агенты, вызывающие заболевания, передаваемые половым путем.
Несколько противоречивы сведения о возможностях дифференциальной цитологической диагностики поражений эпителия, связанных с реактивными состояниями и неоплазией. В связи с этими сложностями в классификации Bethesda введен термин ASCUS - atypical squamous cells of undetermined significance (клетки плоского эпителия с атипией неясного значения). Термин введен для обозначения клеточных изменений, трактовка которых затруднительна.
Для врача – клинициста этот термин мало информативен, однако нацеливает на то, что данная пациентка нуждается в обследовании и\или динамическом наблюдении. Так как данные классификации используются в практике врача – цитолога, выше приведены параллели между классификацией Bethesda и классификацией, распространенной в России.
7. Цитограмма в пределах нормы
В норме в препарате из шейки матки, полученном с помощью шпателя, содержаться клетки плоского эпителия. Лейкоциты единичные, число их увеличивается перед менструацией, но в отличие от лейкоцитов при воспалении они "спокойные", с сохранившимися или пикнотическими ядрами, светлой цитоплазмой, без признаков фагоцитоза. Такой же состав имеют мазки, полученные из влагалища (описание – в разделе "гормональная цитологическая диагностика") (рис.5).
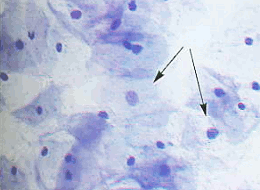 |  | |
Рис. 5. Поверхностные клетки плоского эпителия полигональной формы с обильной цитоплазмой, мелким, пикнотичным ядром, единичные промежуточные клетки (отмечены стрелкой). Мазок из влагалищной порции шейки матки. Окрашивание по Паппенгейму. х 400 | Рис. 6. Мазки из цервикального канала. Однорядные "полоски" из клеток цилиндрического эпителия. Клетки призматической формы, ядра расположены эксцентрически. Окрашивание по Папаниколау. х 250 |
В соскобе, взятом с помощью шпателя Эйра или щетки цервикс-браш, помимо клеток плоского эпителия должны содержаться (и это является признаком хорошего качества мазка) эндоцервикальная слизь, клетки цилиндрического эпителия в виде групп, сотоподобных структур, полосок; могут встречаться метаплазированные клетки (описание в разделе "Клетки метаплазированного эпителия").
В мазках, полученных из цервикального канала, обнаруживают клетки плоского и цилиндрического эпителия, единичные метаплазированные клетки, слизь (рис.6) Клеточный состав мазков, полученных в разные фазы менструального цикла и различные периоды жизни женщины, отличаются между собой.
Изменение клеточного состава мазков из шейки матки и влагалища
в течение менструального цикла и в различных возрастных группах
| Новорожденные У новорожденных в течение первых дней после рождения клеточный состав идентичен составу влагалищного мазка матери перед родами и представлен преимущественно промежуточными клетками и небольшим числом поверхностных. Мазки характеризуются отсутствием лейкоцитов, эритроцитов и бактериальной флоры. В течение месяца характер мазка меняется на атрофический тип. Преобладают парабазальные клетки, имеется небольшое число промежуточных, лейкоциты, необильная коккобациллярная флора. Подростки За 3 – 6 лет до первой менструации (менархе) мазки состоят преимущественно из промежуточных клеток, лейкоциты отсутствуют, появляется физиологическая флора (B. vaginalis, B. Doderlein), иногда бактериальный цитолиз. Примерно за 18 месяцев до менархе начинаются циклические изменения в эпителии влагалища, связанные с ростом фолликула и дегенерацией его без образования желтого тела. Женщины репродуктивного возраста Изменения мазков в репродуктивном возрасте соответствуют четырем основным периодам менструального цикла:
Беременность В первом триместре беременности устанавливается типичная для беременности картина мазка. После 14 недели эффект, связанный с продукцией гормонов плацентой, выражен. Преобладают навикулярные клетки или при наличии палочек Дедерлейна – "голые" ядра промежуточных клеток. Идеально нормальным для беременной после 3 – 5 месяцев является промежуточно-клеточный тип. При беременности могут встречаться клетки с укрупненными ядрами, появление которых связано с гормональными изменениями. Клетки окрашиваются интенсивно, ядра обычно гиперхромные, хроматин распределен равномерно (рис.10) Постменопауза Изменения в мазках сходны с изменениями в пременархе. Сначала отмечаются циклические изменения, не сопровождающиеся менструацией. Затем мазок состоит их промежуточных клеток без циклических вариаций, позже развивается полная атрофия эпителия, и мазки представлены клетками парабазальных слоев и мелкими "псевдопаракератотическими" клетками с интенсивно-базофильной блестящей цитоплазмой, мелким пикнотичным ядром или его фрагментами (кариорексис) (рис.11-15). У некоторых женщин прекращение менструации не сопровождается выраженными атрофическими изменениями, что, возможно, связано с функцией надпочечников, на протяжении всей жизни сохраняется промежуточно-клеточный тип мазка, иногда с присутствием поверхностных клеток (рис.16). Нередко такой тип мазка отмечают у пожилых женщин, продолжающих вести активную сексуальную жизнь. Дегенеративные изменения клеток в постменопаузе могут сопровождаться цитолизом. В этом случае в мазках обнаруживают клетки парабазального типа и "голые" овальные ядра разрушенных клеток (рис.17). Иногда атрофические изменения в мазках сопровождаются увеличением ядер реактивного характера (рис.18). Начинающие цитологи могут принять эти изменения за дисплазию или даже рак. В отличие от дисплазии увеличение ядер не сопровождается другими признаками, характерными для предопухолевых процессов и рака, и является обратимым. | ||||||||||||||||||||||||
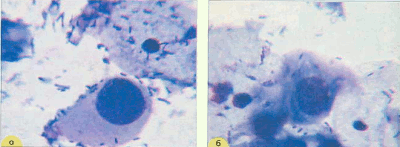
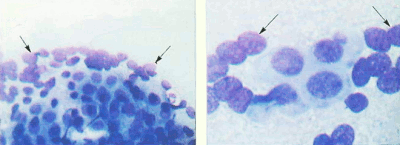 | 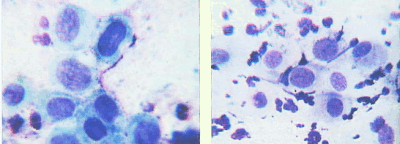 |
Рис. 19. Атрофическийтип мазка. Клетки базально-парабазального слоя, "голые" ядра парабазальных клеток (отмечены стрелками). Окрашивание оп Романовскому. х 160. 400 | Рис. 20. Атрофическийтип мазка. Реактивные изменения в эпителии. Клетки с укрупненными ядрами, контуры ядер ровные, четкие, хроматин распределен равномерно. Окрашивание по Романовскому. х 500. 400 |
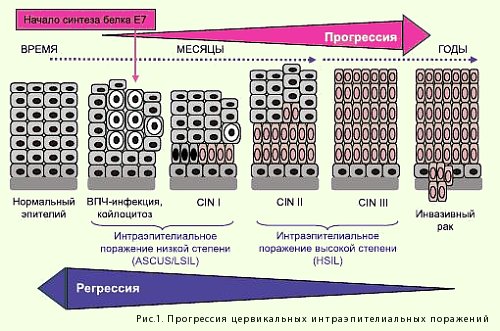
8. Молекулярные механизмы развития дисплазии шейки матки
Дисплазия шейки матки (или цервикальная интраэпителиальная неоплазия (CIN)) - это атипия эпителия шейки матки с нарушением "слоистости", но без вовлечения в процесс поверхностного слоя и стромы. Является самой частой формой морфологического предрака шейки матки. Характеризуется нарушением созревания и дифференцировки клеток многослойного плоского эпителия.
Выделяют три основные формы дисплазий: простую, или легкую (CIN I), среднюю (CIN II) и тяжелую (CIN III).
В группу риска по ДШМ входят женщины, отмечающие в анамнезе:
- раннее начало половой жизни (до 16 лет) - в этом возрасте многослойный эпителий истончен и легко раним, что может привести к ранней травматизации и развитию патологического процесса;
- частую смену сексуальных партнеров;
- воспалительные и венерические заболевания;
- травматизацию во время абортов, родов, выскабливаний;
- пристрастие к курению;
- наличие хронических инфекционных и вирусных (в частности, вируса герпеса второго типа) заболеваний генитального тракта.
К патогенетическим факторам ДШМ относят наличие воспалительных процессов, нарушение баланса половых гормонов и перенесенные травмы шейки матки. Однако главным фактором патогенеза ДШМ считается инфицирование вирусом папилломы человека (ВПЧ). ДНК ВПЧ высокой степени онкогенного риска (преимущественно 16 и 18 типов) обнаруживают в 50-80% образцов умеренной и тяжелой дисплазии плоского эпителия шейки матки (цервикальных интраэпителиальных поражений высокой степени).
Носительство ВПЧ не является пожизненным. По данным ВОЗ (2001), при отсутствии отягощающих факторов в течение трех лет плоскоклеточные внутриэпителиальные поражения низкой степени тяжести, содержащие ВПЧ, подвергаются регрессии в 50-60% наблюдений. В то же время у 15-28% женщин с наличием ДНК ВПЧ высокого онкогенного риска (при нормальной цитологии) в течение двух лет развивается сквамозная интраэпителиальная неоплазия.
Переход ДШМ в онкологический процесс занимает годы и даже десятки лет. Поэтому своевременное выявление и устранение ДШМ является основным способом профилактики ее грозных осложенений.
Влияние ВПЧ на развитие РШМ
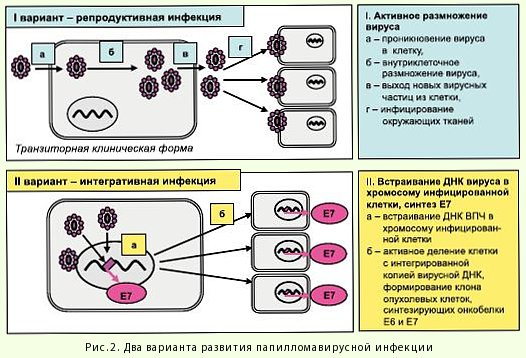
Несмотря на огромное разнообразие клинических форм проявления папилломавирусной инфекции, различают два основных варианта, или две стадии, ее развития:
- I стадия - репродуктивной инфекции, при которой ДНК ВПЧ находится в инфицированной клетке в свободном (эписомальном) состоянии;
- II стадия - интегративной инфекции, при которой ДНК вируса встраивается в геном инфицированных клеток
I стадия является обратимой. При ее благополучном исходе у многих ВПЧ-инфицированных наступает ремиссия. В отличие от нее II стадия является первым шагом к опухолевому перерождению вирус-инфицированной клетки и очень часто заканчивается развитием цервикальной карциномы.
Примечательно, что в случае, если у больного с остроконечными кондиломами (доброкачественными образованиями) в ходе лабораторных анализов определяется ВПЧ 16 типа (ВПЧ высокого онкогенного риска), его ДНК в вирус-инфицированных клетках находится в эписомальной форме, в то время как в образцах цервикального рака вирусная ДНК оказывается интегрированной в клеточный геном.
В результате включения вирусной ДНК в геном клетки-хозяина происходят глобальные изменения клеточного метаболизма, основным из которых является частичная потеря вирусного генетического материала, но с обязательным сохранением онкогенов Е6 и Е7 и их последующей гиперэкспрессией.
На стадии активной репродукции вируса экспрессия онкогенов Е6 и Е7 регулируется белковым продуктом гена Е2-репрессором их транскрипции. Поэтому пока вирус находится в клетке в эписомальном состоянии, протекают доброкачественные процессы разрастания инфицированных тканей. Интеграция вируса в геном хозяина сопровождается делецией гена Е2.
Повышенная продукция вирусных онкогенов Е6 и Е7 через модуляцию активности широкого спектра внутриклеточных сигнальных белков приводит к активации патологической пролиферации (и, соответственно, снижению апоптоза), усилению клеточного деления, неоангиогенеза и инвазии, т.е. основных биологических событий, опосредующих канцерогенез. Плюс к этому, индуцируются процессы хромосомной нестабильности (нарушения геномной целостности).
В ДНК хозяина возникают генетические мутации и эпигенетические модификации (аномальное метилирование - см. ниже), результатом которых является усиленная опухолевая трансформация вирус-инфицированных клеток. С течением времени в результате последовательной селекции клеточных клонов, содержащих интегрированную вирусную ДНК и обладающих повышенной малигнизирующей активностью, формируется злокачественная опухоль.
Таким образом, экспрессия онкогенов Е6 и Е7 вирус-инфицированными эпителиальными клетками шейки матки - это фактически инициация их опухолевой трансформации
Влияние эстрогенов на развитие РШМ
Мы рассмотрели ключевой механизм патогенеза ДШМ, обусловленный инфицированием цервикальных тканей ВПЧ, интеграцией ДНК ВПЧ высокого онкогенного риска в геном клетки хозяина и последующей гиперэкспрессией вирусных онкогенных белков Е6 и Е7.
Однако, помимо вирусных онкобелков Е6 и Е7, важнейшее влияние на развитие ВПЧ-обусловленных канцерогенных процессов шейки матки оказывает гормональный, точнее, эстроген-зависимый фактор.
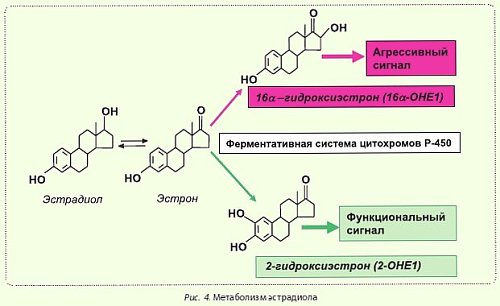
Известно, что основной пул эндогенного эстрогена утилизируется посредством локализованной в печени монооксигеназной системы цитохромов Р-450, катализирующей образование его гидрокси-производных, что облегчает их растворимость и последующее выведение из организма через почки и желчевыводящие пути. Ферментативная система цитохромов Р-450 обеспечивает конверсию эстрадиола в два основных метаболита:
- 16α-гидроксиэстрон (16α-ОНЕ1) - относится к категории "агрессивных" гормонов, вызывающих длительный канцерогенный эффект [23]. Показано, что этот эффект обусловлен образованием прочных ковалентных связей 16α-ОНЕ1 с ядерными эстрогеновыми рецепторами [25].
- 2-гидроксиэстрон (2-ОНЕ1) - обладает умеренными эстрогенными функциями и, в отличие от 16α-ОНЕ1, напротив, нормализует клеточный рост. При повышении уровня 2-ОНЕ1 наблюдается тенденция к гибели опухолевых клеток (in vitro) и профилактике их дальнейшего образования (in vivo).
Изучение функций этих двух метаболитов позволило выявить однозначную связь между уровнем 16α-ОНЕ1 и риском развития опухолей в эстроген-зависимых тканях и заключить, что соотношение 2-ОНЕ1 к 16α-ОНЕ1 является одновременно универсальным биомаркером и надежным диагностическим критерием при определении риска и прогноза развития эстроген-зависимых опухолей.
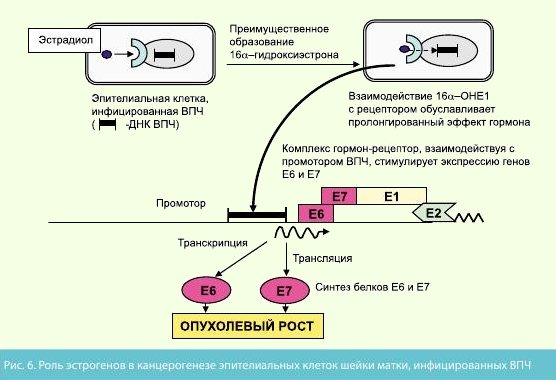
Было замечено, что тканевые изменения в цервикальном канале, вызванные ВПЧ, локализованы главным образом в эстроген-чувствительных зонах. Впоследствии была установлена ключевая роль в цервикальном канцерогенезе эстрогеновых рецепторов α (ERα).
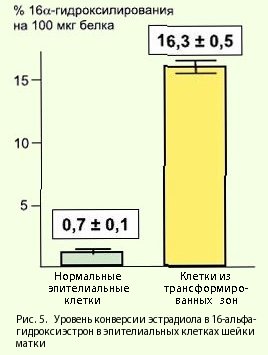
В начале 90-хгг. группе ученых из лаборатории H.L. Bradlow на клеточной модели кератиноцитов генитального тракта человека, инфицированных ВПЧ-16, удалось показать, что активная репродукция ВПЧ способна индуцировать образование в вирус-инфицированных клетках агрессивного метаболита 16α-гидроксиэстрона (16α-ОНЕ1).
Вирус-инфицированные клетки приобретали способность образовывать колонии на мягком агаре, что указывало на их повышенную пролиферативную активность. При этом клеточная культура, содержащая вирус, обеспечивала конверсию эстрадиола в 16α-гидроксиэстрон.
Несмотря на высокую пролиферативную активность, при микроскопическом исследовании данные клетки не имели опухолевого фенотипа. Однако добавление в культуральную среду экзогенного 16α-ОНЕ1 превращало их в типично раковые. В то же время нормальные эпителиальные клетки шейки матки были не способны обеспечивать превращение эстрадиола в 16α-гидроксиэстрон. Следовательно, активная репродукция ВПЧ в инфицированных клетках индуцирует образование "агрессивного" эстрогена - 16α-гидроксиэстрона.
Таким образом, формируется порочный круг, при котором вирус через образование "агрессивной" формы эстрогенов создает благоприятные условия для развития опухоли, стимулируя синтез онкобелка Е7. В свою очередь, онкобелок Е7, с одной стороны, активирует механизмы патологической пролиферации клеток, а с другой - блокирует противовирусную иммунологическую защиту.
Суммируя вышесказанное, можно заключить, что инфицирование эпителиальных клеток ВПЧ является необходимым, но недостаточным фактором для их малигнизации.
Для формирования необратимой неоплазии необходимы:
- индукция метаболических механизмов конверсии эстрадиола в 16α-ОНЕ1, играющего ключевую роль в раковом перерождении ВПЧ-инфицированных клеток;
- активная экспрессия онкогенов Е6 и Е7 вируса, стимулируемая взаимодействием комплекса гормон-рецептор с промотором ДНК ВПЧ;
- индукция множественных повреждений хромосомной ДНК в инфицированной клетке, завершающая процесс опухолевой трансформации.
Влияние активности опухоль-супрессорных генов на развитие РШМ
Известно, что набор генов одного индивидуума содержит абсолютно идентичную информацию. Однако клетки различных органов и тканей, имея полученный по наследству одинаковый набор хромосом, в процессе развития и функционирования экспрессируют различные гены. Такое многообразие способов выражения генетической информации достигается, в том числе, с помощью эпигенетической регуляции.
Можно сказать, что эпигенетическая регуляция - это эволюционный механизм, посредством которого обеспечиваются изменения в спектре экспрессии генов, возникающие в процессе развития клеток и тканей организма и не связанные с изменениями в структуре ДНК. Замечено, что изменения в спектре экспрессирующихся генов наблюдаются также по мере старения организма и при различных патологических состояниях, что является одной из главных причин необратимости некоторых из них, в первую очередь опухолевых заболеваний.
Ключевым механизмом эпигенетической регуляции является метилирование ДНК. Оно заключается в ковалентном присоединении метильной группы по С5-положению цитозина в составе динуклеотида СрG (цитозин-фосфор-гуанозин). Динуклеотидные сочетания СрG могут быть локализованы как в регуляторных (промоторных) участках генов, так и на всем остальном протяжении молекул ДНК. Примерно 50% генов млекопитающих в составе своих промоторов содержат динуклеотид CpG. Если СрG находится в неметилированном состоянии, наблюдается активная экспрессия соответствующего гена. Присоединение метильной группы к цитозину СpG, напротив, подавляет экспрессию генов и переводит их в статус "молчащих".
Показано, что гиперэкспрессия онкобелка Е7 ВПЧ 16 типа активирует процессы метилирования генов противоопухолевой защиты [6]. Метилирование цитозинов в составе пары CpG осуществляется при помощи специального фермента ДНК-метилтрансферазы (DNMT), а точнее, семейства из трех изоферментов - DNMT1, DNMT3a, DNMT3b.
К настоящему моменту накоплена обширная информация, не только подтверждающая роль аномального ДНК-метилирования в возникновении и прогрессии злокачественных опухолей человека, но и свидетельствующая о том, что при этом специфично повышается активность ДНК-метилтрансферазы 1 (DNMT1). На животных моделях (линия мышей с пониженной активностью DNMT1) была убедительно продемонстрирована корреляция между уровнем активности DNMT и степенью злокачественности исследуемых опухолевых тканей.
Таким образом, повышенный уровень ДНК-метилтрансферазы однозначно связывается с повышенной опухолеобразующей (малигнизирующей) активностью клеток млекопитающих.
Напротив, ингибирование DNMT (особенно изоформы DNMT1) блокирует гиперметилирование вновь синтезированных ДНК-цепей, в результате чего происходит снижение общего уровня метилирования генома и ре-экспрессия "молчащих" генов [9].
Диагностика РШМ
Общепризнано, что диагностика заболевания на ранних стадиях позволяет существенно снизить смертность от рака шейки матки (РШМ). Снижение смертности наблюдается в странах с хорошо налаженной системой диагностики. Однако наряду со снижением смертности от РШМ ежегодно регистрируется все большее количество заболевших этим видом рака [13], что говорит о необходимости дальнейшего усовершенствования методов его диагностики.
- Цитологический метод - мазок по Папаниколау [19]. Плохо поддается стандартизации, дает большой процент ложноотрицательных реакций: 30% дисплазий могут быть невыявлены.
- ПЦР-диагностика (мазок на ВПЧ) - не позволяет достоверно выявить лиц с повышенным риском развития РШМ, т.к. обнаруживает ДНК ВПЧ в большом количестве цитологически нормальных проб [26]. Это объясняется тем, что 50-90% (по разным данным) сексуально активного населения были инфицированы тем или иным типом ВПЧ в какой-либо период своей жизни, а 30% женского населения являются постоянными носителями ВПЧ.
- ИФА-диагностика онкобелков Е7 ВПЧ 16 и 18 типа в отделяемом цервикального канала
Усиление экспрессии ранних вирусных онкобелков Е6 и Е7 свидетельствует о встраивании вирусной ДНК в геном эпителиальной клетки [17, 24]. Продолжительная усиленная продукция этих белков часто сопутствует переходу дисплазии в инвазивный цервикальный рак.
У носителей ВПЧ никаких видоизменений в цервикальном канале не происходит и, как отмечалось, инфицирование ВПЧ в 80% случаев заканчивается спонтанной элиминацией вируса без встраивания его в геном человека, что является необходимым условием для развития злокачественного процесса .
Т.о., определение содержания онкобелка Е7 ВПЧ 16 и 18 типов в цервикальных пробах служит критерием в оценке характера (степени злокачественности) патологического процесса шейки матки и позволяет избежать ложноположительных результатов, обусловленных кратковременным и/или прошлым присутствием ВПЧ в организме человека.
Обнаруженный онкобелок Е7 ВПЧ 16 и 18 типов означает, что на субклеточном уровне уже запущены процессы клеточной трансформации (малигнизации). Это подразумевает более активную лечебно-диагностическую тактику со стороны врача в отношении данной больной.
- ПЦР-диагностика ДНК-метилированных опухоль-супрессорных генов
ДНК-гиперметилирование встречается практически во всех видах злокачественных опухолей, при этом каждый вид рака имеет свою, характерную только для него, картину ключевых метилированных генов, например ген Hippel-Lindau - для рака почки, ген MLH1 - для рака прямой кишки, ген АРС - для рака пищевода, ген GSTP1 - для рака простаты и т.д. Т.о., количественное определение уровня ДНК-гиперметилирования - промоторного метилирования метилирования опухоль-супрессорных генов, возникающее на ранних стадиях канцерогенеза, - в настоящее время весьма перспективным биомаркером.
Однако, с точки зрения дальнейшего развития и внедрения в клиническую практику метода диагностики онкологических заболеваний с помощью определения уровня ДНК-метилирования генов-маркеров, наиболее оптимальной и перспективной представляется оценка степени метилирования не одного, а группы ключевых генов, контролирующих процессы канцерогенеза. Ведь большинство опухолей не являются моногенными, и, следовательно, анализ метилирования одного гена не может дать полной информации о всей палитре изменений, происходящих в ткани-мишени. В этом случае успешно преодолеваются ограничения, имеющие место при анализе единичного гена, а именно: недостаточная чувствительность и низкая специфичность метода, невозможность дифференцировки злокачественных новообразований от доброкачественных и опухолей, имеющих другое органное происхождение, а также невозможность оценки риска развития опухолевого заболевания.
В настоящее время идет процесс накопления сведений о спектрах метилированных генов при различных локализациях рака .
Новые подходы к лечению дисплазий шейки матки
В связи с появлением вирусной концепции цервикального канцерогенеза принципиально изменились и подходы к лечению диспластических процессов шейки матки. В настоящее время хирургические методы (по причине высокого процента рецидивов после их применения) стали играть второстепенную роль.
На первое место вышла этиопатогенетическая терапия, имеющая два основных направления:
- воздействие на этиологический фактор - ВПЧ;
К сожалению, лекарственных средств, избирательно воздействующих на ВПЧ, в настоящее время не существует. Наиболее часто для лечения папилломавирусной инфекции используются препараты интерферона (IFN) - белка, вырабатываемого клетками иммунной системы в ответ на стимуляцию вирусными антигенами. Однако в большинстве случаев даже длительная IFN-терпия не приводит к клиническому улучшению.
Показано, что устойчивость к действию IFN ВПЧ-инфицированных цервикальных клеток определяется повышенным уровнем экспрессии онкобелка Е7, внутриклеточно инактивирующего фактор регуляции IFN, который включает транскрипцию генов, кодирующих синтез противовирусных белков.
- воздействие на основные механизмы канцерогенеза
- ингибирование экспрессии онкогена Е7 ВПЧ и синтеза 16-альфа-гидроксиэстрона
- ингибирование ДНК-метилтрансферазы
- стимулирование опухоль-супрессорного белка - фосфатазы PTEN
Источник: Вестник "Лаборатории ДНК-диагностики" N4(13), 2011
скомпилировано из клинической лекции Киселев В.И., Муйжнек Е.Л. Молекулярные механизмы развития дисплазии шейки матки: новые знания - новые возможности.
9. Дисплазия шейки матки
Интраэпителиальная неоплазия (атипическая гиперплазия, дисплазия)
Гистологические особенности
Легкая дисплазия характеризуется небольшой пролиферацией эпителия долек и протоков с двухрядным расположением, при этом просветы ацинусов сохранены, нет глубоких структурных изменений ядра и цитоплазмы.
Умеренная дисплазия: отмечается увеличение размеров ацинусов за счет пролиферирующих клеток эпителия с заполнением просвета, однако большая часть просветов ацинусов сохранена.
Тяжелая дисплазия относится к предраковым процессам и характеризуется укрупнением долек и практически полным заполнением просвета ацинусов и концевых отделов протоков пролиферирующими клетками с укрупненными полиморфными ядрами. В отличие от внутриэпителиального рака (cr in situ) митозы единичные, очаги некроза отсутствуют.
Цитологические признаки
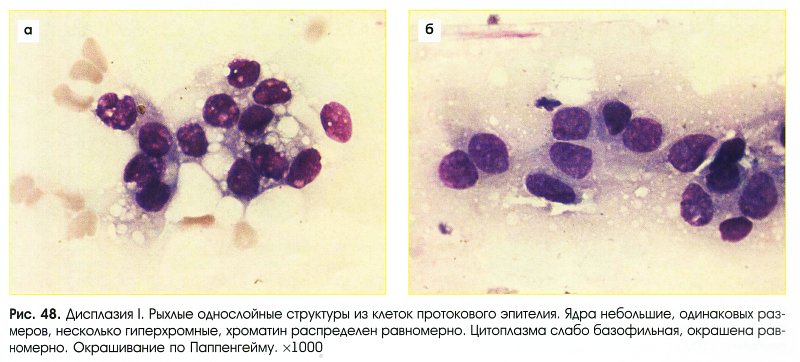
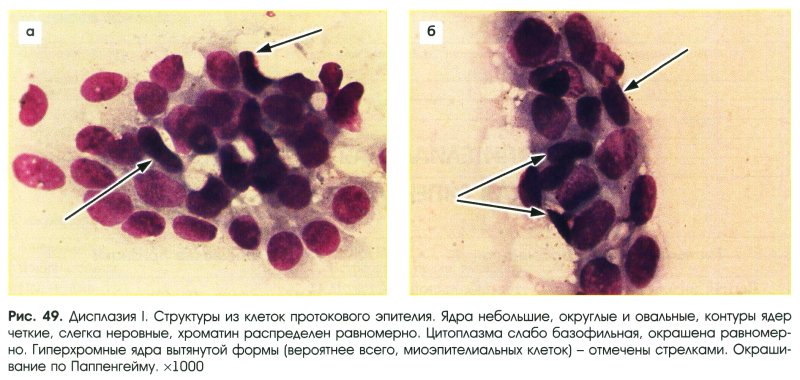
Легкая дисплазия (рис. 48, 49)
- Клетки однотипны.
- Размеры сравнительно небольшие.
- Форма округлая или кубическая.
- Ядра:
- небольшие;
- округлые, овальные;
- четко очерчены;
- хроматин распределен равномерно;
- ядрышки, как правило, не определяются
- Цитоплазма обычно базофильная, окрашена равномерно.
- В структурах:
- расположение клеток правильное;
- нередко однослойное;
- границы между клетками, как правило, видны отчетливо.
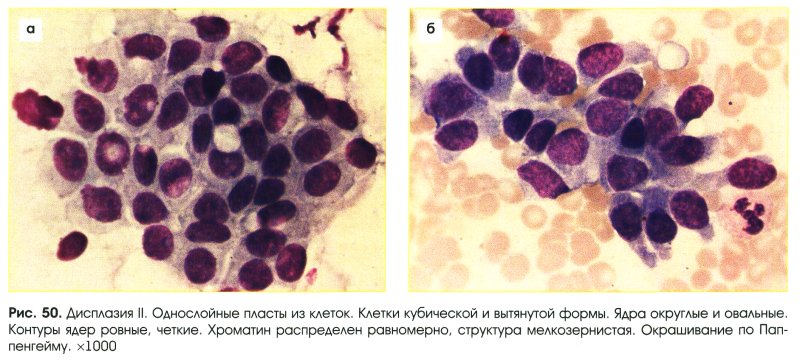
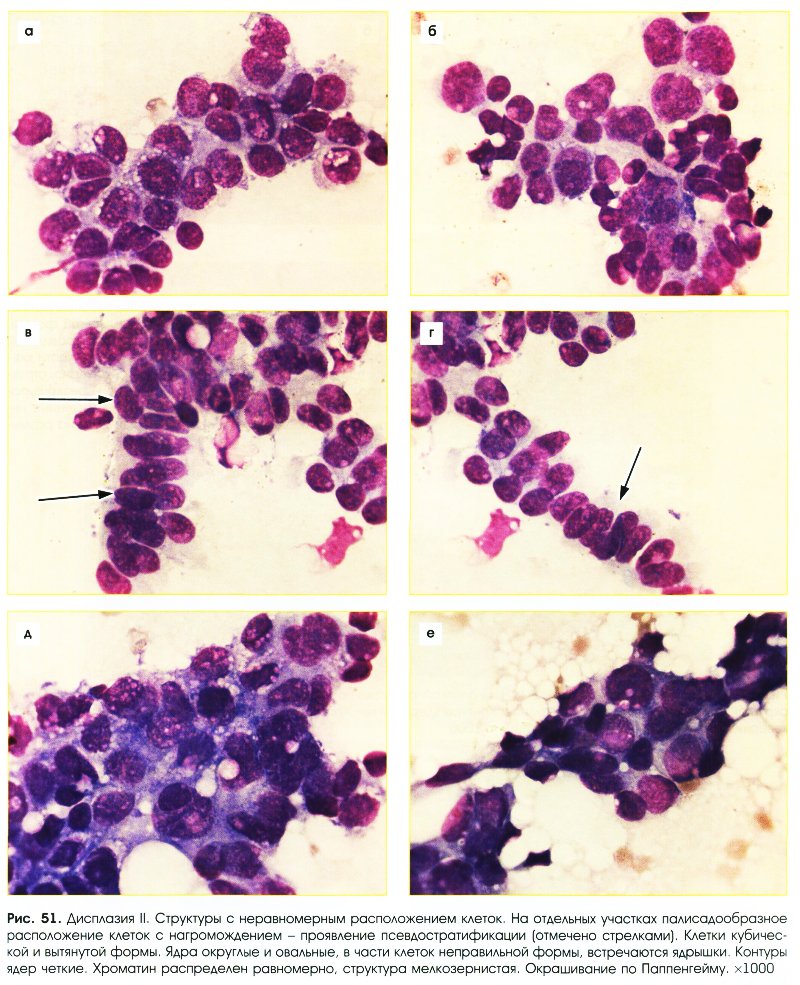
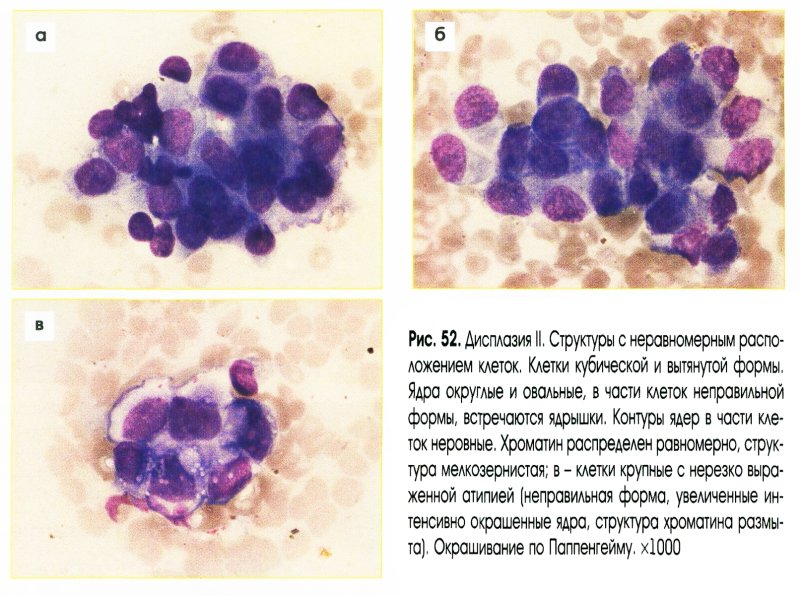
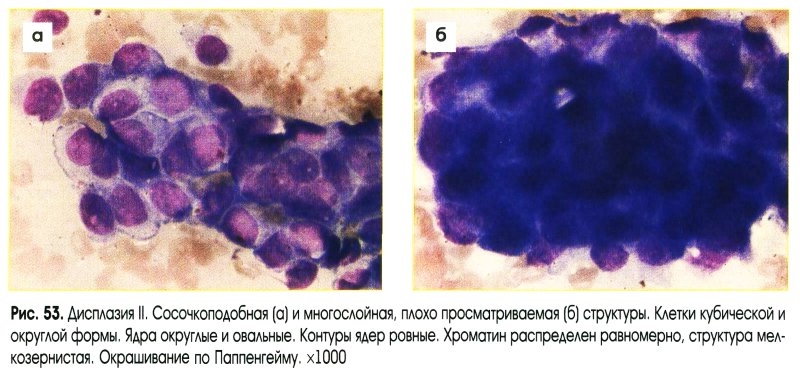
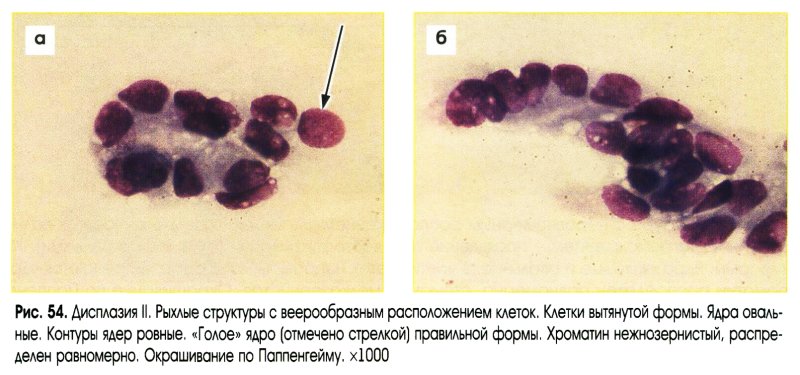
Умеренная дисплазия (рис. 50-54)
- Клетки несколько отличаются по размерам и форме.
- Форма клеток кубическая, вытянутая.
- Могут встречаться крупные клетки с нерезко выраженными признаками атипии.
- Ядра:
- округлые, овальные, слегка набухшие;
- укрупнены;
- гиперхромные;
- мембрана несколько неровная;
- хроматин зернистый, структура четкая;
- хроматин распределен равномерно;
- ядрышки единичные, укрупненные
- Цитоплазма обычно интенсивно базофильная.
- Структуры:
- расположение клеток неравномерное;
- может отмечаться потеря полярности расположения клеток;
- многорядные структуры с палисадообразным расположением ядер;
- могут обнаруживаться многослойные и сосочкоподобные структуры.
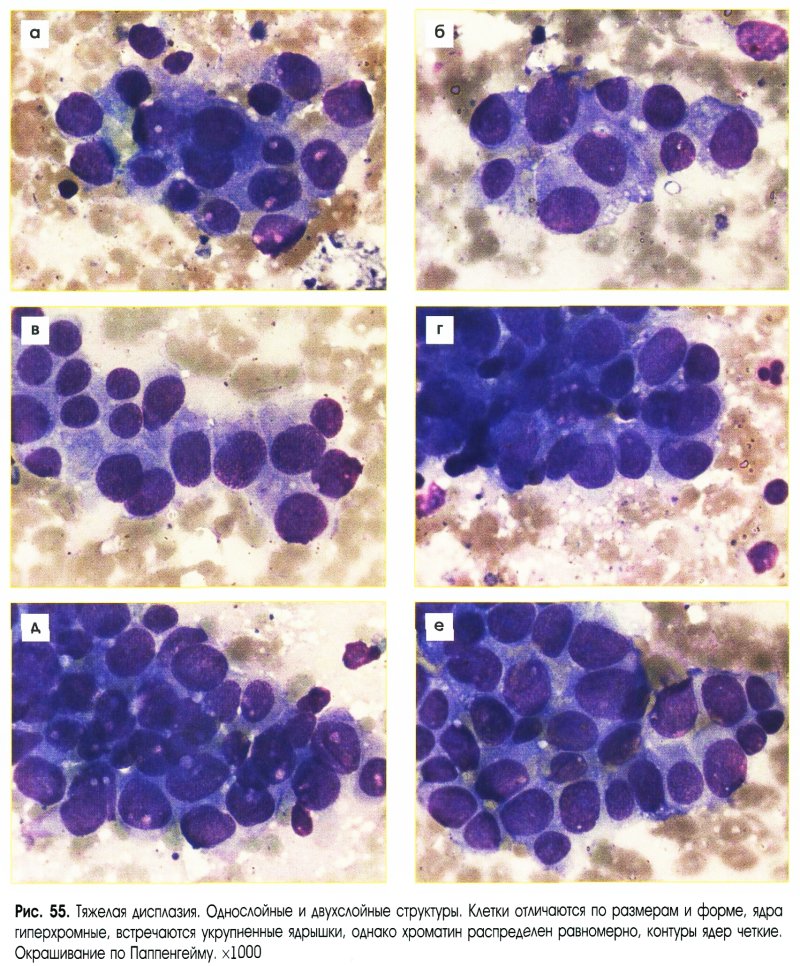
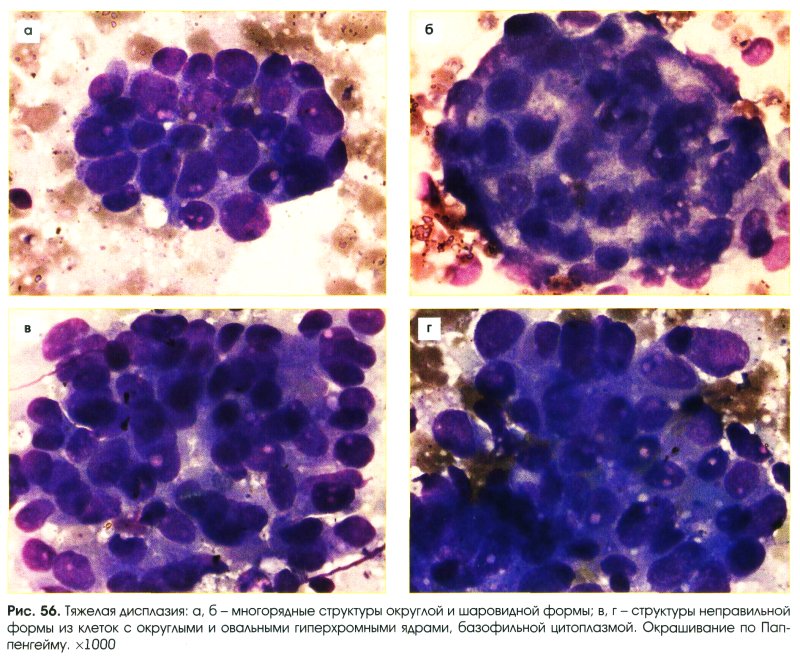
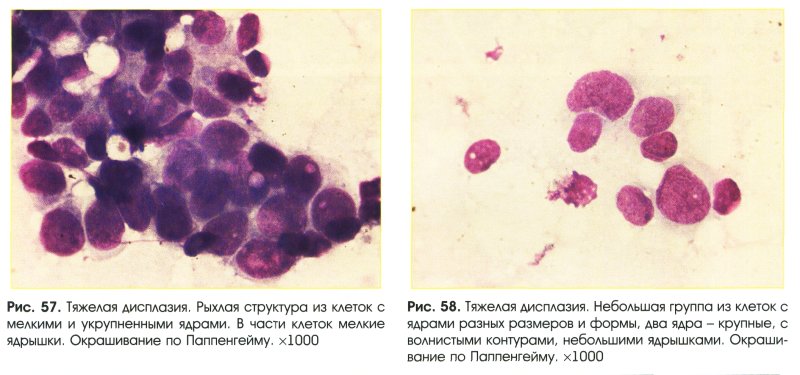
Тяжелая дисплазия (рис. 55-58)
- Клетки отличаются по размерам и форме.
- Значительное нарушение ядерно-цитоплазменного соотношения.
- Ядра:
- округлые, овальные, несколько неправильной формы;
- значительно укрупнены;
- контуры ядер четкие, иногда волнистые;
- хроматин мелкоточечный, насыщенный;
- ядрышки единичные укрупненные
- Цитоплазма необильная.
- Структуры:
- расположение клеток неравномерное;
- потеря полярности расположения клеток;
- многорядные;
- многослойные и сосочкоподобные;
- крупные клетки с признаками атипии в органической связи с клетками пролиферирующего эпителия в пластах и структурах.