Методика проведения электрофореза
| Сайт: | Электронный информационно- образовательный портал ВолгГМУ |
| Курс: | Дисциплина Медицинская биохимия, принципы измерительных технологий в биохимии, патохимия, диагностика, биохимия злокачественного роста Часть 1 |
| Книга: | Методика проведения электрофореза |
| Напечатано:: | Гость |
| Дата: | Среда, 3 Июль 2024, 17:18 |
1. Общая теория электрофореза.
Общая теория электрофореза.
Многие биомолекулы, такие, как аминокислоты, пептиды, белки и нуклеиновые кислоты, содержат ионизующиеся группы, поэтому в растворе они могут существовать в заряженной форме, в виде катионов (+) либо анионов (—).
Кроме того, молекулы с близкими по величине зарядами, но различающимися молекулярными весами отличаются друг от друга отношением заряда к массе.
На этих различиях основано разделение ионов при движении их в растворе под действием электрического поля (электрофореза).
Электрофорез - движение заряженных частиц в электрическом поле под действием кулоновских сил, действующих между частицей и полем.
Транспорт заряженной частицы под действием электрического поля называется электрофоретической подвижностью. Электрофоретическая подвижность μ может быть определена как скорость на единицу электрического поля (μ выражается в см2•сек-1•В-1 )
μ = v/Е и, следовательно, Q = μ/f.
Q-заряд, f-коэффициент поступательного трения макромолекулы, Е-электрическое поле, v-скорость частицы.
2. Разделения белков методом SDS-PAG-электрофореза
Электрофорез белков в полиакриламидном геле – это метод разделения смесей белков в полиакриламидном геле в соответствии с их электрофоретической подвижностью. Этот способ фракционирования белков и пептидов широко применяется в современной биохимии, молекулярной биологии, генетике. Существует большое количество модификаций электрофореза белков в полиакриламидном геле, предназначенных для решения различных задач и для разных белков и пептидов. Наиболее распространённой разновидностью является электрофорез белков в полиакриламидом геле в присутствии додецилсульфата натрия по Лэммли (англ. SDS-PAAGE).
На данном этапе важно правильно подобрать условия для проведения электрофореза, а именно концентрацию полиакриламида для концентрирующего и разделяющего гелей. Так, в концентрирующем геле концентрация полиакриламида может колебаться от 2 до 8%, а в разделяющем геле – от 5 до 20%. Выбор плотности геля зависит от молекулярных масс исследуемых белков.
3. Полиакриламидные гели
Полиакриламидные гели образуются при сополимеризации акриламида (АА) и бис-акриламида (N,N′-метиленбисакриламид, МБА, или просто “бис”). Реакция полимеризации проходит по свободнорадикальному механизму за счёт объединения винильных групп и носит цепной характер. Полимеризация инициируется персульфатом аммония (ПА): NH4–SO4–SO4–NH4, который при растворении в воде подвергается гомолитическому расщеплению по связи между атомами кислорода. В результате образуются два достаточно долго живущих радикала с одним неспаренным электроном у атома кислорода NH4–SO4˙. Скорость образования свободных радикалов из ПА можно увеличить путём добавления в раствор ТЕМЕД (N,N,N′,N′- тетраметилэтилендиамин, (CH3)2N–CH2–CH2–N(CH3)2), который, таким образом, служит катализатором реакции полимеризации. Свободные радикалы ПА взаимодействуют с мономерами акриламида, приводя к разрыву двойной связи и превращая их в свободные радикалы. Последние, в свою очередь взаимодействуют с неактивированными мономерами с образованием нового радикала, давая, таким образом, начало цепной реакции полимеризации. Цепная реакция идёт до тех пор, пока не встретятся два радикала, которые после взаимодействия образуют обычную ковалентную связь. В растущую полимерную цепь по аналогичному механизму могут встраиваться случайным образом молекулы бис-акриламида. Имея в своём составе две винильных группы на разных концах молекулы, МБА может оказаться встроенным в две различные полимерные цепочки, образуя между ними сшивку (рисунок 1). Это приводит к образованию пористого геля, размер пор которого зависит от условий полимеризации и концентрации мономеров растворе.
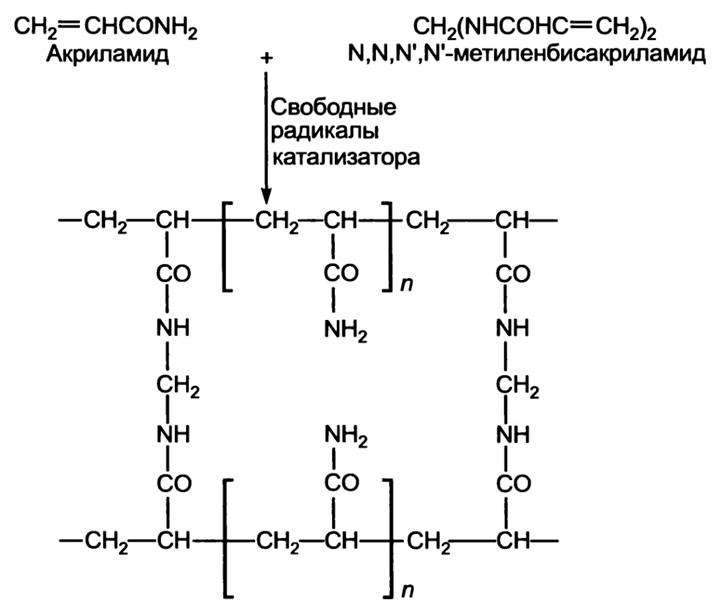
рис.1
Источником свободных радикалов также может служить рибофлавин, нередко используемый вместе с ПА и ТЕМЕД. Под действием света он присоединяет водород и восстанавливается до лейкорибофлавина, который, в свою очередь, окисляется в присутствии кислорода с образованием перекиси водорода. Разложение перекиси приводит к образованию OH˙ радикалов, которые дают начало полимеризации акриламида. Такой механизм часто называют фотохимической полимеризацией.

рис 2 . фото: сканирующая электронная микроскопия (Hitachi S4500) 7,5% ПААГ (а) изнутри _150нм; (B) на поверхности_400нм. Источник: Yuan C., Rhoades E., Heuer D.M., Saha S., Lou X.W., Archer L.A. (2006) Comprehensive Interpretation of Gel Electrophoresis Data. Analytical Chemistry, 78(17), 6179-6186.
Кислород уничтожает свободные радикалы, и поэтому раствор геля обычно дегазируют (еще до использования раствор геля помещают на короткое время в вакуум для удаления растворенного воздуха). Дегазирование раствора геля служит и другой цели. Полимеризация акриламида — экзотермическая реакция (т. е. протекает с выделением тепла), и нагревание геля при его отвердевании может сопровождаться высвобождением пузырьков воздуха, которые остаются включенными в полимеризующийся гель. Дегазирование предотвращает это.
Фотополимеризация представляет собой альтернативный метод полимеризации акриламидного геля. Персульфат аммония и ТЕМЕД заменяют рибофлавином, а залитый гель помещают на яркий свет на 2-3 ч. Фоторазложение рибофлавина происходит с образованием свободных радикалов, инициирующих полимеризацию.
Акриламидные гели характеризуют, указывая долю акриламида; размер пор в геле может варьировать в результате изменения концентрации как акриламида, так и бисакриламида. Акриламидный гель готовят с содержанием акриламида от 3% до 30%.
Таким образом, гель с низким содержанием акриламида (4%) имеет поры большого размера и используется, например, для электрофореза белков, когда требуется свободное движение белков, например для изоэлектрофокусирования или в концентрирующем полиакриламидном геле с додецилсульфатом натрия (SDS, sodium dodecyl sulfate). Низкопроцентные акриламидные гели также используются для разделения ДНК. Гели с содержанием акриламида 10-20% применяют в таких методах, как гель-элекрофорез с SDS, где поры малого размера выполняют роль сита, пропуская молекулы небольших белков.
4. Растворы для ПААГ
30% раствор мономеров (акриламид /бисакриламид) хранить при 4°С в темном месте до 30 дней
1,5 Мтрис- HCl буферрН 8,8 (для разделяющего геля) хранить при 4°С
0,5 М трис-HCl буфер рН 6,8 (для концентрирующего геля) хранить при 4°С
10% раствор SDS (10 г SDS +60 мл дист. воды, аккуратно растворить без образования пены, затем довести до 100 мл дист. водой)
10% раствор персульфата аммония (100 мг ПА на 1 мл воды, готовить непосредственно перед использованием! каждый раз новый!)
50% р-р глицерина
0,5% бромфеноловый синий (БФС)
Буфер для пробы (Vобщ =9,5 мл):
2 мл 10% SDS,
1,25 мл 0,5 М трис-HCl буфер рН 6,8,
2,5 мл глицерина,
0,2 мл 0,5% БФС,
3,55 мл дист. воды
Хранить при комнатной температуре!
 Акриламид мономер - нейротоксин!!! Работать с раствором в перчатках!!!
Акриламид мономер - нейротоксин!!! Работать с раствором в перчатках!!!
Взвешивать в маске!!!
Акриламид постепенно гидролизуется до акриловой кислоты и аммиака – не хранить более
30 дней (обязательно проставить дату на этикетке!).
5. Приготовление геля
Для приготовления 10 мл мономера:
|
|
Концентрирующий гель (КГ) |
Разделяющий гель (РГ) |
|
Реагент |
Концентрация геля 5 % |
Концентрация геля 10 % |
|
Вода дистил. |
5,7 мл |
4,1 мл |
|
30% р-р мономеров |
1,7 мл |
3,3 мл |
|
10% SDS |
0,1 мл |
0,1 мл |
|
0,5 М трис-HCl буфер рН 6,8 |
2,5 мл |
- |
|
1,5М трис-HCl буфер рН 8,8 |
- |
2,5 мл |
|
Внимание! если у вас все готово к заливке геля -добавить темед и персульфат |
||
|
ТЕМЕД |
10 мкл |
10 мкл |
|
Персульфат аммония |
100 мкл |
100 мкл |
|
ДЕГАЗИРОВАТЬ! (добавить воду ) |
|
|
|
Условия проведения электрофореза |
U = 90 В |
U = 180 В (140 В) |
Компоненты
раствора следует перемешать тщательно, но осторожно, не допуская образования
пузырей. Персульфат
аммония и TEMED добавляют последними - именно эти два
компонента инициируют полимеризацию
акриламида.
6. Подготовка образца
Буфер для пробы (Vобщ =9,5 мл):
2 мл 10% SDS,
1,25 мл 0,5 М трис-HCl буфер рН 6,8,
2,5 мл глицерина,
0,2 мл 0,5% БФС,
3,55 мл дист. воды
-Перед использованием добавить 50 мкл β-меркаптоэтанол или ДТТ к 950 мкл буфера для пробы
Растворить пробу в буфере в соотношении 1:2 и инкубировать при температуре 100°С в течение 5 минут.
(Важно! буфер после добавления β-меркаптоэтанола или ДТТ хранить только в холодильнике!)
В карман геля вносить 20 мкл пробы.


7. Подготовка камеры для геля
Вымыть камеры детергентом, хорошо сполоснуть;
Собрать "сэндвич" из стеклянных пластин,


Загерметизировать низ камеры для геля

Закрепить ее вертикально
непосредственно на форезном столике,

Приготовленную смесь РГ 10% аккуратно залить между стекол, закрепленных
вертикально в аппарате для электрофореза на 2/3. За полимеризацией наблюдать по
оставшемуся в пробирке раствору. На поверхность геля наслоить насыщенный
концентрирующим буфером изобутанол (если это допускает инструкция к форезному аппарату) или воду слоем
не менее
5 мм (полимеризация акриламида не идет в присутствии кислорода) и оставить гель
для полимеризации не менее чем на 15-25 минут;


Затем убрать воду

и залить КГ 5% , вставить гребенку и оставить гель для полимеризации не менее чем на 15-25 минут;


За
полимеризацией наблюдать по оставшемуся в пробирке раствору.

8. Сборка установки для электрофореза









ВНИМАНИЕ!!! БУФЕР ПОСЛЕ ПРОЦЕДУРЫ ЭЛЕКТРОФОРЕЗА АККУРАТНО СЛИТЬ В ЕМКОСТЬ ДЛЯ ХРАНЕНИЯ И УБРАТЬ В ХОЛОДИЛЬНИК!!! (БУФЕРНЫЙ РАСТВОР МНОГОРАЗОВОГО ИСПОЛЬЗОВАНИЯ!!!)
9. Фиксация и окраска геля
После окончания электрофореза сразу выполнить фиксацию! (обязательно перед окраской!)
Поместить гель в раствор для фиксации на 10-15 мин: 25 мл ледяной уксусной кислоты: 50 мл этанола : 25мл дистиллированной воды.
Окрашивание геля с помощью красителя Coomassie Brilliant Blue R-250 (чуствительность 0.3-1.0 p,g белка).
Поместить гель в раствор для окрашивания (Кумасси R 250 + уксусная кислота) на 30 мин.
Затем в отмывочный р-р на 24 ч (метанол + ледяная уксусная)