КОС
| Сайт: | Электронный информационно-образовательный портал ВолгГМУ |
| Курс: | Медицинская биохимия (10 семестр) |
| Книга: | КОС |
| Напечатано:: | Гость |
| Дата: | Среда, 29 октября 2025, 12:58 |
1. Введение
Большая часть ферментативных реакций в организме протекает в узком диапазоне pH (7,30—7,50).
Метаболическая активность клеток, функция ферментов и стабильность мембран зависит, кроме прочего, от т.н. рН, который является главным показателем КОС.
В клетках рН может значительно варьировать (4,5 в предстательной железе и 8,5 в остеобластах).
Кислотно-основное состояние и водно-электролитный обмен и объединены законами электронейтральности и изоосмолярности.
Закон электронейтральности подразумевает, что суммарная концентрация катионов (Na, Мg, К, Са, Н) и анионов (Сl, НСО3, РО4, SO4 , анионы белков и органических кислот) составляет 155 ммоль/л тех и других ионов, а, следовательно, суммарно в плазме содержится ионов 310 ммоль/л = 310 мосм/л.
Из общего количества катионов плазмы на долю Na приходится 142 ммоль/л.
В группе анионов плазмы 103 ммоль/л составляют ионы Сl- (слабое основание), [НСО3-] и белки представляют собой сильные буферные основания. На их долю приходится соответственно 27 ммоль/л и 15 ммоль/л.
2. Буферные растворы
Буферная система представляет собой сочетание слабой кислоты и соли, образованной этой кислотой и сильным основанием. При включении буферных систем происходит замена сильной кислоты (или основания) на слабую, количество свободных ионов [Н+] уменьшается. Например:
НСl + NаНСО3 = Н2СО3 + NаСl
В плазме крови наиболее значимы бикарбонатная и белковая буферные системы, слабые буферные кислоты которых находятся в равновесии в основном с натриевыми солями этих кислот. В клеточном секторе преимущественное значение имеют фосфатная и белковая (в эритроцитах - гемоглобиновая) буферные системы, при этом буферные основания представлены в основном калийными солями фосфорной кислоты и белков.
В качестве буферных смесей могут быть использованы системы:
- слабая кислота и её соль с сильным основанием, например, ацетатный буфер СН3СООН + CH3COONa
- слабое основание и его соль с сильной кислотой, например, аммиачный буфер NH4OH + NH4Cl
- кислая соль и средняя соль слабой кислоты с сильным основанием, например, карбонатный буфер Na2CO3 + NaHCO3
pH определяется уравнением Гендерсона—Гассельбальха:
рН = рК + основания/кислоты
Значение pH буферных растворов можно рассчитать по формулам:
- Для слабой кислоты HA и её соли с сильным основанием BA
- Для слабого основания BOH и его соли с сильной кислотой HA
Например, pH аммиачного буферного раствора NH4OH + NH4Cl определяется формулой:
pH карбонатного буферного раствора выражается формулой:
для крови
pH крови = 6,1 + lg [HCO3–]/(pCO2 х 0,03)
Где:
6,1 – рК углекислоты при 38оС и рН 7,4.
0,03 – т.н. константа растворимости CO2
pCO2 х 0,03= Н2СО3
Буферная ёмкость
Буферные растворы сохраняют своё действие только до определённого количества добавляемой кислоты, основания или степени разбавления, что связано с изменением концентраций его компонентов.
Способность буферного раствора сохранять свой pH определяется её буферной ёмкостью — в г-экв. сильной кислоты или основания, которые следует прибавить к 1 л буферного раствора, чтобы его pH изменился на единицу. Буферная ёмкость тем выше, чем больше концентрация его компонентов.
Буферная ёмкость π определяется по формуле
где dx — концентрация введённой сильной кислоты (основания)
Область буферирования — интервал pH, в котором буферная система способна поддерживать постоянное значение pH. Обычно он равен pKa±1.
3. Генерация Н+ в биологических системах
Метаболизм
– постоянный источник веществ, изменяющих рН.
3.1. Конечные продукты метаболизма, влияющие на КОС
|
Углеводы аэробный метаболизм |
Н2О + СО2 |
|
Углеводы анаэробный метаболизм |
Молочная к-та |
|
Жиры и фосфолипиды |
Н2О + СО2 + Н2РО4- |
|
Белки |
Н2О + СО2+ Н2SО4 + НCl |
3.2. Общий путь катаболизма
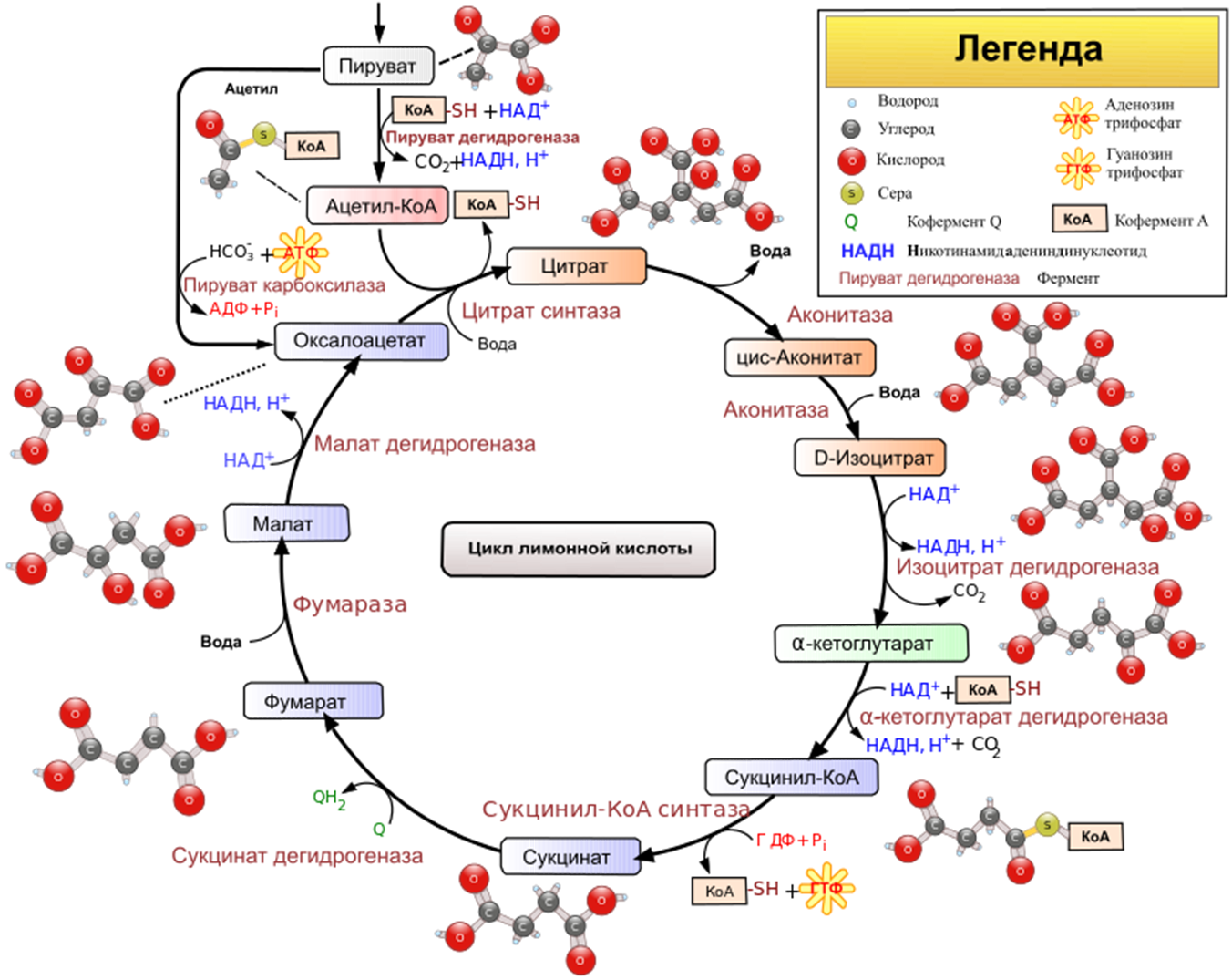
3.3. Газообмен и карбоангидразная реакция
Газообмен происходит по градиенту концентраций
Обмен кислорода и углекислого газа в тканях
В тканях диффундирующий в кровь из клеток СО2 большей частью (около 90%) по градиенту концентрации попадает в эритроциты. Движущей силой этого процесса является быстрая, постоянно идущая реакция превращения его в угольную кислоту при участии фермента карбоангидразы. Угольная кислота диссоциирует и подкисляет содержимое эритроцита, что улучшает отдачу оксигемоглобином кислорода (Эффект Бора).
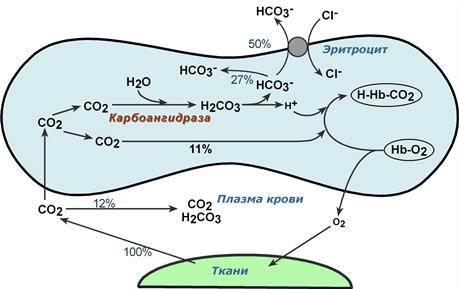
Реакции газообмена в капиллярах тканей
Одновременно с концевыми NH2-группами β-цепей гемоглобина связывается 10-12% двуокиси углерода (CO2) с образованием карбаминогемоглобина (H-HbCO2).
Остальные бикарбонаты выходят в плазму крови в обмен на ионы хлора (гипохлоремический сдвиг).
Таким образом, в составе карбаминогемоглобина транспортируется 10-12% CO2, в растворенном состоянии в плазме крови также до 12%, остальная часть находится в виде растворенного карбонат-иона (HCO3–) в плазме и эритроците, примерно поровну (соотношение 9 : 7).
Обмен кислорода и углекислого газа в легких
В легких в альвеолярном воздухе имеется высокая концентрация кислорода и относительно низкая концентрация углекислого газа. Поэтому происходит быстрая диффузия СО2 из плазмы через альвеолярные мембраны и его удаление с выдыхаемым воздухом,
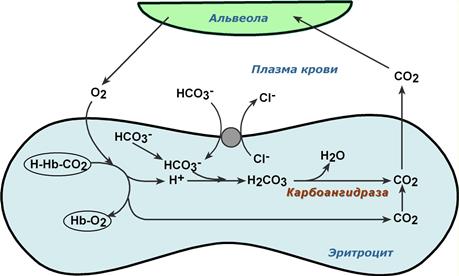
Реакции газообмена в легочных капиллярах
Далее
- уменьшение концентрации СО2 в плазме стимулирует его образование в карбоангидразной реакции внутри эритроцита и снижает здесь концентрацию иона HCO3–,
- одновременно высокая концентрация кислорода вытесняет СО2 из комплекса с гемоглобином с образованием оксигемоглобина – более сильной кислоты, чем угольная,
- диссоциирующие от оксигемоглобина ионы Н+ нейтрализуют поступающий из-вне ион HCO3– с образованием угольной кислоты. После карбоангидразной реакции образуется СО2, который выводится наружу.
4. НАРУШЕНИЯ КИСЛОТНО- ЩЕЛОЧНОГО РАВНОВЕСИЯ
Показатели кислотно-щелочного равновесия
Показатели КЩР подразделяют на основные и дополнительные (табл. 13-1).
• Основные показатели. Оценку КЩР и его сдвигов в клинической практике проводят с учётом нормальных диапазонов его основных показателей: pH, pCO2, стандартного бикарбоната плазмы крови, буферных оснований и избытка оснований капиллярной крови.
• Дополнительные показатели. С целью выяснения причины и механизма развития негазовых форм нарушений КЩР определяют ряд дополнительных показателей крови (КТ, МК) и мочи (титруемая кислотность - ТК и аммиак).
Таблица 13-1. Показатели кислотно-щелочного равновесия
 Окончание табл. 13-1
Окончание табл. 13-1
Дополнительные | ||
КТ крови МК крови ТК суточной мочи Аммиак суточной мочи | 5-25 мг/л 0,3-1,3 ммоль/л 20-40 мэкв/сут 10-107 ммоль/сут | 0,5-2,5 мг% 6-16 мг% 20-40 ммоль/л 30-50 ммоль/л |
Механизмы регуляции кислотно-щелочного равновесия
В норме в организме образуется почти в 20 раз больше кислых продуктов, чем щелочных. В связи с этим доминируют системы, обеспечивающие нейтрализацию, экскрецию и секрецию избытка соединений с кислыми свойствами. К этим системам относятся химические буферные системы и физиологические механизмы регуляции КЩР.
ХИМИЧЕСКИЕ БУФЕРНЫЕ СИСТЕМЫ
Химические буферные системы представлены, в основном, бикарбонатным, фосфатным, белковым и гемоглобиновым буферами. Буферные системы начинают действовать сразу же при увеличении или снижении [H+] и способны устранить умеренные сдвиги КЩР в течение 10-40 с. Ёмкость и эффективность буферных систем крови весьма высока (табл. 13-2).
Таблица 13-2. Относительная ёмкость буферов крови (в %)
Плазма крови | Эритроциты | |
Гидрокарбонатный Гемоглобиновый Белковый Фосфатный Общая ёмкость | 35 7 1 43 | 18 35 4 57 |
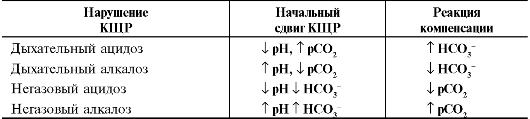
Принцип действия химических буферных систем заключается в трансформации сильных кислот и сильных оснований в слабые. Гидрокарбонатная буферная система - основной буфер крови и межклеточной жидкости. Гидрокарбонатный буфер внеклеточной жидкости состоит из смеси угольной кислоты - H2CO3 и гидрокарбоната натрия - NaHCO3. В клетках в состав соли угольной кислоты входят калий и магний. Гидрокарбонатный буфер - система открытого типа, она ассоциирована с функцией внешнего дыхания и почек (табл. 13-3).
Таблица 13-3. Начальные сдвиги и компенсаторные реакции при нарушениях кислотно-щелочного равновесия
 Фосфатная буферная система играет существенную роль в регуляции КЩР внутри клеток, особенно - канальцев почек. Это обусловлено более высокой концентрацией фосфатов в клетках по сравнению с внеклеточной жидкостью. Фосфатный буфер состоит из двух компонентов: щелочного - (Na2HPO4) и кислого - (NaH2PO4). Белковая буферная система - главный внутриклеточный буфер. На его долю приходится примерно три четверти буферной ёмкости внутриклеточной жидкости. Компонентами белкового буфера являются слабодиссоциирующий белок с кислыми свойствами (белок-COOH) и соли сильного основания (белок-COONa).
Фосфатная буферная система играет существенную роль в регуляции КЩР внутри клеток, особенно - канальцев почек. Это обусловлено более высокой концентрацией фосфатов в клетках по сравнению с внеклеточной жидкостью. Фосфатный буфер состоит из двух компонентов: щелочного - (Na2HPO4) и кислого - (NaH2PO4). Белковая буферная система - главный внутриклеточный буфер. На его долю приходится примерно три четверти буферной ёмкости внутриклеточной жидкости. Компонентами белкового буфера являются слабодиссоциирующий белок с кислыми свойствами (белок-COOH) и соли сильного основания (белок-COONa).
Гемоглобиновая буферная система - наиболее ёмкий буфер крови. Гемоглобиновый буфер состоит из кислого компонента - оксигенированного HbO2 и основного - неоксигенированного Hb. Карбонаты костной ткани функционируют как депо для буферных систем организма. В костях содержится большое количество солей угольной кислоты: карбонаты кальция, натрия, калия и др. При быстром увеличении содержания кислот (например, при острой сердечной, дыхательной или почечной недостаточности; шоке, коме и других состояниях) костная ткань может обеспечивать до 30-40% буферной ёмкости.
ФИЗИОЛОГИЧЕСКИЕ МЕХАНИЗМЫ
Наряду с мощными и быстродействующими химическими системами в организме функционируют органные механизмы компенсации и устранения сдвигов КЩР. Для их реализации и достижения необходимого эффекта требуется больше времени - от нескольких минут до нескольких часов. К наиболее эффективным физиологическим механизмам регуляции КЩР относят процессы, протекающие в лёгких, почках, печени и ЖКТ.
Лёгкие обеспечивают устранение или уменьшение сдвигов КЩР путём изменения объёма альвеолярной вентиляции.Почки способствуют устранению сдвигов КЩР крови с помощью ацидогенеза, аммониогенеза, секреции фосфатов и К+,Na+-обменно-
го механизма, которые сопряжены с образованием гидрокарбоната и поступлением его в плазму крови.
Печень играет существенную роль в компенсации сдвигов КЩР. В ней протекают, помимо общих для всего организма, специфические реакции метаболизма, участвующие в регуляции КЩР:
♦ Синтез белков крови, входящих в белковую буферную систему.
♦ Образование аммиака, способного нейтрализовать кислоты как в самих гепатоцитах, так и в плазме крови и в межклеточной жидкости.
♦ Синтез глюкозы из «кислых» неуглеводных веществ - аминокислот, глицерина, лактата, пирувата.
♦ Выведение из организма нелетучих кислот - глюкуроновой и серной при детоксикации продуктов метаболизма и ксенобиотиков.
♦ Экскреция в кишечник кислых и основных соединений с жёл- чью.
Желудок участвует в коррекции сдвигов КЩР, главным образом, путём изменения секреции соляной кислоты: при защелачивании жидких сред организма этот процесс тормозится, а при закислении - усиливается.
Кишечник способствует уменьшению сдвигов КЩР посредством нескольких механизмов.
♦ Секреции кишечного сока, содержащего большое количество гидрокарбоната. При этом в плазму крови поступает H+.
♦ Изменении количества всасываемой жидкости, что способствует нормализации водного и электролитного баланса в клетках и биологических жидкостях.
♦ Реабсорбции компонентов буферных систем (Na+, K+, Ca2+, Cl-, HCO3).
ТИПОВЫЕ ФОРМЫ НАРУШЕНИЙ КИСЛОТНОЩЕЛОЧНОГО РАВНОВЕСИЯ
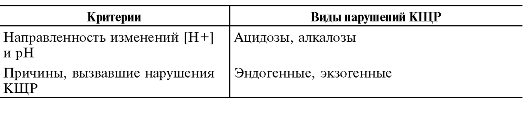
Расстройства КЩР дифференцируют по нескольким критериям (табл. 13-4).
Таблица 13-4. Виды нарушений кислотно-щелочного равновесия
 Окончание табл. 13-4
Окончание табл. 13-4
 Ацидоз и алкалоз
Ацидоз и алкалоз
Ацидоз - типовая форма нарушения КЩР, характеризующаяся относительным или абсолютным избытком в организме кислот.
В крови при ацидозе происходит абсолютное или относительное повышение [H+] и уменьшение pH ниже нормы (условно - ниже нейтральной величины pH, принимаемой за 7,39).
Алкалоз - типовая форма нарушения КЩР, характеризующаяся относительным или абсолютным избытком в организме оснований.
В крови при алкалозе отмечается абсолютное или относительное снижение [H+] и увеличение pH (условно - выше нейтральной величины pH, принимаемой за 7,39).
Компенсированные и некомпенсированные нарушения КЩР
Определяющим параметром степени компенсированности нарушений КЩР является величина pH.
• Компенсированными сдвигами КЩР считают такие, при которых pH крови не отклоняется за пределы диапазона нормы: 7,35-7,45. За «нейтральную» величину условно принимают 7,39. При компенсированных формах нарушений КЩР изменяется абсолютная концентрация компонентов гидрокарбонатной буферной системы. Однако, соотношение [H2CO3]/[NaHCO3] сохраняется 20/1.
♦ При pH 7,38-7,35 - компенсированный ацидоз.
♦ При pH 7,40-7,45 - компенсированный алкалоз.
• Некомпенсированными нарушениями КЩР называют такие, при которых pH крови выходит за диапазон нормы. Некомпенсированные ацидозы и алкалозы характеризуются значительными отклонениями как абсолютной концентрации H2CO3 и NaHCO3, так и их соотношения.
♦ При pH 7,34 и ниже - некомпенсированный ацидоз.
♦ При pH 7,46 и выше - некомпенсированный алкалоз.
Газовые расстройства кислотно-щелочного равновесия
Газовые (респираторные) расстройства КЩР характеризуются первичным изменением содержания в организме CO2 и, как следствие, - концентрации угольной кислоты в соотношении: [HCO3-]/[H2CO3]. Угольная кислота диссоциирует с образованием H+. При газовом ацидозе концентрация угольной кислоты увеличивается, при газовом алкалозе - уменьшается.
Респираторный ацидоз характеризуется снижением pH крови и гиперкапнией (повышением рСО2 крови более 40 мм рт.ст.). Причина: гиповентиляция лёгких (например, при спазме бронхиол или обтурации дыхательных путей).
Респираторный алкалоз характеризуется увеличением pH крови и гипокапнией (уровень рСО2 крови 35 мм рт.ст. и менее). Причина: гипервентиляция лёгких (например, при проведении ИВЛ).
Негазовые нарушения кислотно-щелочного равновесия
Негазовые (нереспираторные) нарушения КЩР характеризуются первичным изменением содержания гидрокарбоната в соотношении: [HCO3-]/[H2CO3]. При негазовых ацидозах концентрация гидрокарбонатов уменьшается, а при негазовых алкалозах - увеличивается.
Выделяют три группы негазовых расстройств КЩР: метаболические, выделительные и экзогенные (табл. 13-4).
МЕТАБОЛИЧЕСКИЕ РАССТРОЙСТВА КЩР
Метаболический ацидоз - одна из наиболее частых форм нарушения КЩР.
Причины метаболического ацидоза.
♦ Нарушения метаболизма, приводящие к накоплению избытка нелетучих кислот и других веществ с кислыми свойствами (например, при сердечной недостаточности, большинстве типов гипоксии).
♦ Недостаточность буферных систем и физиологических механизмов по нейтрализации и выведению избытка нелетучих кислот из организма (например, при печёночной или почечной недостаточности, гипопротеинемии).
Метаболический алкалоз характеризуется повышением pH крови и увеличением концентрации бикарбоната в результате расстройств обмена ионов Na+, Ca2+ и К+.
• Причины
♦ Гиперальдостеронизм приводит к гипернатриемии и гипокалиемии.
♦ Гипофункция паращитовидных желёз сопровождается гипокальциемией и гиперфосфатемией.
• Механизмы развития
♦ Избыточная секреция эпителием канальцев почек в первичную мочу H+ и К+, а также реабсорбция Na+ из первичной мочи в кровь (вследствие изменения активности Na+,К+-АТФазы под влиянием альдостерона).
♦ Накопление в клетках H+ с развитием внутриклеточного ацидоза.
♦ Задержка в клетках Na+ и гипергидратация клеток в связи с гиперосмией.
ВЫДЕЛИТЕЛЬНЫЕ РАССТРОЙСТВА КЩР
Выделительные расстройства КЩР являются результатом нарушения выделения из организма кислот либо оснований.
Выделительные ацидозы
Различают три вида выделительных ацидозов.
• Почечный выделительный ацидоз (накопление в организме кислот, потеря оснований) возникает вследствие почечной недостаточности, интоксикации сульфаниламидами, гипоксии ткани почек.
• Кишечный выделительный ацидоз (потеря организмом оснований) развивается вследствие диареи, фистулы или открытой раны тонкого кишечника.
• Гиперсаливационный выделительный ацидоз (потеря организмом оснований) связан со стоматитами, токсикозом беременных, гельминтозами, отравлением никотином или препаратами ртути.
Выделительные алкалозы
Существует три вида выделительных алкалозов.
• Желудочный выделительный алкалоз развивается вследствие потери организмом HCl при рвоте желудочным содержимым (например, при токсикозе беременных, пилороспазме, пилоростенозе, кишечной непроходимости) или отсасывании его через зонд.
• Почечные (ренальные) выделительные алкалозы обусловлены выведением из организма Na+ и задержкой гидрокарбоната почками.
♦ Торможение реабсорбции Na+ и воды под влиянием диуретиков (например, фуросемида) приводит к выведению из организма Na+, а вместе с ним и Cl- в повышенном количестве, а содержание щелочных анионов гидрокарбоната в плазме крови возрастает.
♦ Наличие в клубочковом фильтрате почек плохо реабсорбируемых ионов (анионов нитрата, сульфата, продуктов метаболизма пенициллина). Накопление плохо реабсорбируемых анионов в первичной моче сопровождается усилением экскреции почками К+ и H+ и реабсорбции HCO3-.
• Кишечный (энтеральный) выделительный алкалоз развивается вследствие повышенного выделения из организма К+кишечником (например, при злоупотреблении слабительными), что стимулирует транспорт в клетки H+ из межклеточной жидкости и плазмы крови, где развивается алкалоз.
ЭКЗОГЕННЫЕ РАССТРОЙСТВА КЩР
Эти расстройства КЩР развиваются в результате попадания в организм экзогенных агентов с кислыми или основными свойствами.
Экзогенный ацидоз
Экзогенный ацидоз является следствием поступления в организм соединений с кислыми свойствами.
• Причины:
♦ Приём растворов нелетучих кислот (например, соляной, серной, азотной) по ошибке, либо с целью отравления.
♦ Продолжительное употребление продуктов питания и питья, содержащих большое количество кислот (например, лимонной, яблочной, соляной, салициловой).
♦ Применение ЛС, содержащих кислоты или их соли (например, ацетилсалициловой кислоты).
♦ Трансфузия препаратов донорской крови, консервированной лимоннокислым натрием.
• Механизмы развития:
♦ Диссоциация экзогенных кислот и их солей ведёт к увеличению концентрации H+ в организме и быстрому истощению буферных систем.
♦ Нарушения обмена веществ под влиянием экзогенных кислот сопровождаются накоплением эндогенных кислых метаболитов.
♦ Повреждение печени и почек потенцирует степень ацидоза.
Экзогенный алкалоз
Экзогенный алкалоз - сравнительно редкое нарушение КЩР - является, как правило, следствием попадания в организм избытка гидрокарбоната либо щелочей.
• Причины:
♦ Введение в течение короткого времени избытка HCO3--содержащих растворов (например, при коррекции лактатацидоза или кетоацидоза у пациентов с СД).
♦ Продолжительное использование продуктов питания и питья, содержащих большое количество щелочей. Наблюдается у пациентов с язвенной болезнью желудка, принимающих в больших количествах щелочные растворы и молоко.
• Механизм развития. Основное звено патогенеза экзогенного алкалоза - увеличение концентрации HCO3- в плазме крови.
Смешанные расстройства кислотно-щелочного равновесия
В клинической практике нередко наблюдают комбинацию газовых и негазовых ацидозов или алкалозов одновременно. Примеры подобных состояний:
• Сердечная недостаточность. У пациента может развиться смешанный ацидоз: газовый (в связи с нарушением перфузии альвеол и отёком лёгких) и негазовые: метаболический (в результате циркуляторной гипоксии) и выделительный почечный (обусловленный гипоперфузией почек).
• Травма головного мозга или беременность. Наблюдается смешанный алкалоз: газовый (вызванный гипервентиляцией лёгких) и негазовый: выделительный желудочный (вследствие повторной рвоты желудочным содержимым).
Проявления и механизмы компенсации нарушений кислотно-щелочного равновесия
ПРОЯВЛЕНИЯ РАССТРОЙСТВ КЩР
Клиническая картина при нарушениях КЩР зависит, главным образом, от направленности изменений [H+] и pH.
Проявления ацидозов
♦ Компенсаторное увеличение альвеолярной вентиляции. При тяжёлом ацидозе может регистрироваться глубокое и шумное дыхание - периодическое дыхание Куссмауля.
♦ Нарастающее угнетение нервной системы и ВНД, что проявляется сонливостью, заторможённостью, сопором или комой (например, при кетоацидозе у пациентов с СД).
♦ Снижение кровотока в мозге, миокарде и почках. Это усугубляет нарушение функций нервной системы, сердца, а также обусловливает олигурию (уменьшение диуреза).
♦ Дисбаланс ионов вследствие активации компенсаторных механизмов: увеличение содержания ионов К+ в межклеточной жидкости, гиперкалиемия, гиперфосфатемия, гипохлоремия.
♦ Гиперосмолярный и отёчный синдромы.
Проявления алкалозов
♦ Недостаточность центрального и органно-тканевого кровотока.
♦ Нарушение микрогемоциркуляции, вплоть до признаков капилляро-трофической недостаточности.
♦ Гипоксия вследствие недостаточности кровообращения и увеличения сродства Hb к кислороду.
♦ Гипокалиемия в связи с транспортом K+ из межклеточной жидкости в клетки в обмен на H+.
♦ Ухудшение нервно-мышечной возбудимости, проявляющееся мышечной слабостью, нарушением перистальтики желудка и кишечника. Указанные расстройства, а также нарушения ритма сердца являются, в основном, результатом гипокалиемии.
МЕХАНИЗМЫ КОМПЕНСАЦИИ НАРУШЕНИЙ КЩР Механизмы компенсации ацидоза направлены на нейтрализацию избытка H+. Выделяют срочные и долговременные механизмы компенсации.
• Срочные механизмы: активация клеточных и внеклеточных буферов, Cl-HCO3-антипорта эритроцитов, увеличение альвеолярной вентиляции.
• Долговременные механизмы реализуются почками и печенью, буферами костной ткани, обкладочными клетками желудка.
Механизмы компенсации алкалоза обеспечивают: 1) снижение в плазме крови и в других биологических жидкостях концентрации HCO3- и 2) повышение pCO2 и, как следствие, - концентрации H2CO3. Однако, механизмы устранения алкалозов значительно менее эффективны, чем ацидозов.
• Срочные механизмы устранения алкалоза.
♦ Клеточные механизмы компенсации. Наибольшее значение среди них имеет активация реакций метаболизма с образованием нелетучих органических кислот.
♦ Внеклеточные буферные системы не имеют существенного значения в устранении алкалоза.
♦ Снижение объёма альвеолярной вентиляции. В связи с этим повышается pCO2, концентрация угольной кислоты и образующегося при её диссоциации H+.
• Долговременные механизмы компенсации алкалоза. Они реализуются при участии почек: в них происходит выведение из организма избытка HCO3-.
Принципы устранения расстройств кислотно-щелочного равновесия
Лечебные мероприятия при коррекции нарушений КЩР базируются на этиотропном, патогенетическом и симптоматическом принципах.
Респираторный ацидоз
Главная цель: уменьшение степени или ликвидация дыхательной недостаточности.
• Этиотропный принцип направлен на устранение причин ацидоза: гиповентиляции или гипоперфузии лёгких, а также сниженной диффузионной способности аэрогематического барьера. При острой дыхательной недостаточности эти мероприятия могут полностью ликвидировать ацидоз.
• Патогенетическое лечение имеет целью устранение повышенного уровня CO2 в крови и других биологических жидкостях организма. Введение содержащих гидрокарбонат буферных растворов с целью устранения хронического респираторного ацидоза неэффективно. Это объясняется тем, что экзогенный HCO3- быстро удаляется из организма почками.
• Симптоматическое лечение имеет целью устранение неприятных и тягостных ощущений, усугубляющих состояние пациента: головной боли, аритмий сердца, психомоторного перевозбуждения, избыточной потливости и других.
Респираторный алкалоз
Цель: устранение дефицита CO2 в организме.
• Этиотропное лечение осуществляется путём ликвидации причины гипервентиляции лёгких.
• Патогенетическое лечение направлено на нормализацию содержания углекислого газа в организме. С этой целью проводят ряд мероприятий.
♦ Дыхание газовыми смесями с повышенным парциальным содержанием CO2.
♦ Коррекция водно-электролитного обмена с помощью буферных растворов, состав которых зависит от конкретных расстройств обмена ионов и воды у данного пациента.
• Симптоматический принцип направлен на устранение симптомов, отягощающих состояние пациента: судорог, сердечной недостаточности, артериальной гипотензии и других.
Негазовые ацидозы
Основная цель: уменьшение содержания в организме избытка кислот и восстановление нормального содержания HCO3-.
• Этиотропный принцип подразумевает ликвидацию причины развития негазового ацидоза.
• Патогенетическое лечение направлено на нормализацию содержания в жидких средах организма HCO3-.
• Симптоматическое лечение направлено на ликвидацию головной боли, нарушений нервно-мышечной проводимости и мышечного тонуса, расстройств ритма сердца, функций ЖКТ и других симптомов.
Негазовые алкалозы
Главная цель: восстановление нормального уровня соединений с щелочными свойствами, прежде всего - гидрокарбонатов.
• Этиотропный принцип предусматривает устранение причины, вызвавшей алкалоз.
• Патогенетическое лечение направлено на блокаду ключевых звеньев патогенеза негазового алкалоза.
♦ Восстановление [H+] в организме.
♦ Устранение расстройств электролитного баланса и гиповолемии достигается парентеральным введением растворов, содержащих необходимые ионы: хлорида натрия, хлорида калия, солей кальция.
♦ Стимуляция выведения из организма избытка HCO3-. С этой целью используют ингибиторы карбоангидразы (например, диакарб), которые увеличивают экскрецию гидрокарбоната почками. У пациентов с почечной недостаточностью применяют гемодиализ.
♦ Ликвидация дефицита в клетках АТФ, креатинфосфата и снижение степени нарушения их энергетического обеспечения.
• Симптоматическое лечение направлено на устранение осложнений алкалоза и уменьшение симптоматики, усугубляющей состояние пациента.
5. Показатели КОС
- рН - показатель водородных ионов плазмы крови. Интегральный показатель, отражающий состояние буферных систем и физиологических механизмов компенсации. Изменяется при воздействии факторов, превышающих возможности этих систем.
- рСО2 - показатель парциального напряжения СО2 в крови. Отражает функциональное состояние системы дыхания.
- АВ (асtuа1 bicarbonate) - истинные бикарбонаты плазмы, то есть содержание ионов НСО3- в крови, взятой у данного больного в конкретных условиях.
- SВ (standart bicarbonate) - стандартные бикарбонаты плазмы крови. Содержание бикарбоната у данного больного, определяемое в стандартных условиях ( рС02 = 40 мм Нg, НЬО2= 100%, to=370С).
- ВВ (buffer base) - буферные основания плазмы, то есть сумма всех основных компонентов бикарбонатной, фосфатной, белковой, гемоглобиновой систем.
- ВЕ (base excess) - сдвиг буферных оснований отражает изменения содержания буферных оснований крови по сравнению с нормальным для данного больного NВB.
- NВВ - сумма всех основных компонентов буферных систем крови больного, но оцениваемая в стандартных условиях (рН = 7.38, рСО2= 40 мм Нg, (t°= 37°С).
- рH мочи - показатель водородных ионов мочи отражает функциональное состояние почек, интенсивность процессов ацидо- и аммониогенеза.
Референсные интервалы
|
Показатели |
Нормальные значения |
|
рН крови |
7,40 |
|
рСО2 |
40± 5мм Нg |
|
АВ |
19-25 ммоль/л |
|
SВ |
20-26 ммоль/л |
|
ВВ |
44-52 ммоль/л |
|
ВЕ |
±2.3 ммоль/л |
|
рН мочи |
5,0-7,0 |
6. Анионный разрыв (промежуток) Anion gap
Анионной разницей называется показатель, являющийся арифметической разницей между регулярно определяемыми в сыворотке крови анионами и катионами: 23 мэкв/л — 11 мэкв/л = 12 мэкв/л.
- Неизмеряемые анионы — это белки крови (большей частью альбумин) = 15 мэкв/л, органические кислоты = 5 мэкв/л, фосфаты = 2 мэкв/л, сульфаты = 1 мэкв/л; всего = 23 мэкв/л.
- Неизмеряемые катионы — это кальций = 5 мэкв/л, калий = 4,5 мэкв/л, магний = 1,5 мэкв/л; всего =11 мэкв/л.
Существует 2 формулы, которые можно использовать для расчета анионного промежутка.
Первая формула: Анионный промежуток = Na⁺ + K⁺ – (Cl⁻ + HCO₃⁻). Эта формула может использоваться если известно значение калия. Однако, второе выражение используется чаще.
Вторая формула: Анионный промежуток = Na⁺ – (Cl⁻ + HCO₃⁻). Здесь значением калия пренебрегли. Эта формула используется чаще других, но можете использовать любую из них, в зависимости от ваших предпочтений.
нормальное значение 8 - 12 мэкв/л без калия, и 12 - 16 мэкв/л с учетом калия
7. Алгоритм оценки нарушения КЩР.
1).По значению главного показателя – pН, выявить вид нарушения КЩР (ацидоз, алкалоз).
2).Указать по этой же цифре компенсированный сдвиг КЩР или декомпенсированный:
а) компенсированный ацидоз рН=7.35-7.40, компенсированный алкалоз рН=7.40-7.45;
б) декомпенсированный ацидоз рН<7.35, декомпенсированный алкалоз рН>7.45.
3).Установить первичное изменение показателей КЩС, определив главное звено патогенеза. Для этого сопоставить pН и основные показатели кислотно-щелочного состояния крови (рСО2 –газовые нарушения; ВВ, SB, ВЕ – негазовые нарушения):
а) газовый ацидоз - повышение pСО2 при pН <7.40;
б) газовый алкалоз – снижение pСО2 при pН > 7.40;
в) негазовый ацидоз - снижение ВВ, SB, «-»BE при pН <7.40;
г) негазовый алкалоз - повышение ВВ, SB, «+»ВЕ при pН >7.40
4).Определить механизмы компенсации, отметить наличие компенсатоpных сдвигов (вторичные изменения показателей КЩР) и их значение:
- при газовых ацидозах, алкалозах- изменение показателей ВВ, SB, ВЕ (выражены при компенсации).
- при негазовых ацидозах, алкалозах - изменение показателя pСО2 (выражены при компенсации).
5).Назвать с учетом анамнеза, возможные причины и механизмы данного нарушения, предложить принципы лечения.







