Морфофункциональная гепатология
| Сайт: | Электронный информационно-образовательный портал ВолгГМУ |
| Курс: | Медицинская биохимия (10 семестр) |
| Книга: | Морфофункциональная гепатология |
| Напечатано:: | Гость |
| Дата: | Среда, 29 октября 2025, 02:29 |
1. Введение
Печень - непарный орган массой 1300-1800 г. Она расположена под диафрагмой в правом верхнем квадранте живота. На нижней, висцеральной ее поверхности определяется короткая поперечная глубокая бороздка - ворота печени. В области ворот находятся печеночная артерия, воротная вена, желчный и лимфатический протоки.
Наиболее распространено деление органа на правую и левую доли, которые в свою очередь состоят из сегментов. Всего насчитывается 8 сегментов. К каждому из них подходят ветви воротной вены, печеночной артерии, а выходят желчный проток и печеночная вена.
На нижней поверхности печени, примыкающей к воротам, расположена небольшая хвостатая доля (спигелиева). Она соответствует первому сегменту.
Более 60% печени составляют гепатоциты. Около 15-20% клеточного состава - эндотелиальные клетки. Остальное падает на протоковые, соединительнотканные и иные клетки.
В эксперименте удаление части печени ведет к быстрой регенерации этого участка. Так, например, удаление 2/3 печени крысы ведет к восстановлению ее прежних размеров всего за несколько дней. Однако полное восстановление печени ad integrum, по-видимому, возможно при удалении не более 10% массы органа (Bucher N. et al„ 1979).
Установлено, что если хвостатая доля остается неповрежденной, то регенерация печени протекает быстрее (Foucou В. et al., 1983; Soyeux Н. et al., 1984, и др.).
Основу структуры печени составляет долька, которая формируется из клеток, в первую очередь гепатоцитов. Центр печеночной дольки - печеночная вена; радиально от нее располагаются атоциты, образуя балки. На периферии дольки, примыкая к ней, находится портальное поле с разветвлениями воротной вены, печеночной артерии и мельчайшим желчным протоком.
Распределение ферментов в различных отделах печени неодинаково. Так, по данным Е. Schmidt и F. Schmidt (1982), при преимущественном поражении центральных отделов дольки (острый алкогольный гепатит и особенно острый венозный застой) в сыворотке крови нарастает активность глутаматдегидрогеназы, при преимущественном поражении портальных трактов и прилегающих отделов печеночной дольки (острый вирусный гепатит и хронический активный гепатит) в первую очередь повышается активность аминотрансфераз.
2. Гепатоцит
В гепатоците различают васкулярный полюс, в котором при помощи микроворсин осуществляется эндоцитоз (захват веществ извне и введение их в клетку) и экзоцитоз, и билиарный полюс, где при помощи микроворсин происходит выделение веществ из клетки.
Клетка состоит из оболочки, цитоплазмы и внутриклеточных структур - органоидов. Обычно в центральной части клетки расположено ядро

Цитоплазматическая мембрана гепатоцита
Отдел мембраны, прилегающий к синусу, занимает 40-50% поверхности всей оболочки. Мембрана высокоактивна в отношении избирательного переноса веществ из крови в гепатоцит, а также из гепатоцита в кровь. Контакт между двумя соседними гепатоцитами осуществляется при помощи латеральной мембраны, занимающей 30-40% поверхности клетки. Большое количество щелей в этой мембране способствует обмену веществ между двумя соседними гепатоцитами.
В сторону желчных ходов обращена канальцевая мембрана, занимающая около 10% поверхности клетки. Мембрана образует большое количество выростов, особенно богатых щелочной фосфатазой, γ-глутамилтрансферазой и 5-нуклеотидазой, получившими вследствие этого название мембранозависимых ферментов. Ферменты обнаруживаются в различных органоидах и отделах клеток. Большинство ферментов локализуется преимущественно в определенных отделах гепатоцита.
Цитоплазма (цитозоль, гиалоплазма) составляет большую часть клетки и содержит различные органоиды, в частности пластинчатый комплекс (тельца Гольджи).
В цитоплазме обнаруживаются следующие ферменты: аланинаминотрансфераза (АлАТ); часть фермента аспартатаминотрансфераза (АсАТ); лактатдегидрогеназа (ЛДГ); сорбит-дегидрогеназа (СДГ); или L-идитолдегидрогеназа; орнитин-карбамоилтрансфераза (ОКТ); часть фермента аргиназа (Apr); часть фермента алкогольдегидрогеназа (АлДГ); γ-глутамилтрансфераза или γ-глутамилтранспептидаза (ГГТФ или ГГТП); фруктозобисфосфат-альдолаза (АЛД), глутатионтрансфераза.
Митохондрии размещены в основном около ядра и в зоне гранулярного эндоплазматического ретикулума у васкулярного полюса гепатоцита. Они производят основную энергию, необходимую для жизнедеятельности клетки. Гепатоцит особенно богат митохондриями; количество их в одной клетке достигает тысячи. В них осуществляются в значительной мере цикл Кребса, окислительное фосфорилирование и окисление жирных кислот. Клинические наблюдения над колебаниями активности глутаматдегидрогеназы дают основание предполагать прямую связь части митохондрий с пребилиарными образованиями клетки.
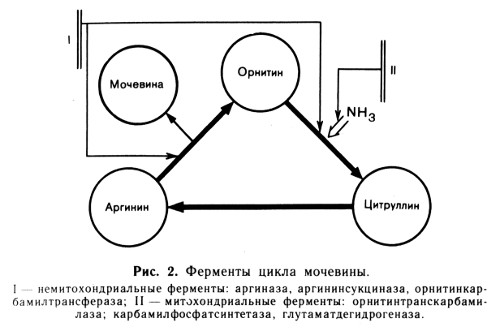
Ферменты, сосредоточенные в основном в митохондриях: часть фермента аспартатаминотрансфераза (АсАТ), глутаматдегидрогеназа (ГлДГ), часть фермента алкогольдегидрогеназа (АлДГ), карбамоилфосфатсинтетаза (КФС), орнитин-транскарбамилаза (ОТК).
До последнего времени информация по расположению ферментов внутри клетки находила применение обычно лишь в чисто диагностическом плане. Сейчас эти данные начали использовать для объяснения патогенеза отдельных синдромов. Такой подход оказался очень плодотворным при расшифровке синдрома Рея, который возникает преимущественно у детей до 10 лет под влиянием вирусных инфекций (ветряная оспа, грипп и др.) и интоксикаций (в первую очередь афлотоксином, возможно, ацетилсалициловой кислотой) и представляет собой своеобразный вариант острого жирового гепатоза с развитием тяжелых форм портально-печеночной недостаточности. Обнаружено избирательное поражение митохондрий гепатоцитов с нарушением митохондриального отрезка преобразования мочевины. Блокада двух ферментов цикла мочевины - орнитиновой транскарбамилазы и карбамоилфосфатсинтетазы - ведет к исчезновению цитруллина в печени. Таким образом, возникает перерыв последовательных преобразований в цепи аммиак - мочевина. Крайне резко возрастает концентрация аммиака сыворотки крови. Обычно при этом заболевании наблюдается тяжелая энцефалопатия, нередко регистрируется гипогликемия и рвота.
В противоположность синдрому Рея при печеночноклеточной коме в основном подавляется активность внемитохондриальных ферментов, участвующих в цикле преобразования мочевины: аргининсукцинатсинтетазы, аргининсукциназы и аргиназы
Специального обсуждения заслуживает термин "микросомы" или "микросомная фракция". По современным представлениям, к микросомам относят фрагменты мембран эндоплазматической сети, как гладкой, так и гранулярной. С момента четкого выделения двух видов эндоплазматической сети (см. ниже) несколько аморфные представления о микросомах, казалось, должны были бы в значительной мере потерять свое значение. Однако по традиции этот термин продолжают достаточно широко использовать в клинической практике. Так, выделяют премикросомальную, микросомальную и постмикросомальную желтуху, подразумевая под ними нарушения пигментного обмена до или после преобразований билирубина в гладком эндоплазматическом ретикулуме, т. е. желтуху, протекающую преимущественно с повышением в сыворотке крови концентрации билирубина, еще не подвергавшегося конъюгации, с повышением концентрации конъюгированного (прямого) билирубина и гипербилирубинемии, а также желтухи, прямо связанные с нарушением конъюгации билирубина.Гранулярный эндоплазматический ретикулум расположен в основном вокруг ядра и митохондрий. Основу зернистой цитоплазматической сети составляют цистерны, наружная поверхность которых усеяна рибосомами. В них образуются плазмопротеины, за исключением иммуноглобулинов. Синтезируемые белки, в первую очередь альбумины и фибриноген, и большая часть глобулинов через пластинчатый аппарат Гольджи выводятся из гепатоцитов в кровь. Здесь же синтезируются и основные факторы свертывания крови.
Ферменты, сосредоточенные преимущественно в гранулярном эндоплазматическом ретикулуме: холинэстераза (ХЭ), холестерол-лецитин - ацилтрансфераза.
Гладкий эндоплазматический ретикулум, или гладкая цитоплазматическая сеть, расположен вокруг ядра и митохондрий и около билиарного полюса гепатоцита. В нем осуществляются биотрансформация и конъюгация как веществ эндогенного происхождения, так и чужеродных для организма соединений (ксенобиотиков). С деятельностью этого органоида в значительной мере связано образование и накопление гликогена. Предполагается, что преимущественно здесь же осуществляется детоксикационная функция печени. В частности, в этих органоидах происходит конъюгация (соединение) токсических веществ с глюкуроновой кислотой, таким путем вещества из жирорастворимых переходят в водорастворимые. Здесь, в частности, осуществляется конъюгация билирубина. Предполагается, что цитохром Р-450, играющий важную роль в преобразовании лекарств и иных ксенобиотиков, в основном сосредоточен в этой фракции. Индикатором Р-450 служит антипириновая проба. Белковая часть глико- и липопротеидов образуется в гранулярном эндоплазматическом ретикулуме и поступает в гладкий эндоплазматический ретикулум, где используется для синтеза этих сложных белков. В этом процессе участвует также пластинчатый комплекс.
В гладком эндоплазматическом ретикулуме обнаруживают глюкозо-6-фосфатазу, билирубингликозилтрансферазу (УДФ-глюкуронилтрансферазу).
Пластинчатый комплекс (аппарат Гольджи) частично с помощью лизосом осуществляет транспорт из клетки ряда веществ, образующихся в эндоплазматическом ретикулуме. Часть этих веществ претерпевает во время транспортировки существенные преобразования. В частности, под влиянием гликозилтрансфераз к молекулам белка присоединяются углеводные комплексы. Таким путем синтезируется часть гликопротеидов или гликозаминогликанов.
Ферменты, сосредоточенные в пластинчатом комплексе, пока в сыворотке крови обычными методами не обнаружены.
Лизосомы - мембранные пузырьки, богаты кислыми гидролазами, осуществляющими расщепление крупных молекул как внутри-, так и внеклеточного происхождения. Такая судьба, в частности, ожидает нередко и бактерии, внедрившиеся в гепатоцит. Лизосомы тесно связаны с пластинчатым комплексом, часто расположены вблизи билиарного полюса, участвуют в секреции желчи. При обычно врожденном нарушении ферментных систем лизосом искажаются нормальные превращения (катаболизм) ряда липидов и гликогена. В случае подобных нарушений эти вещества начинают накапливаться в клетках, вызывая ряд заболеваний, в частности болезнь Гоше, связанную с врожденной недостаточностью лизосомного фермента глюкозилцерамид-β-глюкозидазы (Р - glc). Велика заинтересованность лизосом в патологических процессах при болезни Вильсона - Коновалова.
Резкие изменения pH среды и повреждения лизосом могут приводить к активации гидролаз и разрушению клетки. Таковы, в частности, элементы патогенеза субмассивных и массивных некрозов печени.
Ферменты, сосредоточенные в основном в лизосомах: кислая фосфатаза, катепсин D, β-глюкуронидаза, β-гексозаминидаза, α-глюкозидаза, рибонуклеаза, дезоксирибонуклеаза.
Микроворсинки билиарного полюса гепатоцита формируют истоки желчных канальцев, играют важную роль в выведении продуктов жизнедеятельности гепатоцитов.
Ферменты, сосредоточенные в основном в микроворсинках: щелочная фосфатаза (ЩФ), 5-нуклеотидаза (5-НТ), аланинаминопептидаза (ААП), γ-глутамилтрансфераза или γ-глутамилтранспептидаза (часть ее сосредоточена в цитоплазме).
Взаимоотношения желчных капилляров (канальцев) и микроворсинок играют важную роль в нормальной секреции желчи. Стенки желчного капилляра образованы канальцевыми отделами мембран гепатоцитов. От места появления эпителия желчного хода и формирования таким путем самостоятельной стенки желчного канала этот отрезок желчевыводящих путей называется мельчайшим желчным протоком.3. Кле́тки Купфера
Кле́тки Купфера (синонимы: клетки Бровича — Купфера, клетки береговые, клетки синусоидные, клетки эндотелиальные звездчатые) — специализированные макрофаги печени, являющиеся частью ретикулоэндотелиальной системы. Основной функцией клеток Купфера является захват и переработка старых нефункциональных клеток крови. При этом разрушаются молекулы гемоглобина, их глобиновые цепи повторно утилизируются, а гем расщепляется на железо и билирубин.
Названы в честь Карла Вильгельма Купфера, впервые описавшего их в 1876 году
4. Клетки Ито
Клетки Ито (синонимы: звёздчатая клетка печени, жирозапасающая клетка, липоцит, англ. Hepatic Stellate Cell, HSC, Cell of Ito, Ito cell) — перициты, содержащиеся в перисинусоидальном пространстве печёночной дольки, способные функционировать в двух различных состояниях — спокойном и активированном. Активированные клетки Ито играют главную роль в фиброгенезе — формировании рубцовой ткани при повреждениях печени.
В неповрежденной печени, звёздчатые клетки находятся в спокойном состоянии. В таком состоянии клетки имеют несколько выростов, охватывающих синусоидный капилляр. Другой отличительной чертой клеток является присутствие в их цитоплазме запасов витамина А (ретиноида) в форме жировых капель. Спокойные клетки Ито составляют 5-8 % численности всех клеток печени.[1]
Выросты клеток Ито подразделяются на два типа: перисинусоидальные (субэндотелиальные) и интергепатоцеллюлярные. Первые выходят из тела клетки и простираются вдоль поверхности синусоидного капилляра, охватывая его тонкими пальцеобразными ответвлениями. Перисинусоидальные выросты покрыты короткими ворсинками и имеют характерные длинные микровыбросы, простирающиеся ещё дальше по поверхности эндотелиальной трубки капилляра. Интергепатоцеллюлярные выросты, преодолев пластинку гепатоцитов и достигнув соседнего синусоида, делятся на несколько перисинусоидальных выростов. Таким образом, клетка Ито в среднем охватывает чуть больше двух соседних синусоидов.[2]
При повреждении печени клетки Ито переходят в активированное состояние. Активированный фенотипхарактеризуется пролиферацией, хемотаксисом, сокращаемостью, потерей запасов ретиноида[3] и образованием клеток, напоминающих миофибробластные. Активированные звёздчатые клетки печени также демонстрируют повышенное содержание новых генов, таких как α-SMA, ICAM-1, хемокины и цитокины. Активация свидетельствует о начале ранней стадии фиброгенеза и предшествует повышенному продуцированию ЕСМ-белков. Финальная стадия заживления печени характеризуется усиленным апоптозом активированных клеток Ито, вследствие чего их количество резко сокращается.[4]
Для визуализации клеток Ито при микроскопии применяется окрашивание хлоридом золота. Установлено также, что надёжным маркером для дифференциации этих клеток от других миофибробластов является экспрессия ими белка рилин.[5]
История
В 1876 году Карл Фон Купфер описал клетки, названные им «Sternzellen» (звёздчатые клетки). При окрашивании оксидом золота, в цитоплазме клеток были заметны включения. Ошибочно сочтя их фрагментами эритроцитов, захваченных путём фагоцитоза, Купфер в 1898 году пересмотрел свои взгляды о «звёздчатой клетке» как об отдельном типе клеток и отнес их в разряд фагоцитов. Однако в последующие годы регулярно появлялись описания клеток, похожих на Купферовские «звёздчатые клетки». Им присваивались различные названия: интерстициальные клетки, парасинусоидные клетки, липоциты, перициты. Роль этих клеток оставалась загадкой на протяжении 75 лет, пока профессор Тосио Ито (Toshio Ito) не обнаружил в перисинусоидальном пространстве печени человека некие клетки, содержащие вкрапления жира. Ито назвал их «shibo-sesshu saibo» — жиропоглощающие клетки. Поняв, что вкрапления были жиром, выработанным клетками из гликогена, он сменил название на «shibo-chozo saibo» — жирозапасающие клетки.[6]В 1971 Кендзиро Вакэ (Kenjiro Wake) доказал идентичность «Sternzellen» Купфера и жирозапасающих клеток Ито. Вакэ также установил, что эти клетки выполняют важную роль складирования витамина А (до этого считалось, что витамин А откладывается в клетках Купфера[7][8]). Вскоре после этого, Кент и Поппер продемонстрировали тесную связь клеток Ито с фиброзом печени. Эти открытия положили начало процессу детального изучения клеток Ито.

Вверху — схематическое изображение клетки Ито (HSC) по соседству с ближайшими гепатоцитами (PC), ниже синусоидальных эпителиальных клеток печени (EC). S — синусоид печени; KC — клетка Купфера. Внизу слева — клетки Ито в культуре под световым микроскопом. Внизу справа — электронная микроскопия позволяет разглядеть многочисленные жировые вакуоли (L) клеток Ито (HSC), в которых хранятся ретиноиды.
- ↑ Geerts A. (2001) History, heterogeneity, developmental biology, and functions of quiescent hepatic stellate cells. Semin Liver Dis. 21(3):311-35. PMID 11586463
- ↑ Wake, K. (1988) Liver perivascular cells revealed by gold- and silver-impregnation method and electron microscopy. In «Biopathology of the Liver. An Ultrastructural Approach» (Motta, P. M., ed) pp. 23-36, Kluwer Academic Publishers, Dordrecht, Netherlands
- ↑ Stanciu A, Cotutiu C, Amalinei C. (2002) New data about ITO cells. Rev Med Chir Soc Med Nat Iasi. 107(2):235-9. PMID 12638266
- ↑ John P. Iredale (2001) Hepatic Stellate Cell Behavior During Resolution of Liver Injury. Seminars in Liver Disease, 21(3):427-436 PMID 11586470 — полный текст статьи в открытом доступе (англ.) на сайте Medscape.
- ↑ Kobold D, Grundmann A, Piscaglia F, Eisenbach C, Neubauer K, Steffgen J, Ramadori G, Knittel T. (2002) Expression of reelin in hepatic stellate cells and during hepatic tissue repair: a novel marker for the differentiation of HSC from other liver myofibroblasts. J Hepatol. 36(5):607-13. PMID 11983443
- ↑ Adrian Reuben (2002) Ito becomes a star. Hepatology. Volume 35, Issue 2 , Pages 503—504 полнотекствая статья в свободном доступе (формат PDF) (англ.)
- ↑ Suematsu M, Aiso S. (2001) Professor Toshio Ito: a clairvoyant in pericyte biology. Keio J Med. 50(2):66-71. PMID 11450594 полный текст статьи в открытом доступе (формат PDF) (англ.)
- ↑ Querner F: Der mikroskopische Nachweis von Vitamin A im animalen Gewebe. Zur Kenntnis der paraplasmatischen Leberzellen-einschlüsse. Dritte Mitteilung. Klin Wschr 1935, 14:1213-1217.
5. Образование желчи
Конъюгированный билирубин секретируется гепатоцитом в желчный капилляр (каналец). Секреция осуществляется в зоне микроворсинок, к мембранам которых очень близко прилегают лизосомы и аппарат Гольджи. По современным воззрениям, желчные канальцы, микроворсинки, прилегающие к ним лизосомы и пластинчатый комплекс составляют желчьсекретирующий аппарат. Этот аппарат секретирует билирубин, холестерин, желчные кислоты, электролиты, воду и другие компоненты желчи. Характерной особенностью желчного канальца является его полная изоляция от кровеносных капилляров.
Тонкий механизм секреции желчи предусматривает выделение холестерина, желчных кислот и пигментов, а также фосфолипидов (в основном лецитина) в виде специфического макромолекулярного комплекса, или желчной мицеллы. Соотношение этих четырех основных компонентов, составляющих мицеллу, в нормальных условиях достаточно постоянно и обеспечивает растворимость компонентов. Ведь холестерин почти нерастворим в воде, плохо растворим в растворе желчных солей, но сочетание желчных кислот и лецитина резко повышает растворимость холестерина. Желчные кислоты, а также хлорид натрия в значительной мере определяют осмотическое давление желчи, а следовательно, и экскрецию воды из гепатоцита.
За сутки выделяется около 600 мл желчи. Строгие соотношения, необходимые для растворимости компонентов желчной мицеллы, объясняют уязвимость процессов желчной секреции и последующей желчединамики. Секреция желчи, а значит, и формирование мицеллы часто нарушаются: в результате патологических сдвигов в гормональной регуляции холестерино- и фосфолипидогенеза: при беременности (особенно в III триместре), реже - в менопаузе, а также при приеме гормональных препаратов (тестостерон, пероральные противозачаточные средства и др.). Воспалительно-дистрофические изменения гепатоцитов, в частности гладкого эндоплазматического ретикулума, лизосом и канальцевых мембран, при многих острых, а нередко и при хронических заболеваниях печени приводят к грубым нарушениям секреции желчи, что усугубляется поражением мельчайших желчных ходов. Как и при упомянутых выше гормональных нарушениях, может развиться желтуха (см. ниже).
Знание ультраструктуры гепатоцита и, в том числе, размещения в нем ферментов становится необходимым в клинической практике, в частности в диагностике синдромов и заболеваний печени, в объяснении патогенеза ряда болезней печени (синдром Рея, болезнь Гоше и др.) и в оценке эффективности лечения.
Жёлчь, выделяемая печенью (часть её направляется непосредственно в двенадцатиперстную кишку), называют «печёночной» (или «молодой»), а выделяемую жёлчным пузырём — «пузырной» (или «зрелой»).
|
Общие характеристики печёночной и пузырной жёлчи[4] |
||
|
Параметры |
Печеночная жёлчь |
Пузырная жёлчь |
|
Кислотность, pH |
7,3 — 8,2 |
6,5 — 6,8 |
|
Удельная масса |
1,01 — 1,02 |
1,02 — 1,048 |
|
Сухой остаток, г/л |
26,0 |
133,5 |
|
Вода, % |
95 — 97 |
80 — 86 |
Состав жёлчи человека
Основной компонент жёлчи — жёлчные кислоты (67 % — если исключить из рассмотрения воду). Половина — первичные жёлчные кислоты: холевая и хенодезоксихолевая, остальная часть — вторичные: дезоксихолевая, литохолевая, аллохолевая и урсодезоксихолевая кислоты.
Все жёлчные кислоты являются производными холановой кислоты. В гепатоцитах образуются первичные жёлчные кислоты — хенодезоксихолевая и холевая. После выделения жёлчи в кишечник под действием микробных ферментов из первичных жёлчных кислот получаются вторичные жёлчные кислоты. Они всасываются в кишечнике, с кровью воротной вены попадают в печень, а затем в жёлчь.
Жёлчные кислоты в жёлчи находятся в виде конъюгатов (соединений) с глицином и таурином: гликохолевой, гликохенодезоксихолевой, таурохолевой и других так называемых парных кислот. Жёлчь содержит значительное количество ионов натрия и калия, вследствие чего она имеет щелочную реакцию, а жёлчные кислоты и их конъюгаты иногда рассматривают как «жёлчные соли».
|
Содержание некоторых органических веществ в печёночной и пузырной жёлчи] |
||
|
Компоненты |
Печёночная, ммоль/л |
Пузырная, ммоль/л |
|
35,0 |
310,0 |
|
|
0,8 — 1,0 |
3,1 — 3,2 |
|
|
~3,0 |
25,0 — 26,0 |
|
|
1,0 |
8,0 |
|
22 % жёлчи — фосфолипиды. Кроме того, в жёлчи имеются белки (иммуноглобулины А и М) — 4,5 %, холестерин — 4 %, билирубин — 0,3 %, слизь, органические анионы (глутатион и растительные стероиды), металлы (медь, цинк, свинец, индий, магний, ртуть и другие), липофильные ксенобиотики.
|
Содержание ионов в печёночной и пузырной жёлчи[4] |
||
|
Ионы |
|
Ионы |
|
Печёночная, ммоль/л |
Пузырная, ммоль/л |
Печёночная, ммоль/л |
|
Натрий (Na+) |
|
Натрий (Na+) |
|
165,0 |
280,0 |
165,0 |
|
Калий (K+) |
|
Калий (K+) |
|
5,0 |
15,0 |
5,0 |
Функции
Жёлчь выполняет целый комплекс разнообразных функций, большинство из которых связано с пищеварением, обеспечивая смену желудочного пищеварения на кишечное, ликвидируя действие пепсина, опасного для ферментов поджелудочной железы, и создавая для них благоприятные условия.
Жёлчные кислоты, содержащиеся в жёлчи, эмульгируют жиры и участвуют в мицеллообразовании, активизируют моторику тонкой кишки, стимулируют продукцию слизи и гастроинтенсинальных гормонов: холецистокинина и секретина, предупреждают адгезию бактерий и белковых агрегатов.
Жёлчь также участвует в выполнении выделительной функции. Холестерин, билирубин и ряд других веществ не могут фильтроваться почками и их выделение из организма происходит через жёлчь. Экскретируется с калом 70 % находящегося в жёлчи холестерина (30 % реабсорбируется кишечником), билирубин, а также перечисленные выше металлы, стероиды, глутатион.
Жёлчь активирует киназоген, превращая его в энтеропептидазу, которая в свою очередь активирует трипсиноген, превращая его в трипсин, то есть, она активирует ферменты, необходимые для переваривания белков.
Патологии
Жёлчные камни
Жёлчные камни
Несбалансированная по составу жёлчь (так называемая литогенная жёлчь) может вызывать выпадение некоторых жёлчных камней в печени, жёлчном пузыре или в жёлчных путях. Литогенные свойства жёлчи могут возникать вследствие несбалансированного питания с преобладанием животных жиров в ущерб растительным; нейроэндокринных нарушений; нарушений жирового обмена с увеличением массы тела; инфекционного или токсического поражений печени; гиподинамии.
Стеаторея
При отсутствии жёлчи (или недостатке в ней жёлчных кислот) жиры перестают абсорбироваться и выделяются с калом, который вместо обычного коричневого становится белого или серого цвета жирной консистенции. Такое состояние называется стеаторея, её следствием является отсутствие в организме важнейших жирных кислот, жиров и витаминов, а также патологии нижних отделов кишечника, которые не приспособлены к столь насыщенному непереваренными жирами химусу.
Рефлюкс-гастрит и ГЭРБ[править | править вики-текст]
При патологических дуоденогастральных и дуоденогастроэзофагеальных рефлюксах жёлчь в составе рефлюксата попадает в заметном количестве в желудок и пищевод. Длительное воздействие содержащихся в жёлчи жёлчных кислот на слизистую оболочку желудка вызывают дистрофические и некробиотические изменения поверхностного эпителия желудка и приводит к состоянию, называемому рефлюкс-гастритом. Конъюгированные жёлчные кислоты, и, в первую очередь, конъюгаты с таурином обладают значительным повреждающим слизистую пищевода эффектом при кислом рН в полости пищевода. Неконъюгированные жёлчные кислоты, представленные в верхних отделах пищеварительного тракта, в основном, ионизированными формами, легче проникают через слизистую оболочку пищевода и, как следствие, более токсичны при нейтральном и слабощелочном рН. Таким образом, попадающая в пищевод жёлчь может вызывать разные варианты гастроэзофагеальной рефлюксной болезни
Исследование жёлчи
Рис. Зонд, применяемый при исследовании жёлчи методом фракционного-дуоденального зондирования(дуоденальный зонд Левина)
- Для исследования жёлчи применяют метод фракционного (многомоментного) дуоденального зондирования. При проведении процедуры выделяют пять фаз:
- Базальной секреции жёлчи, во время которой выделяется содержимое двенадцатиперстной кишки и общего жёлчного протока. Длительность 10 — 15 минут.
- Закрытого сфинктера Одди. Длительность 3 — 6 мин.
- Выделения жёлчи порции А. Длительность 3 — 5 минут. За это время выделяется от 3 до 5 мл светло-коричневой жёлчи. Начинается с момента открытия сфинктера Одди и заканчивается открытием сфинктера Люткенса. Во время I и III фаз жёлчь выделяется со скоростью 1 — 2 мл/мин.
- Выделения пузырной жёлчи. Порция В. Начинается с момента открытия сфинктера Люткенса и опорожнения жёлчного пузыря, что сопровождается появлением тёмно-оливковой жёлчи (порция В), и заканчивается появлением янтарно-жёлтой жёлчи (порция С). Длительность 20 — 30 минут.
- Выделения печёночной жёлчи. Порция С. Фаза начинается от момента прекращения выделения тёмно-оливковой жёлчи. Длительность 10 — 20 минут. Объём порции 10 — 30 мл.
Нормальные показатели жёлчи следующие:
- Базальная жёлчь (фазы I и III, порция А) должна быть прозрачной, иметь светло-соломенный цвет, плотность 1007—1015, быть слабощелочной.
- Пузырная жёлчь (фаза IV, порция В) должна быть прозрачной, иметь тёмно-оливковый цвет, плотность 1016—1035, кислотность — 6,5—7,5 рН.
- Печёночная жёлчь (фаза V, порция С) должна быть прозрачной, иметь золотистый цвет, плотность 1007—1011, кислотность — 7,5—8,2 рН.[10]
Воздействие на жёлчь
В медицине для увеличения концентрации жёлчных кислот в жёлчи применяют холеретики. Для стимуляции сократительной функции жёлчного пузыря используют жёлчегонные препараты (например, такие травы, как: череда, арника, петрушка, шиповник, полынь). Для изменения состава жёлчных кислот жёлчи в сторону потенциально менее токсичных жёлчных кислот применяют препараты, изготовленные на основе урсодезоксихолевой или хенодезоксихолевой жёлчных кислот.
6. Участие печени в метаболизме
Печень, являясь центральным органом метаболизма, участвует в поддержании метаболического гомеостаза и способна осуществлять взаимодействие реакций обмена белков, жиров и углеводов.
Местами "соединения" обмена углеводов и белков является пировиноградная кислота, щавелевоуксусная и α-кетоглутаровая кислоты из ЦТК, способных в реакциях трансаминирования превращаться, соответственно, в аланин, аспартат и глутамат. Аналогично протекает процесс превращения аминокислот в кетокислоты.
С обменом липидов углеводы связаны еще более тесно:
- образуемые в пентозофосфатном пути молекулы НАДФН используются для синтеза жирных кислот и холестерола,
- глицеральдегидфосфат, также образуемый в пентозофосфатном пути, включается в гликолиз и превращается в диоксиацетонфосфат,
- глицерол-3-фосфат, образуемый из диоксиацетонфосфата гликолиза, направляется для синтеза триацилглицеролов. Также для этой цели может быть использован глицеральдегид-3-фосфат, синтезированный в этапе структурных перестроек пентозофосфатного пути,
- "глюкозный" и "аминокислотный" ацетил-SКоА способен участвовать в синтезе жирных кислот и холестерола.
6.1. Белковый обмен
Самые легкие белки крови, отн. мол. масса около 70 000. Период полураспада, по данным разных методов исследования, колеблется от 7 до 26 дней. В связи с необходимостью относительно частого обновления печень должна ежедневно синтезировать 12-15 г этого белка.
Альбумины играют важную роль в поддержании нормального онкотического давления крови, поэтому падение их содержания легко приводит к отекам. Альбумины играют важную роль в транспортировке веществ, плохо растворимых в воде. Часть альбумина, способная связывать и транспортировать эти вещества, обозначается как лигандин. В последнее время установлена близость лигандина к глутатионтрансферазе [Мусил Я., 1985, и др.]. К веществам, зависимым от глутатионтрансферазы, относятся неконъюгированный билирубин, холестерин, свободные жирные кислоты, ряд гормонов и лекарств. Нарушение транспортной функции альбуминов приводит к многим патологическим изменениям.
90% α1-глобулинов синтезируется в печени, они богаты липопротеидами. В эту фракцию входят кислый α1-гликопротеид (орозомукоид), α1-липопротеид, α1-антитрипсин.
Период полураспада α1-глобулинов 8-10 дней. После гепатэктомии в эксперименте первыми из белков сыворотки крови снижаются α1-глобулины, а лишь за ними - альбумины. α1-Глобулины, как и альбумины, могут выполнять транспортные функции. Изменения этой фракции в клиническом плане часто напоминают изменения альбуминов
Все факторы свертывания, за исключением фактора VIII, синтезируются в печени, и период полувыведения большинства из них составляет несколько часов или суток.
Синтез факторов свертывания крови II, VII, К и X зависит от витамина К.
Способность печени синтезировать факторы свертывания оценивают путем измерения протромбинового времени, отражающего взаимодействие факторов II, V, VII и X. Протромбиновое время увеличивается как в случае нарушения синтеза факторов свертывания, так и при дефиците витамина К. О дефиците последнего свидетельствует уменьшение протромбинового времени после назначения витамина К.
6.2. Углеводный обмен
Глава в работе
6.3. Обмен липидов
Материал в работе
6.4. Пигментный обмен
В работе
7. Основные клинико-лабораторные синдромы повреждения печеночной паренхимы
В настоящее время представляется целесообразным классифицировать диагностические исследования по синдромному принципу, т. е. по сущности нарушений гепатобилиарной системы, которые эти тесты отражают. Выделяют следующие синдромы:
- цитолитический синдром;
- синдром малой недостаточности печени, гепатодепрессивный синдром, гепатопривный синдром;
- мезенхимально-воспалительный синдром, синдром повышенной активности мезенхимы, иммуновоспалительный синдром;
- холестатический синдром, синдром нарушения секреции и циркуляции желчи;
- синдром портокавального шунтирования печени, синдром "отключения" печени;
- синдром регенерации и опухолевого роста печени;
- синдром гепатофиброза.
Кроме индикаторов основных синдромов, выделяется специальная группа лабораторных тестов, куда входят маркеры вирусов гепатита и вирусной инфекции.
7.1. Ферменты сыворотки крови
Среди функциональных проб печени все большее значение приобретает определение активности ферментов сыворотки крови. В отдельных клинических лабораториях крупных стационаров выполнение этих тестов составляет половину работы биохимического сектора. Нам представляется необходимым знакомство с некоторыми данными, касающимися этих веществ, включая систематизацию ферментов сыворотки крови.
Под изоферментами подразумевают ферменты, которые катализируют распад одинаковых субстратов, но существенно различаются по физико-химическим свойствам. Изоферменты могут вырабатываться разными органами, например изоферменты щелочной фосфатазы и до известной степени лактатдегидрогеназы. Часть изоферментов аспартатаминотрансферазы размещается в цитоплазме, а часть - в митохондриях клетки.
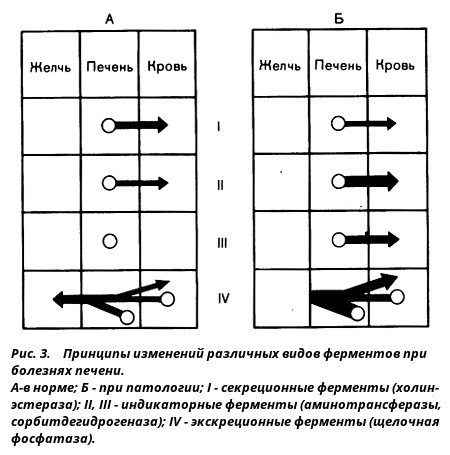
Наиболее распространено следующее деление [Richterich R., 1963] ферментов, используемых в диагностических целях (рис. 3).
- Секреционные, или плазмаспецифические, ферменты синтезируются органоидами гепатоцита (в основном рибосомами) и в нормальных условиях сецернируются в плазму крови, где они играют определенную физиологическую роль. К этим ферментам относятся холинэстераза (псевдохолинэстераза), большая часть прокоагулянтов и церулоплазмин. При повреждении печени и, в частности, ее рибосомального аппарата активность секреционных ферментов отчетливо снижается. Эта закономерность прослеживается при циррозах, "шоковой печени" и других заболеваниях.
- Индикаторные (так называемые клеточные) ферменты. К ферментам этой группы относят аминотрансферазы (трансаминазы), глутамат-, сорбит-, лактатдегидрогеназы, орнитин-карбамоилтрансферазы и ряд других ферментов. Большинство из них в нормальных условиях находится в плазме крови в относительно небольших количествах. При патологических процессах, сопровождающихся распадом клеток, активность этих ферментов возрастает во много раз. Индикаторные ферменты - главные и наиболее надежные показатели цитолитического синдрома в печени (см. ниже).
- Экскреционные ферменты производятся в печени (лейцинаминопептидаза) либо как в печени, так и в других органах (щелочная фосфатаза). В нормальных условиях эти ферменты выделяются в сыворотку крови и в желчь. Механизм выделения этих веществ изучен не полностью. При патологических условиях, особенно при затрудненном оттоке желчи, возрастает продукция этих ферментов и их активность в сыворотке крови увеличивается. Если прежде главная роль в повышении активности экскреционных ферментов отводилась затрудненной экскреции их в желчь (например, при механической желтухе), то в последние годы все большее значение отводится увеличению продукции этих ферментов гепатоцитами и эпителием мельчайших желчных протоков. При таком подходе суть самого термина "экскреционные ферменты" становится уязвимой.
Такие вещества, как билирубинглюкуронид, холестерин, желчные кислоты, β-липопротеиды, ведут себя в патологических условиях, в первую очередь при холестазе, подобно экскреционным ферментам.
В последние годы предпринимается попытка разделения ферментов по их преимущественной локализации в гепатоците. Выделяются: 1) цитоплазматические, 2) митохондриальные, 3) лизосомальные, 4) рибосомальные ферменты.
Это разделение ферментов представлено в клинической морфологии печени. Большинство ферментов расположено не в одном, а в нескольких отделах гепатоцита, и обычно указывается лишь преимущественная локализация одного из изоферментов.
Деление ферментов на органоспецифические и органонеспецифические весьма условно. Из ферментов, широко применяемых в клинической практике, к органоспецифическим относят глутаматдегидрогеназу, сорбит(идитол) дегидрогеназу и др. Было бы ошибочным предполагать, что эти ферменты представлены только в клетках печени, в небольших количествах они встречаются и в других органах и тканях. Как уже указывалось, "органоспецифичность" фермента имеет относительное диагностическое значение. Главное диагностическое качество фермента - это его чувствительность как индикатора соответствующего синдрома.
Таблица. Период полужизни ферментов в плазме крови
|
Фермент |
Фермент (полное название) |
Период полураспада |
|
- |
Амилаза |
3-6 ч |
|
АлАТ (ГПТ) |
аланинаминотрансфераза |
47 ± 10 ч |
|
АсАТ (ГОТ) |
аспартатаминотрансфераза |
17 ± 5 ч |
|
ГГТФ (ГГТП) |
γ-Глутамилтрансфераза |
3-7 сут |
|
ГЛДГ |
глутаматдегидрогеназа |
18 ± 1 ч |
|
ЛДГ1 (ГБДГ) |
лактатдегидрогеназа (1) |
113 ± 60 ч |
|
ЛДГ5 |
лактатдегидрогеназа (5) |
10 ± 2 ч |
|
ХЭ |
холинэстераза |
Около 10 сут |
|
ЩФ |
щелочная фосфатаза |
3-7 сут |
При оценке активности патологического процесса в печени, особенно при острых заболеваниях, необходимо учитывать скорость падения активности фермента в плазме крови (табл).
Важно отметить, что при повреждении печени активность одних ферментов изменяется значительно (АлАТ и др.), других (АсАТ, ЛДГ и др.) - существенно меньше.
7.2. Индикаторы цитолитического синдрома
Цитолитический синдром возникает вследствие нарушения структуры клеток печени, в первую очередь гепатоцитов. Эти повреждения иногда ограничиваются только клеточными мембранами, чаще распространяются на цитоплазму и могут охватывать отдельные клетки в целом. Все же главным в цитолизе следует считать нарушение проницаемости клеточных мембран. Обычно на начальных стадиях цитолиза изменяется состояние липидов мембран (в частности, нарастает пероксидное окисление липидов) и оболочка гепатоцита становится более проницаемой для ряда субстанций, в первую очередь для внутриклеточных ферментов. Важно подчеркнуть, что цитолиз в типичной ситуации не тождествен некробиозу клетки: когда цитолиз достигает степени некробиоза, в клинической практике пользуются термином "некроз" (ограниченный или распространенный). Разрушенная клетка перестает продуцировать ферменты. Цитолитический процесс может поражать незначительное число гепатоцитов, но нередко бывает более распространенным, захватывая огромное количество однородных клеток.
Цитолиз - один из основных показателей активности патологического процесса в печени. Представление об остром гепатите будет неполноценным без данных о состоянии цитолитического компонента. То же можно сказать и об активной стадии хронического воспалительного процесса в печени. Значение выявления цитолиза при заболеваниях печени нельзя переоценить, так как активность патологического процесса в печени - важнейшая характеристика большинства заболеваний этого органа. В связи с этим индикаторам цитолитического синдрома, отведено в изложении первое место.
Установление причин цитолиза, как правило, играет важную роль в понимании существа патологического процесса в печени. Можно веделить ряд механизмов цитолитического синдрома.
I. Преимущественно токсический (цитотоксический) цитолиз (прямое повреждающее действие этиологического агента):
1. вирусный;
2. алкогольный;
3. лекарственный.
II. Иммуноцитолиз (действие этиологического агента опосредуется иммунопатологическими реакциями):
1. вирусное, алкогольное и лекарственное поражение;
2. аутоиммунный (наследственно обусловленный?).
III. Гидростатический цитолиз:
1. при развитии желчной гипертензии;
2. при развитии гипертензии в системе печеночных вен.
IV. Гипоксический цитолиз (синдром "шоковой печени" и др.).
V. Опухолевый цитолиз.
VI. Нутритивный цитолиз:
1. при резком дефиците энергетической ценности пищи (общее голодание);
2. при выраженном дефиците отдельных компонентов питания (например, недостаток цистина и токоферола - парциальное голодание).
При оценке цитолиза учитываются некоторые биологические и химические особенности самих ферментов.
L-идитолдегидрогеназа содержится в гепатоцитах в относительно небольших количествах, остальные ферменты (АлАТ, глутаматдегидрогеназа) - в больших количествах. Ферменты, расположенные в цитоплазме, обычно сравнительно легко проникают через клеточную мембрану (АлАТ, ЛДГ, изоцитратдегидрогеназа и др.). Ферменты, сосредоточенные как в цитоплазме, так и в органоидах, проникают через клеточную мембрану с разной скоростью. Сравнительно легко попадают в кровоток, например, АсАТ и малатдегидрогеназы, расположенные как в цитоплазме, так и в митохондриях. Аналогично попадает в кровоток изоцитратдегидрогеназа, представленная цитоплазматическим и митохондриальными компонентами, но активность этого фермента в сыворотке крови определяет в основном цитоплазматический изофермент. Чисто митохондриальным ферментом является глутаматдегидрогеназа. Несмотря на очень большую молекулярную массу, этот фермент проходит через клеточную мембрану относительно легко, свидетельством чему являются резкие подъемы активности фермента в первые же часы обтурации общего желчного протока. Несколько медленнее проникают через клеточную мембрану ферменты, сосредоточенные на мембранах клетки и клеточных органоидов. К ним относятся γ-глтамилтрансфераза (γ-глутамилтранспептидаза), а также ферменты другого класса - щелочная фосфатаза, 5-нуклеотидаза.
Ряд лекарств влияет на гиперферментемию. Так, кортикостероидные гормоны, в частности преднизолон, обычно отчетливо снижают активность индикаторных ферментов, в первую очередь аминотрансфераз. Эндогенное ингибирование одних ферментов (γ-глутамилтрансфераза) и индукция других (β-глюкуронидаза) наблюдаются при беременности.
|
Таблица 13. Нормы основных ферментов - индикаторов цитолитического синдрома |
||||
|
Название и код фермента |
Метод определения |
Традиционные единицы |
Единицы СИ |
|
|
первона- чальный вариант, мкмоль/ (ч·л) |
оконча- тельный вариант, нмоль/ (с·л) |
|||
|
Аланинамино-трансфераза (2.6.1.2) |
Реакция с 2,4-ди-нитрофенилгид-разином (Райтмана - Френкеля, Пасхиной) |
7-40 |
0,1-0,68 |
28-190 |
|
По оптическому тесту Варбурга |
7-40 |
2-25 |
30-420 |
|
|
Аспартатамино- трансфераза (2.6.1.1) |
Реакция с 2,4-ди-нитрофенилгид-разином (Райтмана - Френкеля, Пасхиной) |
7-40 |
0,1-0,45 |
28-125 |
|
По оптическому тесту Варбурга |
7-40 |
2-20 |
30-330 |
|
|
γ-Глутамил- трансфераза (2.3.2.2) |
С субстратом γ- глутамил II-нитроанилидом |
Мужчины 15-106 |
М 15-106 |
250-1770 |
|
Биотест "Лахема" |
0,9-6,5 |
|
|
|
|
Глутаматдегидрогеназа (1.4.1.2) |
По оптическому тесту Варбурга |
0-0,9 |
0-0,9 |
0-15 |
|
L-идитолдегидро- геназа (1.1.1.14) |
Реакция с резорцином (Севела, Товарека) |
|
0-0,02 |
0-5,6 |
|
По оптическому тесту Варбурга |
до 0,9 |
0-0,9 |
0-15 |
|
|
Лактатдегидрогеназа (1.1.1.27) |
Реакция с 2,4-динитрофенил гидра- зином (Севела Товарека) |
100-340 |
0,8-4,0 |
220-1100 |
Ниже кратко представлены принципы дополнительного обследования в зависимости от предполагаемой причины цитолиза.
|
Методы распознавания патогенеза цитолитического синдрома |
|
|
Предполагаемое происхождение цитолитического синдрома |
Дополнительные методы исследования, необходимые для уточнения причины цитолиза |
|
1. В основном токсическое: |
|
|
вирусное |
Антитела к
вирусу гепатита А класса иммуноглобулина М |
|
алкогольное |
Определение ГГТФ, ГЛДГ, мочевой кислоты |
|
лекарственное |
Определение ГГТФ, ГЛДГ, ЩФ |
|
2. В основном иммунные нарушения |
Определение иммуноглобулинов сыворотки крови, Т- и В-лимфоцитов периферической крови |
|
3. Гидростатические нарушения: |
|
|
при желчной гипертензии |
Определение
ГГТФ, ГЛДГ, ЩФ, 5-НТ |
|
при гипертензии в системе печеночных вен |
Определение центрального венозного давления, эхокардиография, веногепатикография |
|
4. Гипоксический цитолиз (синдром "шоковой печени") |
Повторное определение холестерина, холинэстеразы сыворотки, сулемовой пробы, а также альдостерона и кортизола |
|
5. Опухолевый цитолиз |
Определение
ГГТП, ГЛДГ, ЩФ, ЛДГ. |
|
6. Нутритивный цитолиз: |
|
|
в результате общего голодания |
Контроль за массой тела, определение общего белка, альбуминов, азота аминокислот |
|
в результате парциального голодания |
То же, включая определение цистина |
8. Градация и стадирование при биопсии печени
Биопсия печени является важным диагностическим инструментом. На сегодняшний день - это наиболее точный метод оценки состояния печени, позволяющий посредством измерения степени воспаления и определения стадии фиброза прогнозировать развитие болезни и результат лечения.
Биопсия печени заключается в отборе очень маленького образца печёночной ткани. Образец отправляется на оценку специалисту-патологу. Очень важно, чтобы эта процедура и результаты всех лабораторных тестов интерпретировались специалистом.
В 1995 г. в J. Hepatology была опубликована статья, в которой группа ведущих морфологов мира под руководством К. Ishak предложила новую методику полуколичественной оценки степени активности воспаления и выраженности фиброза печени по результатам пункционной биопсии печени. В настоящее время эта методика, которую называют шкала Ishak и ее модификация Кнодель(Knodell), одна из наиболее широко используемых в мире среди морфологов при оценке поражения печени.
8.1. Степень и стадия
Степень и стадию заболевания традиционно определяли в онкологии. Степень отражает степень дифференцировки опухоли, а стадия - ее распространение. Те же принципы могут быть применены при классификации неопухолевых заболеваний, таких как хронический гепатит [3].
Степень гистологических изменений позволяет описать некровоспалительную активность хронического гепатита.
Стадия же указывает на выраженность фиброза и нарушения архитектуры печени (т.е. отражает структурное прогрессирование заболевания), которые считают следствием некровоспалительного процесса.
Цель выделения стадии и степени - оценить гистологические изменения, которые характеризуют тяжесть течения и прогрессирование хронического гепатита и могут также иметь прогностическое значение. Для оценки могут использовать количественные индексы, что позволяет провести полуколичественный анализ гистологической картины.
Возможность точной классификации степени и стадии гепатита при биопсии печени ограничена, поэтому при интерпретации результатов морфологического исследования следует учитывать размер и качество биоптата.
Если анализируется большое число биопсий, например, в рамках клинического исследования противовирусных средств, то точность классификации повышается.
Мы не считаем, что полуколичественная оценка стадии и степени гепатита необходима в обычной практике (как альтернатива простому описанию результатов биопсии). Однако применение подобной классификации необходимо в исследованиях новых агентов и схем противовирусной терапии, так как полуколичественнный анализ позволяет сравнивать результаты различных исследований.
Таблица 1. Модифицированный индекс степени гистологической активности: некровоспалительные изменения
Индекс | |
| А. Перипортальный или перисептальный межуточный гепатит (ступенчатый некроз) | |
| Отсутствует | 0 |
| Легкий (очаговые, отдельные портальные тракты) | 1 |
| Легкий/умеренный (очаговый, большинство портальных трактов) | 2 |
| Умеренный (охватывает <50% трактов или септ) | 3 |
| Тяжелый (охватывает >50% трактов или септ) | 4 |
| В. Сливной некроз | |
| Отсутствует | 0 |
| Очаговый | 1 |
| Некроз 3 зоны в некоторых областях | 2 |
| Некроз 3 зоны в большинстве областей | 3 |
| Некроз 3 зоны + единичные порто-центральный (Р-С) мостовидный | 4 |
| Некроз 3 зоны+множественный порто-центральный мостовидный | 5 |
| Панацинарный или мультиацинарный некроз | 6 |
| С. Фокальный (очаговый) литический некроз, апоптоз и фокальное воспаление* | |
| Отсутствует | 0 |
| Один очаг или менее на 10 полей зрения | 1 |
| 2-4 очага на 10 полей зрения | 2 |
| 5-10 очагов на 10 полей зрения | 3 |
| Более 10 очагов на 10 полей зрения | 4 |
| D. Портальное воспаление | |
| Нет | 0 |
| Легкое в некоторых или всех портальных трактах | 1 |
| Умеренное в некоторых или всех портальных трактах | 2 |
| Умеренное/выраженное во всех портальных трактах | 3 |
| Выраженное во всех портальных трактах | 4 |
* Не включает в себя воспалительную инфильтрацию синусоидов
Максимальное значение индекса 18.
Дополнительные изменения, которые следует указывать, хотя их количественный анализ не проводится:
- Воспаление и повреждение желчных канальцев
- Лимфоидные фолликулы
- Легкий, умеренный и выраженный стеатоз
- Дисплазия гепатоцитов (крупно- или мелкоклеточная)
- Аденоматозная гиперплазия
- Депозиты железа или меди
- Внутриклеточные включения (PAS-положительные, тельца Мэллори)
Иммуногистохимические данные:
- Необходимо указывать информацию о вирусных антигенах, субпопуляциях лимфоцитов и других изменениях
Кроме того, выделение стадии и степени гепатита может иметь определенное прогностическое значение и оказать влияние на тактику ведения пациента.
Например, у пациента с хроническим гепатитом низкой степени активности (другими словами, с легким хроническим гепатитом) прогноз часто более благоприятный, чем у пациента с высокой активностью (т.е. тяжелым гепатитом).
С другой стороны, течение и прогноз хронического гепатита невозможно предсказать, если не известны причина, активность репликации вируса и иммунного ответа, ответ на противовирусную терапию и наличие суперинфекции.
Изучение стадии и степени гистологических изменений имеет важное научное значение. Точная оценка гистологических данных позволяет оценить их взаимосвязь с клиническими исходами, например, важность мостовидного фиброза для развития цирроза у пациентов с HCV-инфекцией.
8.2. Какие гистологические изменения следует учитывать при выделении стадии?
При классификации стадии следует учитывать наличие фиброза, нарушения архитектуры и цирроза (табл. 2). При наличии цирроза бывает очень трудно интерпретировать результаты анализа небольшого биоптата, что необходимо принимать во внимание.
Таблица 2. Модифицированная классификация стадии гепатита: изменения архитектуры, фиброз и цирроз
| Индекс | |
| Фиброза нет | 0 |
| Распространение фиброза на некоторые портальные тракты ± короткие фиброзные септы | 1 |
| Распространение фиброза на большинство портальных трактов ± короткие фиброзные септы | 2 |
| Распространение фиброза на большинство портальных трактов и единичные порто-портальные септы | 3 |
| Распространение фиброза на портальные тракты с множественными порто-портальными и порто-центральными септами | 4 |
| Выраженный мостовидный фиброз с единичными узлами (неполный цирроз) | 5 |
| Вероятный или определенный цирроз | 6 |
| Максимальное значение индекса | 6 |
Дополнительные изменения, которые следует указывать:
- Интраацинарный фиброз, перивенулярный фиброз, флебосклероз терминальный печеночных венул
8.3. Оценка активности
При оценке степени активности следует учитывать признаки повреждения гепатоцитов в сочетании с распространенностью лимфоцитарной инфильтрации, характерной для некоторых форм хронического гепатита, в том числе вирусного, аутоиммунного и лекарственного, а также гепатита неизвестной этиологии.
По гистологической картине хронический гепатит сходен с другими хроническими воспалительными заболеваниями печени, такими как первичный билиарный цирроз, первичный склерозирующий холангит, а также болезнь Вильсона и дефицит α1-антитрипсина, однако указанные состояния следует рассматривать отдельно. Соответственно, они не обсуждаются в данной статье.
Злоупотребление алкоголем также может привести к появлению гистологических признаков хронического гепатита, который в некоторых случаях связан с инфекцией, вызванной вирусом гепатита, однако классический алкогольный стеатогепатит не включен в данную классификацию, учитывая особенности гистологической картины.
По нашему мнению, при оценке степени активности следует учитывать наличие портальной, перипортальной и интраацинарной воспалительной инфильтрации и различных форм повреждения и некроза гепатоцитов (табл. 1):
фокальный некроз и апоптоз гепатоцитов,
ступенчатый некроз (межуточный гепатит),
простой сливающийся некроз (гибель группы гепатоцитов без четкой зональной локализации или мостовидного характера),
зональный сливной некроз (зона 3),
мостовидный некроз, соединяющий сосудистые структуры и
панацинарный или мультиацинарный некроз.
Мы поддерживаем использование термина "межуточный гепатит", а не "ступенчатый некроз", так как многие формы повреждения печени при этом процессе являются скорее следствием апоптоза, а не некроза [5].
Термин "мостовидный некроз", по нашему мнению, следует использовать только для описания соединения портальных трактов и печеночных венул. Эти изменения, которые, вероятно отражают некроз ацинарных зон 3, часто начинающийся в перивенулярного некроза, в прогностическом и патогенетическом отношении отличаются от слияния портальных трактов. Последнее обычно происходит при распространении ступенчатых или лестничных некрозов (подробную информацию об этих и других морфологических терминах см. [6]).
8.4. Клинический пример
Необходимость критической оценки гистологических изменений печени в клинических исследованиях привела к разработке различных классификаций заболеваний печени. Однако в обычной клинической практике вполне достаточно описания соответствующих гистологических признаков, в то время как их количественный анализ, как правило, не требуется.
Для общей оценки тяжести хронического гепатита могут быть, например, использованы термины "минимальный", "легкий", "средне-тяжелый" или "тяжелый" гепатит, которые предполагают морфологическую интеграцию различных изменений.
В качестве примера ниже приведены описание биоптата печени и результаты его полуколичественного анализа.
"Архитектура печени сохранена, однако портальные тракты расширены, а короткие септы выходят за их пределы, но не формируют мостовидные соединения между сосудистыми структурами.
Портальные тракты инфильтрированы лимфоцитами с образованием лимфоидных фолликулов с герминативными центрами.
Межуточный гепатит (ступенчатые некрозы) минимальный.
Отмечено легкое повреждение желчных канальцев в виде отека эпителия и незначительной его инфильтрации лимфоцитами.
В ацинусах определяются отдельные небольшие очаги некрозов и инфильтрации лимфоидными клетками и макрофагами.
Видны немногочисленные ацидофильные тельца.
Сливающийся и порто-центральный мостовидный некроз отсутствует.
Жировая дистрофия легкая.
Гемосидероза нет.
Включения α1-антитрипсина отсутствуют.
Заключение: легкий хронический гепатит с лобулярным компонентом без мостовидного некроза, соответствующий диагнозу хронического гепатита С."
Степень: (A)1+(B)0+(C)2+(D)3; суммарный индекс =6. Стадия = 2
8.5. Какие полуколичественные классификации существуют сегодня?
В настоящее время используется или предложено несколько классификаций стадии и степени хронического гепатита [6,8-10].
Наиболее популярен индекс гистологической активности, предложенный Knodell и соавт. [8]. Его применение уже позволило сравнить результаты лечения и наблюдения нескольких групп больных хроническим вирусным гепатитом. Представляется вероятным, что и в будущем многие патологоанатомы и гепатологу продолжать пользоваться этим индексом.
Однако применение индекса Knodell сопряжено с некоторыми проблемами [3], поэтому мы считаем целесообразной его модификацию. Эти проблемы включают в себя следующие:
- Первые три категории индекса гистологической активности (перипортальный ± мостовидный некроз, интралобулярная дегенерация и фокальный некроз, портальное воспаление) отражают степень активности, поэтому полученные индексы не следует суммировать с индексом фиброза, который является показателем стадии заболевания.
- Первая категория включает в себя как ступенчатые некрозы, так и мостовидный фиброз, хотя мы считаем целесообразным рассматривать эти формы поражения печени по отдельности.
- Для всех 4 категорий предложено указывать индексы от 0 до 10 или от 0 до 4, однако цифры пропущены. Например, описаны показатели 0, 1, 3 и 4, в то время как описание индекса 2 отсутствует. Соответственно, у патологоанатома может возникнуть вопрос, можно ли указывать промежуточное значение 2.
- В некоторых случаях индексы оценивают на основании сочетания распространенности и тяжести изменений. В некоторых случаях патологоанатомы сталкиваются с трудностями, если распространенность и тяжесть (например, портального воспаления) не совпадают друг с другом.
- При статистическом анализе необходимо учитывать, что значения индексов не являются непрерывными переменными.
8.6. Метавир
Система баллов Метавир была специально разработана для пациентов с гепатитом С. Эта система предусматривает использование стадирования и градации.
Степенью характеризуют активность инфекции, или уровень воспаления, а стадия (фаза) даёт представление о количестве фиброзной ткани или рубцевания.
Степени присваивается балл на основе тяжести воспаления, обычно от 0 до 4 баллов (0 означает отсутствие воспаления, а 3 или 4 указывают на тяжёлое воспаление). Количественная оценка воспаления очень важна, поскольку воспаление печени является предшественником фиброза
Шкала METAVIR. Стадии гистологической активности
| Ступенчатые некрозы | Лобулярное воспаление | ИГА |
| 0 (нет) | 0 (нет или мягкое) | А0 |
| 1 (умеренное) | А1 | |
| 2 (выраженное) | А2 | |
| 1 (мягкие) | 0, 1 | А1 |
| 2 | А2 | |
| 2 (умеренные) | 0, 1 | |
| 2 | А3 | |
| 3 (выраженные) | 0, 1, 2 |
8.7. Литература
- De Groote J, Desmet V, Gedigk P, Korb G, Popper H, Poulsen H, Shmid M, Uehlenger E, Wepler W. A classification of chronic hepatitis. Lancet 19S8; ii: 626-28.
- Ludwig J. The nomenclature of chronic active hepatitis: an obituary. Gastroenterology 1993; 105: 274-78.
- Desmet VJ, Gerber M, Hoofnagle JH, Manns M, Scheuer PJ. Classification of chronic hepatitis: diagnosis, grading and staging. Hepatology 1994; 19: 1513-20.
- Ishak KG. Chronic hepatitis. Morphology and nomenclature. Modern Pathol 1994; 7: 690-713.
- Powell LW. The nature of cell death in piecemeal necrosis: is order emerging from chaos? Hepatology 1987; 7: 794-96.
- Bianchi L, Gudat E Chronic hepatitis. In: MacSween RNM, Anthony PP, Scheuer PJ, Portmann B, Burt AD, eds. Pathology of the Liver; 3rd Edn: Edinburgh: Churchill Livingstone, 1994; 349-95.
- Bedossa P, Bioulac-Sage P, Callard P, Chevallier M, Degott C, Deugnier Y, Fabre M, Reynes M, Voigt JJ, Zafrani ES. Intraobserver and interobserver variations in liver biopsy interpretation in patients with chronic hepatitis C. Hepatology 1994; 20:15-20.
- Knodell RG, Ishak KG, Black WC, Chen TS, Craig R, Kaplowitz N, Kiernan TW, Wollman J. Formulation and application of a numerical scoring system for assessing histological activity in asymptomatic chronic active hepatitis. Hepatology 1981; 1:431-35.
- Lok ASF, Lindsey I, Scheuer P, Thomas HC. Clinical and histological features of delta infection in chronic hepatitis В virus carriers. J Clin Pathol 1985; 38: 530-33.
- Scheuer PJ. Classification of chronic viral hepatitis: a need for reassessment. J Hepatol 1991; 13: 372-74.