Метаболизм одноуглеродных фрагментов. Роль фолиевой кислоты. Гипегомоцистеинемия.
1. Обмен одноуглеродных фрагментов
1.1. Роль глицина и серина
Обмен серина и глицина
Серин - заменимая аминокислота, синтезируется из промежуточного продукта гликолиза - 3-фосфоглицерата, а аминогруппу получает от глутаминовой кислоты.
Глицин - также заменимая аминокислота, основным источником которой служит серии. Реакцию синтеза глицина из серина катализирует фермент серин-оксиметилтрансфераза, кофермен-том которой является Н4-фолат (см. схему А).
Реакция превращения серина в глицин легко обратима. Основной путь катаболизма глицина у человека и других позвоночных также связан с использованием Н4-фолата (см. схему Б).
Эта реакция обратима и катализируется глицинсинтазой - ферментным комплексом, похожим на пируватдегидрогеназный комплекс, и локализованным в митохондриях клеток печени. По последним данным глицинрасщепляющая ферментная система несколько отличается от глицинсинтазы и содержит 4 белка: Р-белок, включающий кофермент ПФ, Н-белок, содержащий липоевую кислоту, Т-белок с коферментом Н4-фолат, L-белок, являющийся дигидролипоилдегидрогеназой с коферментом NAD+.
1. Пути метаболизма серина и глицина
Аминокислоты серии и глицин выполняют в организме человека разнообразные и очень важные функции. Роль серина и глицина в синтезе многих биологически важных соединений представлена на рис.
1. Синтез из 3-Фосфоглицерата. Серин - заменимая АМК, синтезируется из промежуточного продукта гликолиза - 3-фосфоглицерата, а аминогруппу получает от глутаминовой кислоты
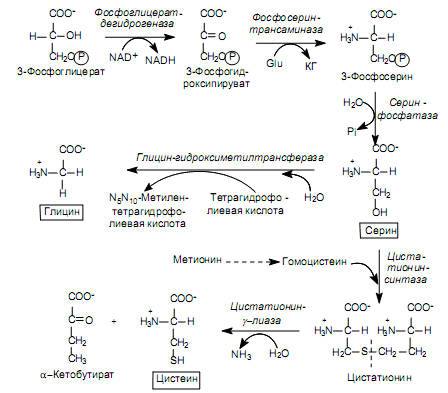
2. Глицин синтезируется из серина, при этом образуется метилен ТГФК (Схема А). Основной путь катаболизма глицина - обратимая реакция (также связанная с использованием ТГФК), катализируется глицинсинтазой - ферментным комплексом (аналог пируватдегидрогеназного комплекса), локализованным в митохондриях гепатоцитов (Схема Б).
Глицинсинтаза – мультиферментный комплекс, включающий:
Р-белок (глициндегидрогеназа, включает кофермент ПФ);
Н-белок (содержит липоевую кислоту);
Т-белок (аминометилтрансфераза включает кофермент ТГФК);
L-белок (дигидролипоилдегидрогеназа с коферментом NAD+)

Схема А

Схема Б
При соединении схем А и Б серина, реакция системы расщепления глицина становится:
2 глицина + NAD+ + H2O → серин + CO2 + NH3 + NADH + H+
У людей и большинства позвоночных система расщепления глицина является частью наиболее известного пути глицинового и серинового катаболизма.

Рис. Биологическая роль серина и глицина.
На рисунке видно, что обе аминокислоты необходимы не только для синтеза белков и глюкозы (при её недостатке в клетках), но и нукле-отидов, коферментов, тема, сложных липидов, креатина и других соединений. Многие из этих реакций представлены в соответствующих разделах учебника.
2. Роль фолиевой кислоты
в обмене аминокислот
В превращениях серина и глицина главную роль играют ферменты, коферментами которых служат производные фолиевой кислоты. Этот витамин широко распространён в животных и растительных пищевых продуктах. Молекула фолиевой кислоты (фолата) состоит из 3 частей: птеринового производного, парааминобензойной и глутаминовой кислот (см. схему В).
Фолиевую кислоту (фолат) называют также птероилглутаминовой кислотой. Птерины широко распространены в природе. Некоторые из них, например ксантоптерин, являются пигментами глаз и крыльев насекомых (бабочек).
Коферментную функцию выполняет восстановленная форма фолата - тетрагидрофолиевая кислота (ТГФК или Н4-фолат) (см. схему Г).
Фолиевая кислота в печени превращается в Н4-фолат в несколько стадий с участием ферментов фолатредуктазы и дигидрофолатредуктазы, коферментом которых служит NADPH.
Н4-фолат - акцептор β-углеродного атома серина. При этом образуется метиленовый мостик между атомами азота в молекуле Н4-фолата в положениях 5 и 10, образуя метилен-Н4-фолат (см. схему Д).
3. Образование и использование
одноуглеродных фрагментов
Особое значение реакций катаболизма серина и глицина заключается в том, что они сопровождаются образованием одноуглеродного

Схема В

Схема Г

Схема Д
метиленового фрагмента (-СН2-). Метиленовая группа в молекуле метилен- Н4-фолата может превращаться в другие одноуглеродные группы (фрагменты): метенильную (-СН=), формильную (-НС=О), метильную (-СН3) и формиминогруппу (-CH=NH).
Ещё один источник формального и формимино-фрагментов - гистидин. Катаболизм гистидина происходит только в печени (очень небольшой процент в коже) в результате следующих реакций.
Конечными продуктами катаболизма гистидина являются глутамат, NH3 и одноуглеродные фрагменты - формимино-Н4-фолат и формил-Н4-фолат.
Все образующиеся производные Н4-фолата играют роль промежуточных переносчиков и служат донорами одноуглеродных фрагментов при синтезе некоторых соединений: пуриновых оснований и тимидиловой кислоты (необходимых для синтеза ДНК и РНК), регенерации метионина, синтезе различных формиминопроизводных (формиминоглицина и т.д.).
496

Рис. Образование производных Н4-фолата.
Перенос одноуглеродных фрагментов к акцептору необходим не только для синтеза ряда соединений, но и для регенерации свободного Н4-фолата в печени.
Глицинская энцефалопатия, также известная как некетотическая гиперглицинемия (NKH), является основным расстройством системы расщепления глицина, что является следствием пониженной функции системы расщепления глицина, вызывающей повышенный уровень глицина в биологических жидкостях. Болезнь впервые была клинически связана с системой расщепления глицина в 1969 году. [10] Ранние исследования показали высокий уровень глицина в крови, моче и цереброспинальной жидкости. Первоначальные исследования с использованием изотопов углерода показали снижение уровня образования СО2 и серина в печени, что прямо указывает на недостатки реакции расщепления глицина [11]. Дальнейшие исследования показали, что делеции и мутации в 5'-области Р-белка являются основными генетическими причинами некетотической гипергликемии. . [12] В более редких случаях было обнаружено, что миссенс-мутация в генетическом коде T-белка, вызывающая гистидин в положении 42 для аргинина, приводит к некетотической гипергицинемии. Эта специфическая мутация непосредственно влияла на активный сайт Т-белка, что приводило к снижению эффективности системы расщепления глицина. [13]
10. Yoshida T, Kikuchi G, Tada K, Narisawa K, Arakawa T (May 1969). "Physiological significance of glycine cleavage system in human liver as revealed by the study of hyperglycinemia". Biochem. Biophys. Res. Commun. 35 (4): 577–83. doi:10.1016/0006-291x(69)90387-8. PMID 5788511.
11. Jump up ^ Hayasaka K, Tada K, Fueki N, Nakamura Y (June 1987). "Nonketotic hyperglycinemia: analyses of glycine cleavage system in typical and atypical cases". J Pediatr. 110 (6): 873–7. doi:10.1016/S0022-3476(87)80399-2. PMID 3585602.
12. Jump up ^ Kanno J, Hutchin T, Kamada F, Narisawa A, Aoki Y, Matsubara Y, Kure S (Mar 2007). "Genomic deletion within GLDC is a major cause of non-ketotic hyperglycinaemia". Journal of Medical Genetics. 44 (3): e69. doi:10.1136/jmg.2006.043448. PMC 2598024 Freely accessible. PMID 17361008.
13. Jump up ^ Kure S, Mandel H, Rolland MO, Sakata Y (April 1998). "A missense mutation (His42Arg) in the T-protein gene from a large Israeli-Arab kindred with nonketotic hyperglycinemia". Hum. Genet. 102 (4): 430–4. doi:10.1007/s004390050716. PMID 9600239.