Введение в нейробиологию
12. Мембранный транспорт и генерация мембранных потенциалов
12.6. Вторичный активный транспорт
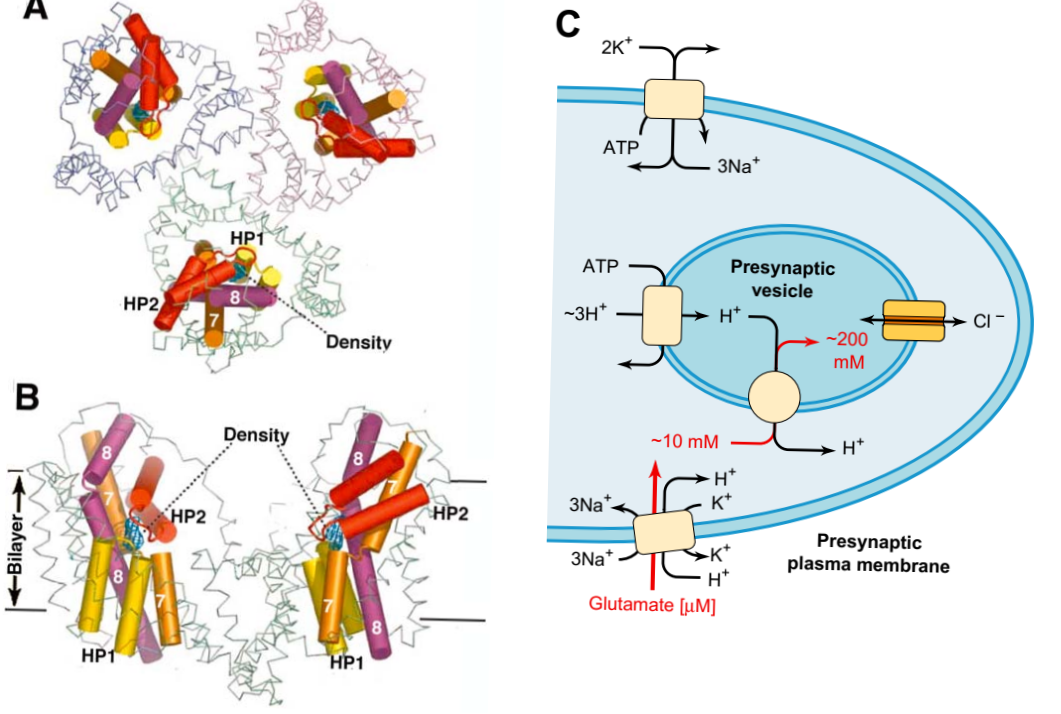
РИСУНОК 5-13 (А, В). Структура транспортера глутамата. Этот переносчик бактериальных глутаматов представляет собой первую модель с высоким разрешением для переноса глутамата [88]. Данные рентгеновского излучения указывают на тримерную структуру. (A) Вид тримера внеклеточно и перпендикулярно бислою. (B) Вид из двухслойной плоскости. Тример образует глубокую миску, которая позволяет внеклеточным растворам получить доступ к внеклеточному сайту связывания глутамата, расположенному вблизи центра двухслойной плоскости. Спиралью, представленную цветными цилиндрами, входят в структуру ионофорических сайтов, которые включают в себя трансмембранные спирали 7 и 8 и две петли повторного входа, HP1 (желтый) и HP2 (красный), которые поступают с противоположных сторон чаши. Объектами, отмеченными «Плотность», являются глутаматы, связанные на ионофорических сайтах. Авторы обсуждают эту структуру в терминах модели, в которой каждый связанный глутамат переносится в цитоплазму путем обязательной связи с симпортом 3 Na + и 1 H +. (С разрешения со ссылкой [88].) (C) Процессы, связанные с поглощением и упаковкой нейротрансмиттеров на нервных окончаниях. Концентрация в цитоплазме достигается с помощью симплексоров Na + с высокой аффинностью и специфичностью для нейротрансмиттера в плазмалемме. Как указано красным, μm внеклеточный глутамат концентрируется в мм в цитоплазме и примерно до 200 мм в везикулах. Синаптические пузырьковые мембраны содержат протонный насос V-ATPase (рис. 5-9) и хлоридные каналы, которые вместе подкисляют пространство внутреннего везикула и генерируют протонный градиент, который управляет селективными нейротрансмиттерами.
Вторичные транспортеры используют энергию, хранящуюся в градиентах ионов, для переноса других ионов и молекул. Многие из них являются симпортерами или антипортерами, связанными с Na + или протонными градиентами (фиг.5-1). Однако ситуация часто бывает более сложной, с участием более одного ионного градиента. Недавно была принята более систематическая номенклатура для вторичных перевозчиков. Он основан на геномных анализах эволюционных отношений между этими транспортёрами, которые являются членами большого «семейства растворенных носителей» (SLC) [41]. Примеры обсуждаются в следующих разделах. Восстановление нейротрансмиттеров из синаптических щелей и их хранение в цитоплазматических везикулах осуществляется тандемными действиями вторичных транспортеров в плазме и везикулярных мембранах. Натрий-зависимые симпортеры опосредуют повторный захват нейротрансмиттера от синаптических расщелин в нейроны и глии, тогда как прондезависимые антипортеры концентрируют нейротрансмиттеры из нейронной цитоплазмы на синаптические везикулы (рис. 5-13).
В то время как степень требований к метаболизму мозговых энергий обратного захвата нейротрансмиттера по-прежнему несколько противоречива, это в значительной степени способствует увеличению метаболизма, связанного с нейронной активностью [42] (см. Главу 31). Существует два разных подсемейства Na + -зависимых транспортеров, которые функционируют в плазменных мембранах. Одно подсемейство SLC6 характеризуется 12 трансмембранными сегментами и включает (Na +, Cl-) -зависимые транспортеры для гамма-аминомасляной кислоты (ГАМК), глицина, норэпинефрина, допамина, серотонина и гистамина. Другое подсемейство SLC1 включает в себя Na + -зависимые глютаматные транспортеры. Он охватывает некоторые переносчики амино- и карбоновой кислоты, включая переносчики глутамата, которые экспрессируются в бактериях. Данные рентгеновской дифракции получены из кристаллов одного из них [43] (рис. 5-13). Анализ множественных последовательностей последовательностей указывает на то, что эта молекула имеет высокую степень структурного сходства с переносчиками глутамата, которые выражены в мозге. Кажется, что каждая субъединица содержит ионофорический сайт, который может связывать глутамат, вероятно, в сочетании с тремя Na + и одним H +. Этот сайт расположен вблизи центральной плоскости бислоя и включает в себя две из восьми трансмембранных спиралей плюс две «петли повторного входа», по одному с каждой стороны, которые могут выступать в качестве «ворот доступа», которые открываются последовательно, чтобы разрешить связывание и диссоциацию внутри каждый транспортный цикл. Транспортеры глутамата в головном мозге кодируются пятью различными, но тесно связанными генами, SLC1A1-4 и SLC1A6. Существует несколько тривиальных имен для каждого из соответствующих белков. Транспортеры могут сопоставлять один Glu с тремя Na + и одним H + и антипортами K + в каждом цикле, но они отличаются своим клеточным выражением. Различные изоформы имеют различные регуляторные взаимодействия и выражены в разных типах клеток. Астроциты восстанавливают большую часть синаптически высвобожденного глутамата через транспортеры GLT1 / EAAT2 (SLC1A2) и GLAST / EAAT1 (SLC1A3). Они превращают большую часть этого в глутамин, который рециркулируют в нейроны (см. Chs 15 и 31), вероятно, с помощью Na + или H + -связанных членов семейства генов SLC38. Мутантная форма SLC1A2 ассоциирована с амиотрофическим боковым склерозом (см. Гл. 44). Мыши [34] и крысы [35] с дефицитом GLAST или GLT-1 имеют повышенный внеклеточный глутамат, а у мышей - летальные судороги [44]. Регулирование концентрации глутамата представляет особый интерес, поскольку его внеклеточное накопление является фактором различных патологий (см. Главу 32). В то время как общая концентрация глутамата в мозге составляет около 10 ммоль / л, внеклеточный глутамат, измеряемый микродиализом in vivo, обычно составляет всего 3-4 мкмоль / л. Глутамат в синаптической щели должен поддерживаться в еще более низких концентрациях в состоянии покоя. При использовании «нормальных» мембранных потенциалов и концентраций ионов транзитор глутамата теоретически может уменьшить это значение до 0,6 мкмоль / л или менее. Однако при деполяризационных или аноксических условиях мембранный потенциал и градиенты Na + и K + могут уменьшаться до уровней, которые приводят к тому, что симпордер не работает или работает в обратном направлении, что приводит к увеличению во внеклеточном глутамате в 100-1000 раз. В дополнение к своей функции транспортера перисинаптические транспортеры функционируют в качестве буферов для ограничения внеклеточного свободного глутамата до рецепторов, ближайших к местам постсинаптического высвобождения. По оценкам, общая концентрация глиальных транспортеров в некоторых синаптических областях ЦНС достаточна для связывания содержания глутамата от трех до пяти везикул на синапс [45]. Эта «буферизация», которая встречается главным образом в endfeet астроцитов, необходима для надежной синаптической передачи высокочастотных сигналов [46].Обратный захват GABA опосредуется вторичными транспортерами GAT1-4 (SLC6A1-4), которые экспрессируются в ГАМКергических нейронах. Семейство SLC6 также включает транспортерные гены для катехоламинов, серотонина, гистамина и глицина. Все активируются Na + symport. Хлорид котранспортируется, но, поскольку в большинстве клеток он пассивно распределяется по плазматической мембране, диффузия хлорида не подает энергию в систему. Многие из этих транспортеров экспрессируются при высоких плотностях в перисинаптической нейронной плазматической мембране. Однако до половины транспортеров обнаружены в небольших эндоцитотических везикулах, которые рециркулируют параллельно с везикулами нейротрансмиттеров [47, 48]. Переработка между везикулами и мембранами, по-видимому, является механизмом быстрого регулирования популяций многих различных интегральных мембранных белков. Транспортиры катехоламинов и серотонина ингибируются различными препаратами, как терапевтическими, так и вызывающими зависимость [49]. Синаптическое действие ацетилхолина уникально среди нейротрансмиттеров тем, что оно прекращается путем гидролиза, а не транспорта (глава 11). Следовательно, холинергические нейроны восстанавливают холин, а не ацетилхолин, через высокоаффинный холиновый транспортер CHT-1. Большая часть этих транспортеров CHT-1 находится в пресинаптических везикулах и только включена в пресинаптические мембраны одновременно с высвобождением ацетилхолина [50]. Это форма регулирования, несколько аналогичная той, которая наблюдалась для семейства SLC6, отмеченного выше. Структурно CHT-1 наиболее похож на Na + -зависимые переносчики глюкозы и классифицируется в семействе генов SLC5. Упаковочные нейротрансмиттеры в пресинаптические везикулы опосредуются протон-связанными антипортами. Как обсуждалось выше, мембраны, полученные из Гольджи, включая пресинаптические пузырьковые мембраны, содержат первичные транспортеры V-типа, которые накачивают протоны в просвет этих мембран и везикул. Антиподатчики с глутаматной упаковкой - VGLUT1, -2 и -3. VGLUT1 и -2 главным образом локализованы в глутаматергических нейронах и обладают высокой специфичностью, но с низким сродством (≈1 ммоль / л) для цитоплазматического глутамата, потому что концентрация цитоплазматического глутамата высока. Некоторое указание на функциональное значение различных изоформ можно получить из демонстраций, которые VGLUT2 экспрессируется в некоторых дофаминергических нейронах, тогда как везикулы VGLUT3 встречаются в некоторых серотонинергических и ГАМКергических интернейронах. Было высказано предположение, что такие нейроны могут высвобождать глутамат в качестве ауторегулятора, действующего на метаботропные пресинаптические рецепторы [51]. Антипортер GABA-упаковки, VGAT или VIAAT, был впервые идентифицирован по характеристике мутантного гена Caenorhabditis elegans, который продуцировал фенотип, который имитировал абляцию идентифицированного нейрона HABA. Ортолог млекопитающего этого гена функционирует как в ГАМКергическом, так и в глицинергическом нейронах. Он является протонным антипортером и, как и VGLUT, имеет относительно низкое сродство к его субстратам, ГАМК и глицину. Различные моноаминовые нейротрансмиттеры упаковываются в везикулы относительно неспецифическими антипортами VMAT1 (SLC18A1) и VMAT2 (SLC18A2). Селективность нейротрансмиттера в этих случаях, очевидно, определяется экспрессией биосинтетических ферментов. Упаковка ацетилхолина в синаптических везикулах как центральных, так и периферических нейронов опосредуется одним и тем же антипортером, VAChT (SLC18A3) [52]