Введение в нейробиологию
3. Белки мембран
Мембранные интегральные белки имеют трансмембранные домены, которые вставляются непосредственно в липидные бислои. Трансмембранные домены (TMD) состоят преимущественно из неполярных аминокислотных остатков и могут проходить через бислой один или несколько раз. Структурная информация с высоким разрешением доступна только для нескольких интегральных мембранных белков, прежде всего потому, что трудно получить кристаллы мембранного белка, которые являются адекватными для рентгеновских дифракционных измерений. TMD обычно состоят из спирали. Пептидная связь является по своей природе полярной и может образовывать внутренние водородные связи между карбонильными атомами кислорода и амидными нитрогенами, или любой из них может быть гидратирован. Внутри липидного бислоя, где вода по существу исключена, пептиды обычно принимают альфа-спиральную конфигурацию, которая максимизирует их внутреннюю водородную связь. Длина спирали из 18-21 аминокислотных остатков достаточна для охвата обычной ширины липидного бислоя рис. . Поскольку поверхностные свойства спирали определяются ее боковыми цепями, один спиральный сегмент, который может вставляться в двухслойный слой или через него, будет состоять в основном из гидрофобных остатков. Интегральные мембранные белки с одним трансмембранным доменом могут иметь «растворимые» домены на обеих или обеих поверхностях. Пример монотопного белка, цитохром b5 имеет один гидрофобный сегмент, который образует петлю шпильки, действуя как якорь к поверхности цитоплазмы, но, вероятно, не полностью проникает в двухслойный слой. Биотопные белки с одной трансмембранной спиралью более распространены. Если они ориентированы с экстрацитоплазмой N-конца, они классифицируются как тип I или, если цитоплазматический тип II рис.. Битопические мембранные белки часто участвуют в сигнальной трансдукции, примером которой являются рецептор-активированные тирозинкиназы (глава 24): агонистическая активность домена экстрацитоплазматического рецептора может передавать структурные изменения через одну трансмембранную спираль для активации латентной киназной активности в цитоплазматическом домене. Ионные каналы, транспортеры и многие рецепторы являются политопическими. Полярные и спирально-дестабилизирующие остатки, вероятно, происходят в их трансмембранных сегментах, чтобы сформировать необходимые ворота, каналы или связывающие домены. Трансмембранные спирали в политопных белках обычно плотно упакованы. Примерами этого являются рецепторы, связанные с G-белком (GPCRs, глава 19), и саркоплазматический Ca2 + pump (глава 5). Каждая пептидная связь имеет значительный дипольный момент, который передается на концы спирали. Это обстоятельство способствует близкой упаковке антипараллельных спиралей и является наблюдаемым расположением спиралей в бактериородопсине [3]. В олигомерных трансмембранных белках межзубная упаковка может охватывать экстрамембранные белковые домены и двухслойные липиды. Многие трансмембранные белки, которые опосредуют внутриклеточные сигналы, образуют комплексы как с внутри-, так и с внеклеточными белками. Например, молекулы адгезии нервных клеток (NCAM) являются гликопротеинами клеточной поверхности (глава 7). Внеклеточные домены NCAM могут активировать рецепторы фактора роста фибробластов при кластеризации путем реакции с антителами NCAM [4] или путем гомотипического связывания с доменами соседних клеток (см. Рис. 7-2). Было обнаружено, что активация секвестрирует комплекс NCAM, βI spectrin и PKCβ2 в плотах, как определено рабочими критериями, описанными на стр. 28. Мембранные ассоциации могут происходить путем селективного связывания белка с группами липидных голов. Одним из примеров является спектрин, который связывается с фосфатидилинозитол-4,5-бисфосфатом с помощью домена плекстрина-гомологии (PH) [5]. а также к фосфатидилсерину [6] рис. . Приток Ca2 + инициирует белковые и мембранные ассоциации несколькими различными механизмами. Часто происходит аллостерическая регуляция гидрофобности поверхностей, связывающих белок. Одним из наиболее изученных примеров является Ca2 + -зависимое связывание кальмодулина с другими белками (глава 22). Приекнины представляют собой семейство белков, которые проявляют Ca2 + -зависимые ассоциации с клеточными мембранами путем прямого взаимодействия с фосфолипидами, и, наоборот, взаимодействия с фосфолипидами увеличивают их аффинность для Ca2 + [7]
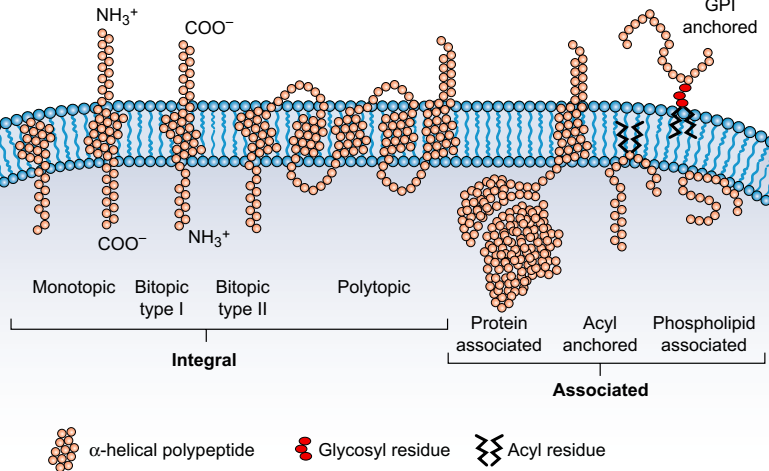
Рис. Слева: интегральные мембранные белки можно классифицировать относительно ориентации и сложности их трансмембранных сегментов. Справа: белки могут ассоциироваться с мембранами через несколько типов взаимодействий с двухслойными липидами и взаимодействием с интегральными мембранными белками. Они также могут быть «закреплены» путем интеграции в двухслойный слой ковалентно связанных липидов. GPI = гликозилфосфатидилинозитол
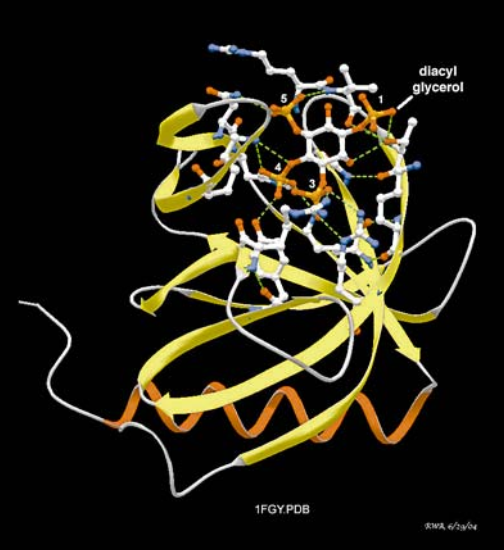
Рис. Область гомологичности плекстрина (PH) GrP1, фактор обмена валовой ГТФ (гуанозин 5 'трифосфат) для Arf GTPases. Активация GrP1 происходит, когда этот домен связывается с PI (3,4) P2 или PI (3,4,5) P3, полученным во внутреннем листе плазменных мембран с помощью PI3-киназы (глава 20). Эта структура показана в комплексе с инозитолом 1,3,4,5-тетрафосфата, поскольку она кристаллизовалась для дифракции рентгеновских лучей, тогда как диацилглицерин этерифицировался до 1-фосфата инозита в связанной с мембраной форме. Аминокислотными остатками (модели с шариком и палкой) показаны те, которые приближаются к титрофосфату инозита, достаточно близко к образованию водородных связей (зеленые штрихи). Модель, построенная из базы данных протеиновых координат 1fgy [32] с использованием DeepView 3.7 [33]