Введение в нейробиологию
12. Мембранный транспорт и генерация мембранных потенциалов
12.1. Na+/K+ АТФаза
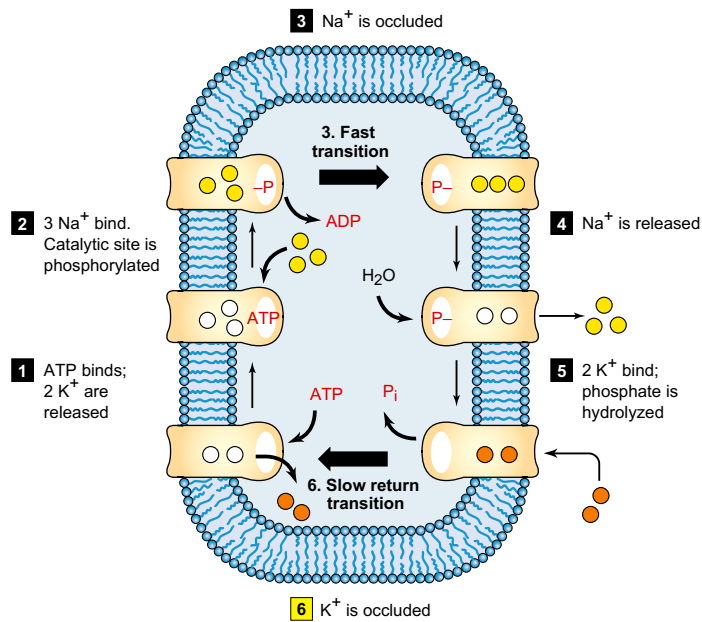
Механизм АТФ-зависимого натриевого насоса. Последовательность этапов реакции обозначена большими стрелками. С левой стороны молекулы накачки находятся в конформации E1, которая имеет высокое сродство к Na + и АТФ и низкое сродство к K +. Ионофорические сайты доступны только с цитоплазматической стороны. Шаг 1. К + выгружается, когда метаболическая энергия добавляется к системе путем связывания АТФ. Шаг 2. Три связывания Na + и фермент обратимо фосфорилируют. Шаг 3. Конформационный переход от E1 ~ P к E2-P, показанный наверху, представляет собой «энергетический ход» насоса, в течение которого ионофорические участки с тремя связанными Na + становятся доступными внеклеточной стороне и уменьшают их сродство к Na +. Часть свободной энергии фермента ацилфосфата была рассеяна в этом процессе. Шаг 4. Три Na + диссоциируют из E2-P. Шаг 5. Два связывания K + и более свободная энергия рассеиваются по мере гидролиза фермента ацилфосфата. В этот момент два K + становятся жестко связанными («закупоренными»), а на этапе 6 E2 возвращается к E1, несущим K + к цитоплазматической стороне. Каждый шаг этого цикла экспериментально обратим.
Основная доля производства мозговой энергии потребляется насосом Na +, K +. Большая часть этого требуется для компенсации экструзии внутриклеточного Na +, который поступает через каналы во время электрической активности и через Na + -зависимые вторичные транспортеры при восстановлении нейротрансмиттера. Предполагая типичные значения градиентов концентрации Na + и K +, то есть [Na +] e / [Na +] i 12 и [K +] i / [K +] e 50, тогда ΔG составляет около 3,8 ккал (16 кДж) на моль Na + обменялся на K +. Гидролиз высокоэнергетической фосфатной связи АТФ может давать до 12 ккал / моль в физиологических условиях, что позволяет обмен примерно на три эквивалента катиона для каждого моля гидролизата АТФ. Из этой стехиометрии видно, что химическая свободная энергия гидролиза АТФ должна использоваться с эффективностью 95% (3 × 3,8 / 12) для работы натриевого насоса в физиологических условиях. Другие процессы, использующие хранилища энергии, перечислены в таблице 31-1.
Энергетические затраты
мозга
|
Функции |
Энергетические затраты (% от общей энергии) |
|
Сигнальная функция |
75 |
|
Потенциал действия |
35.3 |
|
Постсинаптические рецепторы |
25.5 |
|
Потенциал покоя |
9.8 |
|
Рециркуляция глутамата |
2.3 |
|
Постсинаптический Ca2+ |
2.3 |
|
Основная клеточная активность |
25 |
|
Обмен фосфолипидов&стабидизация мембран |
≈5 |
|
Круговорот белков и олигонуклеотидов |
2 |
|
Аксональный транспорт |
* |
|
Протонные течи в митохондриях |
† |
Источник: adapted from Attwell and Laughlin [1].
*Энергетические
затраты неизвестны.
†Значения не известны для мозга, но
в других они тканях равны 20%
Na, K-АТФаза представляет собой гетеродимер, состоящий из каталитической α-субъединицы и вспомогательной β-субъединицы. Четыре изоформы α-субъединицы и три β-субъединицы выражены у млекопитающих. Три изоформы α-субъединицы экспрессируются в мозге и будут обсуждаться в более позднем разделе. Β-субъединицы (≈40 кДа) являются монотопными гликопротеинами и обладают некоторыми характеристиками молекул клеточной адгезии. По крайней мере, одна из трех изоформ β-субъединицы должна быть коэкспрессирована для того, чтобы транслоцировать α-субъединицу из эндоплазматического ретикулума (ER) в плазмалемму. Три изоформы β-субъединицы имеют примерно 45% идентичности последовательности. Β1 наиболее выражен [2]. Β2 первоначально описывался как «молекула адгезии на глие» (AMOG), поскольку он временно экспрессируется на поверхности мозжечка Bergmann glia во время дифференциации клеток гранул. По мере взросления мозга он широко выражается на астроцитах и исчезает из большинства нейронов. Специфическая изоформа β-субъединицы в паре с α-субъединицей мало влияет на параметры насоса [3]. Однако различные β-изоформы могут влиять на конечную клеточную и субклеточную локализацию насосов Na + [4]. Существуют также γ-субъединицы Na +, семейства протеолипидов ≈15 кДа, которые могут связываться с α-субъединицами натрия. Однако они не нужны для активности насоса и не экспрессируются во всех клетках. Γ-субъединицы классифицируются как члены семейства генов FXYD, а некоторые из них экспрессируются в мозге [5]. Почечная экспрессирует почти исключительно Na +, K + насосы с α1-субъединицами на функционально разнообразных сегментах нефрона, но разные γ-субъединицы выражены в разных сегментах. Из этого следует, что различные γ-субъединицы оптимизируют натрий-насос для работы в различных ионных средах [6].
В центральной нервной системе Na, K-АТФаза наиболее выражена в регионах, где ожидаются высокие уровни обмена Na + / K +. К ним относятся аксональные терминалы, узлы Ранвье, дендритные процессы и нейронная сома, но не в оболочках миелина. В спинном мозге экспрессия нейрона α1 ограничена набором расположенных в боковом направлении передних роговых клеток и промежуточных клеток грудного корня. Различные клетки ганглиозного дорзального корня экспрессируют α3 самостоятельно или вместе с α1, но не экспрессируют только α1. В эпигенетическом пигментном эпителии и сосудистой оболочке саркоидной мембраны насос Na + наиболее сконцентрирован на апикальных (просветных) поверхностях (рис.5-3). С этими исключениями эпителиальные клетки, адаптированные для секреции или реабсорбции, экспрессируют Na + насос исключительно на базалатеральных или абламинальных поверхностях.
Na, K-АТФазы изменяются с развитием, старением и деменцией. Активность Na, K-АТФазы относительно общего белка увеличивается примерно в десять раз непосредственно перед стадией быстрого миелинизации у крыс. Это происходит через 2-12 дней после дня и соответствует времени глиальной пролиферации, разработке нейронных и глиальных процессов и увеличению нейрональной возбудимости. Нейроны могут играть роль в повышении глиальной экспрессии изоформы α2 во время пиковых периодов миелинизации, и эффект, вероятно, зависит от контакта [7]. Изменения в развитии Na, K-АТФазы в мозге, по-видимому, зависят от тиреоидных влияний. Культуры глиальных клеток из 1-дневного мозга крыс выражают постепенно возрастающие количества изоформ α1, α2, β1 и β2 в зависимости от увеличения воздействия трийодтиронина [8]. В церебральной коре человека (рис.5-4) и крысе α3 мРНК находится в кластеризации над пирамидальной и другой нейронной сомой, тогда как α1 мРНК распределяется диффузно через нейропил. У лиц без сутенеров пожилых людей экспрессия α1 мРНК существенно не изменяется, хотя имеются значительные, но небольшие сокращения в α3 мРНК нейрональной перикарьи. Напротив, при деменции болезни Альцгеймера (глава 47) содержание α3 мРНК в нейрональной перикарье и нейропиле заметно снижается в начале нейродегенеративного процесса до дистрофических изменений нейронов (рис.5-4).
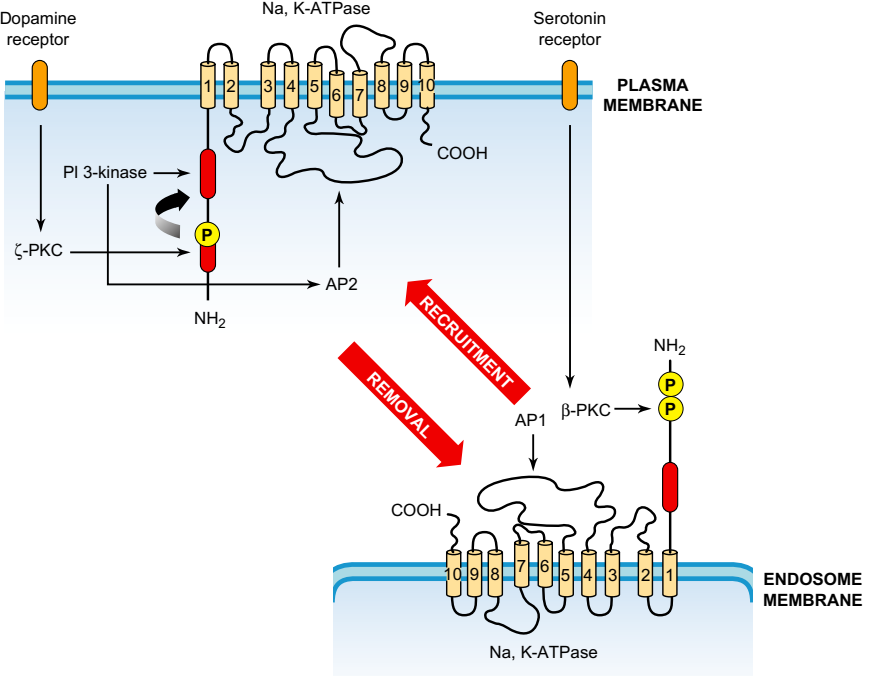
РИСУНОК 5-5. В эпителиальных клетках почек, которые экспрессируют только изомер α1, понижающую регуляцию Na, K насосов можно инициировать дофамином посредством активации GPCR эндоцитоза, и это контролируется фосфорилированием одного Ser-остатка в N- терминалы α-субъединиц Na, K-АТФазы для интернализации. Анализ мутаций предполагает, что активация PI3K-IA происходит от ее связывания с богатым пролином доменом, присутствующим в α-субъединице Na, K-АТФазы, но которая становится доступной только для киназы после Ѕ-PKC-зависимого Ser-фосфорилирования. Активация PI3K-IA набирает адаптеры AP-2, которые переносят везикулы плазматической мембраны в ранние эндосомы. Таким образом, Na, K-АТФаза служит своим собственным каркасом, организуя рецепторные сигналы, которые в конечном счете снижают его активность. Серотонин, действуя через GPCR, может активировать фосфорилирование β-PKC двух серинов в N-концах эндоцитированных Na-1-субъединиц Na, K-АТФазы. Это, очевидно, рекрутирует AP-1 адаптеры, которые инициируют повторное включение насосов Na, K в плазматическую мембрану. Однако в случае культивируемых стригальных колючих нейронов, которые экспрессируют все три изоформы Na, K-насоса, регуляция является более сложной: хотя допамин продуцирует понижающую регуляцию на основе эндоцитоза, это может быть предотвращено глутаматом, а глутамат может приводить к активации чистого насоса путем набора α2-изоформы [20]. (Адаптировано с разрешения на фиг.4 ссылки [83]).
Изоформы α-субъединицы представляют собой продукты отдельных генов, которые отличаются по 5'-фланкирующим регуляторным последовательностям. Они могут усилить или затруднить сборку комплекса пренициации РНК-полимеразы и соответствующих факторов транскрипции [9]. Выражение физиологической изоформы зависит от типа и зрелости клеток. В сердце крысы преобладающая форма переходит от неонатального α3 к взрослым α2. Изоформа α3 экспрессируется главным образом в взрослых нейронах и неонатальных кардиомиоцитах. Ген α3 демонстрирует три позитивно регулируемых цис-элемента, которые связывают NP-Y, Sp1 и Sp2 [10]. Специфичность нейронов, по-видимому, связана с нейрон-ограничительным элементом глушителя и положительно действующим цис-элементом [11]. «Базальный промотор», необходимый для конститутивной экспрессии гена α1, представляет собой позитивный регуляторный элемент, называемый ARE [12], содержащий сайты связывания для нескольких факторов транскрипции, включая элемент, чувствительный к цАМФ (CRE). CRE происходит внутри промоторов многих генов cAMPinducible и может взаимодействовать с CRE-связывающим (CREB) и CRE-модулятивным (CREM) белками и с активирующим транскрипционным фактором (ATF) -1. Это подгруппа в семействе лейцин-молнии, определяемая их сходством аминокислотной последовательности и способностью димеризоваться друг с другом. Сайт CRE регулируется несколькими путями, в том числе cAMP, Ca2 + и трансформирующим фактором роста (TGF) β. Фосфорилирование ATF-1 и CREB с помощью PKA или PKC усиливает их связывание с сайтом ATF / CRE и может потребоваться для транскрипции гена AT1 α1 [13]. Na, K-АТФаза подвержена гормональной регуляции. В гиппокампе крысы зубчатые гранулированные клетки экспрессируют изоформы α1 и α3, а у крыс с надпочечниками - альдостерон может избирательно регулировать α3 в этих нейронах. Однако в других кортикальных нейронах, которые экспрессируют обе мРНК, альдостерон не влияет ни на [14], а в почках альдостерон регулирует уровень экспрессии α1. Регулирование Isoform альдостероном, по-видимому, определяется местными факторами, такими как тип клеток и местоположение. Эти положительные или отрицательные локальные факторы в регуляции генов были названы «клеточным контекстом». Белковая система цАМФ или CREB также взаимодействует с системой рецепторов минералокортикоидов для модификации транскрипции α-субъединицы [15]. В крысиной коре почки альдостерон увеличивает α-1 субъединичную мРНК, и это, как было показано, происходит непосредственно из-за альдостерона, а не с увеличением потока Na + [16]. Альдостерон также усиливает мРНК изоформы α3 и β1 в мозге крыс надпочечников [17]. Na + также может регулировать экспрессию Na, K-pump. Изменения в локальной ионной среде за счет изменений в цитоплазматическом Ca2 + и Na + могут влиять на экспрессию Na, K-насоса через ранние ответы генов [18]