Введение в нейробиологию
12. Мембранный транспорт и генерация мембранных потенциалов
12.5. Транспортеры ABC
Транспортеры ABC являются продуктами одного из крупнейших надсемейств генов. Каждый из них состоит из двух цитоплазматических нуклеотидсвязывающих доменов (NBD) и двух трансмембранных доменов (TMD). NBD высококонсервативны в семействе ABC и содержат мотивы, типичные для сайтов ATPbinding, тогда как структуры TMD изменяются, вероятно, потому, что они адаптированы к широкому спектру субстратов. У эукариот C-конец каждого NBD связан с TMD. В некоторых случаях функциональная единица (NBD-TMD) 2, а в других, первая TMD ковалентно связана со вторым NBD. Определены трехмерные структуры нескольких АВС-транспортеров из прокариотов. На рис. 5-10 сравниваются структуры NBD из почти идентичных транспортеров из Vibrio cholerae и Escherichia coli, которые кристаллизовались с их TMD в двух «закрытых» и «открытых» конформациях соответственно.
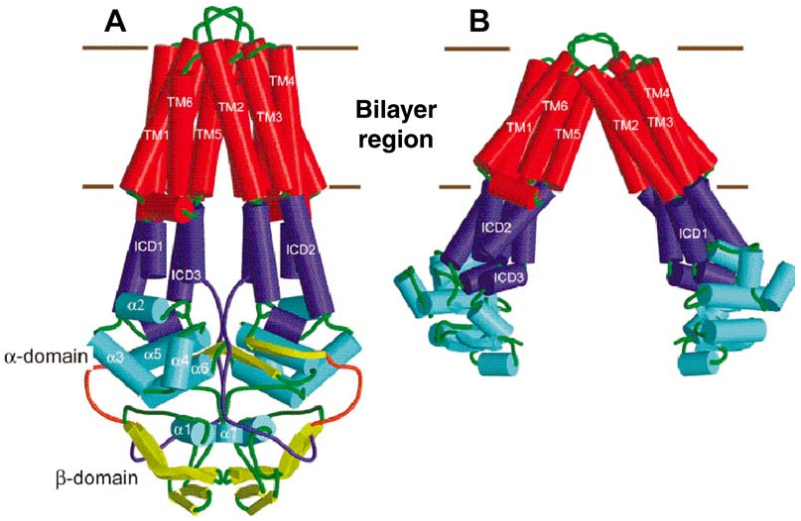
РИСУНОК 5-10 (A) Структура транспортера ABC с множественной лекарственной устойчивостью, VC-MsbA, выраженная Vibrio cholerae. Взгляните в отверстие камеры (вид сбоку). Трансмембранный домен (TMD), внутриклеточный домен (ICD) и нуклеотидсвязывающий домен (NBD) окрашены в красный, синий и голубой. Отображаются трансмембранные и NBD-спирали, а соединительные петли показаны зеленым цветом. Цикл, соединяющий α- и β-домены NBD, показан оранжевым. АТФ-связывающие β-листы выделяются желтым цветом. Коричневые линии указывают приблизительное расположение клеточной мембраны. (B) Соответствующий вид очень сходного АВС-транспортера, выраженного Escherichia coli, Eco-MsbA. Получены кристаллы этих двух белков, которые имеют соответственно закрытые и открытые конформации. (С разрешения на фиг.2 ссылки [87].)
Гипотетически, субстрат будет приобретаться и транспортироваться в результате активизации конформационного цикла, связывая его с гидролизом АТФ. В замкнутой конформации (рис. 5-10А) две NBD-домены связываются друг с другом и, как показано на рисунке 5-11, нуклеотидное связывание происходит в карманах, образованных между этими двумя доменами.
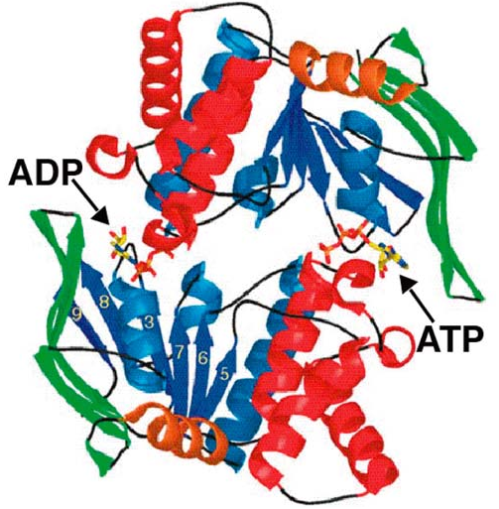
РИСУНОК 5-11 Ленточная диаграмма димера NBD (PDB 1f30). β-нити изображаются стрелками и α-спиралями в виде спиральных лент. Два нуклеотида, показанные как модели палочек, связываются, чтобы сформировать часть интерфейса, которая стабилизирует димерное взаимодействие. (С разрешения на фиг.5 справки [88].)
Стехиометрия и нуклеотидная селективность этих связывающих карманов были определены для АВС-транспортера, который функционирует для экспорта пептидов из дрожжевых митохондрий [34]. Результаты этого исследования привели к тому, что предложенный реакционный цикл был описан и описан на рисунке 5-12.
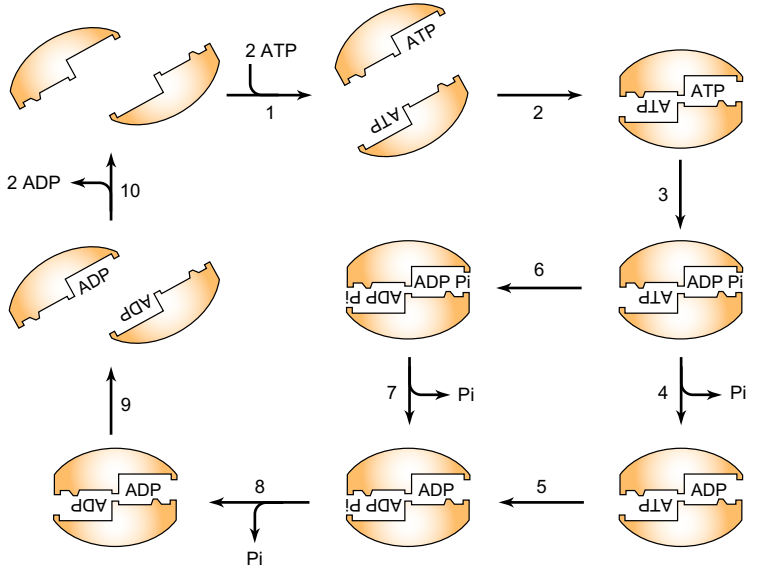
РИСУНОК 5-12. Модель последовательного зажима для цикла ATPase транспортера ABC Mdl1p. Связывание АТФ (этап 1) на доменах NBD обоих мономеров индуцирует образование димера (стадия 2). После гидролиза АТФ с помощью первого NBD (стадия 3) сначала выделяют либо Pi (этап 4), затем гидролиз второго ATP (этап 5), так и высвобождение второго Pi (этап 8) или второй ATP представляет собой сначала подвергают гидролизу (стадия 6), а затем обе фосфаты освобождают (этапы 7 и 8). После того как оба АТФ гидролизуются до АДФ и оба фосфата высвобождаются, димерный комплекс диссоциирует (этап 9) и АДФ (этап 10) высвобождается. Цикл гидролиза может снова начаться с связывания АТФ. (С разрешения на фиг.7 ссылки [34].)
ABCA1 функционирует, чтобы транслоцировать холестерин и фосфолипиды наружу через плазматическую мембрану после их доставки во внутренний лист плазменной мембраны через везикулярные пути [35]. Это происходит в астроцитах и развивающихся нейронах. Астроциты также секретируют апоЕ. Внеклеточный apoE связывается и взаимодействует с ABCA1 для стимулирования холестерина и оттока ПК из культивируемых астроцитов с помощью механизма, который приводит к стабилизации апоЕ HDL-подобными частицами (см. Рис. 2-7). В отсутствие аполипопротеина ABCA1 быстро протеолизируется кальпаином с T1 / 2, содержащим приблизительно 20 минут в некоторых клетках. Однако аполипопротеины защищают ABC1A от кальпаина и повышают его уровень экспрессии [36]. Таким образом, взаимодействие аполипопротеина с ABCA1 является частью регуляционного процесса оттока холестерина. Тесно связанный транспортер ABCA2 экспрессируется в олигодендроцитах и заметно усиливается во время миелинизации [37].
Другое подсемейство ABC, белки с множественной лекарственной устойчивостью (MDR), может «переворачивать» амфипатические молекулы, включая мембранные фосфолипиды и сфинголипиды, от внутреннего к внешнему лифту плазматических мембран [38]. Один член MDR3 может избирательно транспортировать фосфатидилхолин [39]. MDR1or 'P-гликопротеин' является классическим MDR, состоящим из двух кассет внутри одной пептидной цепи. Выкачивая лекарства из клеток, повышенная экспрессия во время химиотерапии может снизить хемочувствительность раковых клеток. P-гликопротеин экспрессируется в высоких концентрациях в просветных мембранах мозговых капилляров [40] и, вероятно, объясняет многие функции исключения лекарств гематоэнцефалического барьера. Адренолеодистрофия и синдром Зеллвегера (глава 41) являются результатом дефектов в двух разных генах, которые определяют белки «одной кассетой», нацеленные на пероксисомы.