Дисциплина Биофизика белка (7 семестр)
Самостоятельная работа 1. Классификация фолдинга растворимых белков
Круговой дихроизм
В белках такие структуры, как альфа-спирали и бета-слои , являются хиральными и, таким образом, поглощают такой свет.
Поглощение этого света служит маркером степени складчатости белкового ансамбля.
Этот метод использовался для измерения равновесного развертывания белка путем измерения изменения этого поглощения в зависимости от
концентрации денатуранта или температуры . Денатурирующий расплав измеряет свободную энергиюразворачивания, а также значение m белка или
зависимость от денатурации. Температура плавления измеряет температуру денатурации (Tm) белка. Что касается флуоресцентной спектроскопии,
спектроскопию кругового дихроизма можно комбинировать с устройствами быстрого перемешивания, такими как остановленный поток ,
для измерения кинетики сворачивания белка и создания шевронных графиков.
Спектроскопия кругового дихроизма измеряет поглощение света с круговой поляризацией .
Колебательный круговой дихроизм белков Более поздние разработки методов колебательного кругового дихроизма (VCD) для белков,
растворе даже для очень больших белковых
молекул. Такие VCD-исследования белков можно комбинировать с данными рентгеновской
дифракции для
белковых кристаллов, данными FT-IR для белковых растворов в тяжелой воде (D 2 O)
или квантовыми
вычислениями .
в настоящее время использующие инструменты преобразования
Фурье (FT), предоставляют мощные средства для определения
конформаций белка
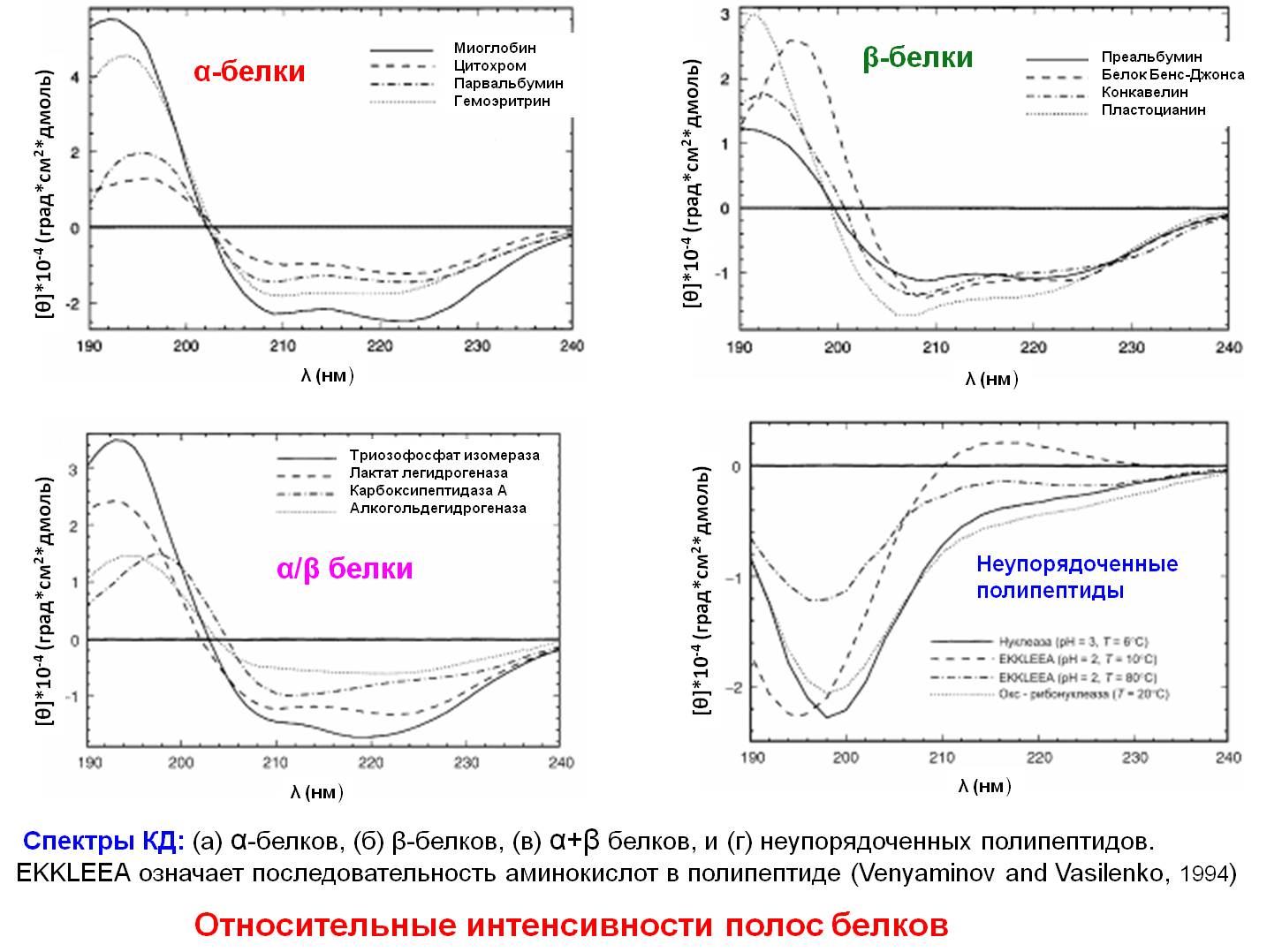
КД
стал одним из популярных методов для
оценки вторичной структуры белков в
растворах, поскольку он требует
относительно малого количества образца,
экспериментальная процедура проста.
Сигнал КД очень интенсивен в области
поглощения пептидной связи в дальнем УФ,
что позволяет использовать довольно
разбавленные растворы с концентрацией
порядка десятых долей миллиграмма на миллилитр.
Измерение КД особенно полезно для наблюдения за структурными и конформационными изменениями в
молекуле. Однако, вследствие сложности
белковой структуры и зависимости спектра
от локального окружения в молекуле,
интерпретация в терминах структуры основывается на эмпирических критериях. Из анализа базы
данных белковых структур известно,
что наиболее распространенными
вторичными структурами являются а-спиралии β-листы,поэтому белки
классифицируют в соответствии с их
топологической организацией . Благодаря наличию в белках триптофана и тирозина, КД в ближнем УФ (где поглощают эти аминокислотные остатки) чувствителен к их третичной структуре. КД также играет важную роль в изучении процесса
сворачивания белков, поскольку сигнал неструктурированного полипептида существенно отличается от сигнала
структурированного полипептида, имеющего вторичную и третичную структуру.
КД-спектры
макромолекул в растворе соответствуют
электронным переходам между низшим колебательным уровнем основного
состояния и различными колебательными уровнями в первом
возбужденном состоянии.
КД полосы β-белков гораздо разнообразнее и менее
интенсивны чем полосы α-белков.
КД-спектры α/β-белков - смесь спектров
α-спиралей и β-структур с доминированием полос α-спирали.
Базы данных КД-спектров созданы на основе данных
кристаллографии и ЯМР.
КД-спектры — определение состояния белка при
сворачивании:
- спектр в дальнем УФ - информация о
присутствии или отсутствии вторичной структуры
- спектр в ближнем УФ — информация о третичной
структуре.
КД - сигнал нуклеиновых кислот обусловлен
преимущественно гидрофобными взаимодействиями пар оснований в спирали, и,
следовательно, зависит от вторичной структуры.
КД-анализ углеводов позволяет отличить
неупорядоченный клубок от спиральной конформации, жесткие структуры от гибких,
и в подходящих условиях, тип связи между мономерными
субъединицами, которые, в отличие от белков и нуклеиновых кислот,
отличаются большим разнообразием.
КД-спектрометры с использованием синхротронного
излучения позволяют получать спектры в диапазоне
длин волн 190-160 нм (для обычных
лабораторных спектрометров недоступен)
↓
Можно более точно предсказать вторичную структуру
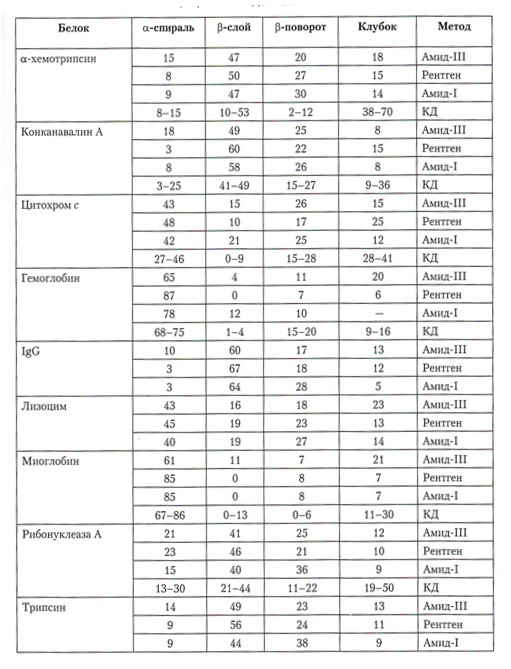
Сравнение содержания элементов вторичной структуры белков с помощью ИК-спектров в области полос амид-I и амид-Ill,КД-спектров и
рентгеновских кристаллографических данных
белковых кристаллов, данными FT-IR для белковых растворов в тяжелой воде (D 2 O) или квантовыми вычислениями .

КД-спектры α/β-белков - смесь спектров α-спиралей и β-структур с доминированием полос α-спирали.
Базы данных КД-спектров созданы на основе данных кристаллографии и ЯМР.
КД-спектры — определение состояния белка при сворачивании:
- спектр в дальнем УФ - информация о присутствии или отсутствии вторичной структуры
- спектр в ближнем УФ — информация о третичной структуре.
КД - сигнал нуклеиновых кислот обусловлен преимущественно гидрофобными взаимодействиями пар оснований в спирали, и,
следовательно, зависит от вторичной структуры.
КД-анализ углеводов позволяет отличить неупорядоченный клубок от спиральной конформации, жесткие структуры от гибких,
и в подходящих условиях, тип связи между мономерными субъединицами, которые, в отличие от белков и нуклеиновых кислот,
отличаются большим разнообразием.
КД-спектрометры с использованием синхротронного излучения позволяют получать спектры в диапазоне
длин волн 190-160 нм (для обычных лабораторных спектрометров недоступен)
Сравнение содержания элементов вторичной структуры белков с помощью ИК-спектров в области полос амид-I и амид-Ill,КД-спектров и
рентгеновских кристаллографических данных

