Приём пищи человеком происходит иногда со значительными интервалами, поэтому в организме выработались механизмы депонирования энергии. ТАГ (нейтральные жиры) – наиболее выгодная и основная форма депонирования энергии. Депонированный жир может обеспечивать организм энергией при голодании в течение длительного времени (до 7–8 недель). Синтез ТАГ происходит в абсорбтивный период в печени и жировой ткани. Но если жировая ткань – только место депонирования жира, то печень выполняет важную роль превращения части углеводов, поступающих с пищей, в жиры, которые затем секретируются в кровь в составе ЛПОНП и доставляются в другие ткани. Непосредственными субстратами в синтезе жиров являются ацил-КоА и глицерол-3-фосфат. Метаболический путь синтеза жиров в печени и жировой ткани одинаков, за исключением разных путей образования глицерол-3-фосфата.
Печень – основной орган, где идет синтез жирных кислот из продуктов гликолиза. В гладком эндоплазматическом ретикулюме гепатоцитов жирные кислоты активируются и сразу же используются для синтеза ТАГ, взаимодействуя с глицерол-3-фосфатом. Синтезированные жиры упаковываются в ЛПОНП и секретируются в кровь.
В жировой ткани для синтеза ТАГ используются в основном жирные кислоты, освободившиеся при гидролизе жиров ХМ и ЛПОНП. Жирные кислоты поступают в адипоциты, превращаются в производные КоА и взаимодействуют с глицерол-3-фосфатом. Кроме жирных кислот, поступающих в адипоциты из крови, в этих клетках идет и синтез жирных кислот из продуктов распада глюкозы. Молекулы ТАГ в адипоцитах объединяются в крупные жировые капли, не содержащие воды, и поэтому являются наиболее компактной формой хранения топливных молекул.
Регуляция синтеза триацилглицеролов
В абсорбтивный период при увеличении соотношения инсулин/глюкагон активируется синтез ТАГ в печени. В жировой ткани индуцируется синтез липопротенлипазы (ЛПЛ), т.е в этот период активируется поступление жирных кислот в адипоциты. Одновременно инсулин активирует белки-переносчики глюкозы – ГЛЮТ-4, что ведет к увеличению поступления глюкозы в адипоциты и активации там гликолиза. В результате образуются необходимые для синтеза жиров глицерол-3-фосфат и активированные жирные кислоты. В печени в результате действия инсулина увеличивается количество и активность регуляторных ферментов гликолиза, пируватдегидрогеназного комплекса, а также ферментов, участвующих в синтезе жирных кислот из ацетил-КоА. Итогом этих изменений является увеличение синтеза ТАГ и секреция их в кровь в составе ЛПОНП. ЛПОНП доставляют жиры в капилляры жировой ткани, где действие ЛПЛ обеспечивает быстрое поступление жирных кислот в адипоциты, где они депонируются в составе ТАГ.
Мобилизация жиров, т.е. гидролиз до глицерола и жирных кислот, происходит в постабсорбтивный период, при голодании и активной физической работе. Процесс осуществляется под действием гормончувствительной ТАГ-липазы. Этот фермент отщепляет одну жирную кислоту у первого углеродного атома глицерола с образованием диацилглицерола, а затем другие липазы гидролизуют его до глицерола и жирных кислот, которые поступают в кровь. Глицерол как водорастворимое вещество транспортируется кровью в свободном виде, а жирные кислоты – в комплексе с белком плазмы альбумином.
Регуляция мобилизации триацилглицеролов
Мобилизация депонированных ТАГ стимулируется глюкагоном и адреналином, и, но в гораздо меньшей степени, соматотропным гормоном и кортизолом. В постабсорбтивный период и при голодании глюкагон, действуя на адипоциты через аденилатциклазную систему, активирует гормончувствительную липазу, что инициирует липолиз и выделение жирных кислот и глицерола в кровь. При физической активности увеличивается секреция адреналина, который также через аденилатциклазную систему активирует липолиз. В настоящее время предполагается, что действие адреналина двояко: при низких концентрациях в крови преобладает его антилиполитическое действие через α2-рецепторы, а при высокой – преобладает липолитическое действие через β-рецепторы.
В результате мобилизации ТАГ концентрация жирных кислот в крови увеличивается приблизительно в 2 раза, но они достаточно быстро утилизируются. Для мышц, сердца, почек, печени при голодании или физической работе жирные кислоты становятся важным источником энергии. Печень перерабатывает часть жирных кислот в кетоновые тела, используемые мозгом, нервной и некоторыми другими тканями как источники энергии. Когда постабсорбтивный период сменяется абсорбтивным, инсулин через промежуточные механизмы подавляет активность гормончувствительной липазы и распад жиров останавливается
Липолиз - новое прочтение
Мобилизация жира
В настоящее время, после открытия в 2004 году адипоцитарной триглицеридлипазы (ATGL, adipose triglyceride lipase, деснутрин), прежняя концепция липолиза получила новое прочтение. ATGL несет ответственность за большую часть липолитической активности как в базальных, так и в стимулированных условиях.
В обычных условиях на поверхности липидной капли находятся белок перилипин, ATGL и ее коактиватор под названием CGI-58 (comparative gene identification-58, или также Abhd5, abhydrolase domain-containing 5).
Гормон-чувствительная липаза (HSL, hormone sensitive lipase) и белок, переносящий жирные кислоты (FABP, fatty acid binding protein) в это время преимущественно находятся в цитоплазме.
В спокойном адипоците
- ATGL отщепляет жирные кислоты (С16-С18) во 2-м положении триацилглицерола с образованием продукта 1,3-ДАГ. Происходит базальный липолиз.
В стимулированном адипоците
- перилипин, фосфорилируемый протеинкиназой А, изменяет свою конформацию и уходит от поверхности липидной капли в цитозоль.
- белок CGI-58 отделяется от перилипина и присоединяется к ATGL, формируя с ней активный комплекс и меняя ее специфичность.
- триглицеридлипаза (ATGL), после связывания с CGI-58, начинает отщеплять от 1-го положения триацилглицеролов жирные кислоты, продуцируя 2,3-ДАГ. Именно 2,3-ДАГ является субстратом гормон-чувствительной липазы (HSL).
- гормон-чувствительная липаза (HSL) фосфорилируется протеинкиназой А и/или протеинкиназой G и в такой активной форме мигрирует к липидной капле. Отсутствие перилипина позволяет этой липазе подобраться к ядру липидной капли, где она гидролизует 2,3-диацилглицеролы до моноацилглицеролов и свободной жирной кислоты.
- МАГ-липаза находится как в цитозоле, так и на поверхности липидной капли и гидролизует моноацилглицеролы.
Хотя главным субстратом HSL являются диацилглицеролы, также она может гидролизовать ТАГ и МАГ, в соотношении скоростей гидролиза 20 : 2 : 1 для ДАГ:ТАГ:МАГ соответственно.
Жирные кислоты покидают жировую клетку и переносятся кровотоком, связываясь с сывороточным альбумином; затем они освобождаются от него и проникают в мишеневые клетки с помощью БПЖК (белки-переносчики жирных кислот).
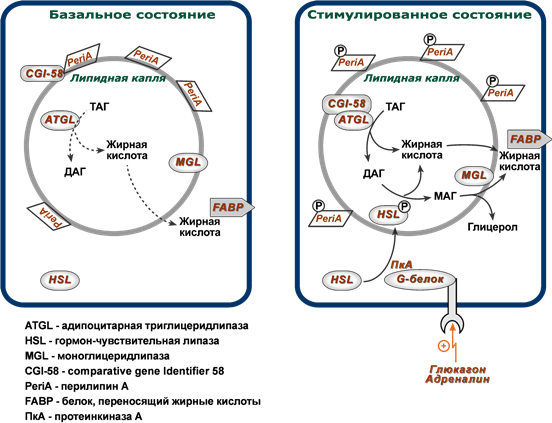
Регуляция липолиза в адипоците
Основную роль в липолизе играет изменение состояния перилипина под воздействием протеинкиназы А. Фосфорилирование гормон-чувствительной липазы, хотя и повышает ее активность в 2-3 раза, тем не менее, не способно обеспечить возрастание общей мощности процесса до 50 раз, которое наблюдается при гормональной стимуляции.
Базальный распад и синтез триацилглицеролов в жировой ткани объединены в субстратный цикл. 1,3-ДАГ, продукт малоактивной ATGL, является предпочтительным субстратом одного из ферментов синтеза триацилглицеролов – ДАГ-ацил-трансферазы. В результате ATGL и ДАГ-ацил-ТФ действуют скоординированно и поддерживают цикл гидролиз-реэтерификация ТАГ.
В состоянии покоя около 70% жирных кислот, высвобожденных при участии малоактивной ATGL, не покидают клетку и включаются обратно в состав ТАГ. Остальные 30% жирных кислот выходят в кровь. Вышедшие в кровь жирные кислоты используются в тканях, и их часть неминуемо попадает в печень, где они реэтерифицируются в ТАГ, далее формируется их транспортная форма ЛПОНП. При метаболизме последних в плазме крови образуются остаточные ЛПОНП, некоторая часть которых превращается в синусоидах печени в атерогенные ЛПНП.
Активации субстратного цикла жирных кислот также способствует часто наблюдающийся дисбаланс между потреблением насыщенных и полиненасыщенных жирных кислот, так как липидная капля в адипоците окружена монослоем фосфолипидов, которые должны содержать ПНЖК. При нарушении синтеза фосфолипидов доступ ATGL-липазы к триацилглицеролам облегчается и их гидролиз ускоряется, возрастает доля насыщенных ЖК, выходящих в кровь.
Избыток насыщенных ЖК крови легко переходит в клеточные мембраны и задерживается здесь, образуя кластеры. Это меняет свойства мембраны, нарушает ионные потоки, ухудшает взаимодействие рецепторов с их лигандами.

