Основным путем образования пуриновых нуклеотидов является синтез из простых предшественников (de novo). В этом метаболическом пути свободное азотистое основание не образуется, а пуриновое кольцо формируется на остатке рибозо-5-фосфата при участии глицина, амидного азота Глн, а-NН2-группы Асп, СО2 и одноуглеродных производных: метенил- и формил-Н4-фолата. Синтез пуриновых оснований происходит во всех клетках организма, главным образом в печени. Исключение составляют эритроциты, полиморфноядерные лейкоциты, лимфоциты.
Условно все реакции синтеза можно разделить на 4 этапа:
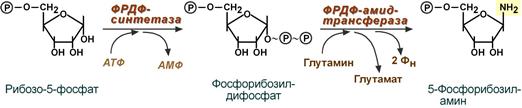
1. Синтез 5'-фосфорибозиламина
Первая реакция синтеза пуринов заключается в активации углерода в положении С1 рибозо-5-фосфата, это достигается синтезом 5-фосфорибозил-1-дифосфата (ФРДФ). Рибозо-5-фосфат является тем якорем, на основе которого синтезируется сложный пуриновый цикл.
Вторая реакция – это перенос NH2-группы глутамина на активированный атом С1 рибозо-5-фосфата с образованием 5'-фосфорибозиламина. Указанная NH2-группа фосфорибозиламина уже принадлежит будущему пуриновому кольцу и ее азот будет атомом номер 9.
Реакции синтеза 5'-фосфорибозиламина
Параллельно фофорибозилдифосфат используется при
синтезе пиримидиновых нуклеотидов. Он реагирует с оротовой кислотой и рибозо-5-фосфат связывается с ней, образуя оротидилмонофосфат (реакция).
2. Синтез инозинмонофосфата
5-фосфорибозиламин вовлекается в девять реакций, и в результате образуется первый пуриновый нуклеотид – инозинмонофосфорная кислота (ИМФ). В этих реакциях источниками атомов пуринового кольца являются глицин, аспартат, еще одна молекула глутамина, углекислый газ и производные тетрагидрофолиевой кислоты (ТГФК). В целом на синтез пуринового кольца затрачивается энергия 6 молекул АТФ.
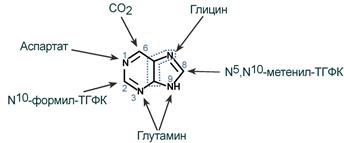
Источники атомов пуринового кольца
В схеме представлена последовательность всех 11 химических реакций этого синтеза с указанием ферментных систем, коферментов, источников энергии и других известных к настоящему времени кофакторов.
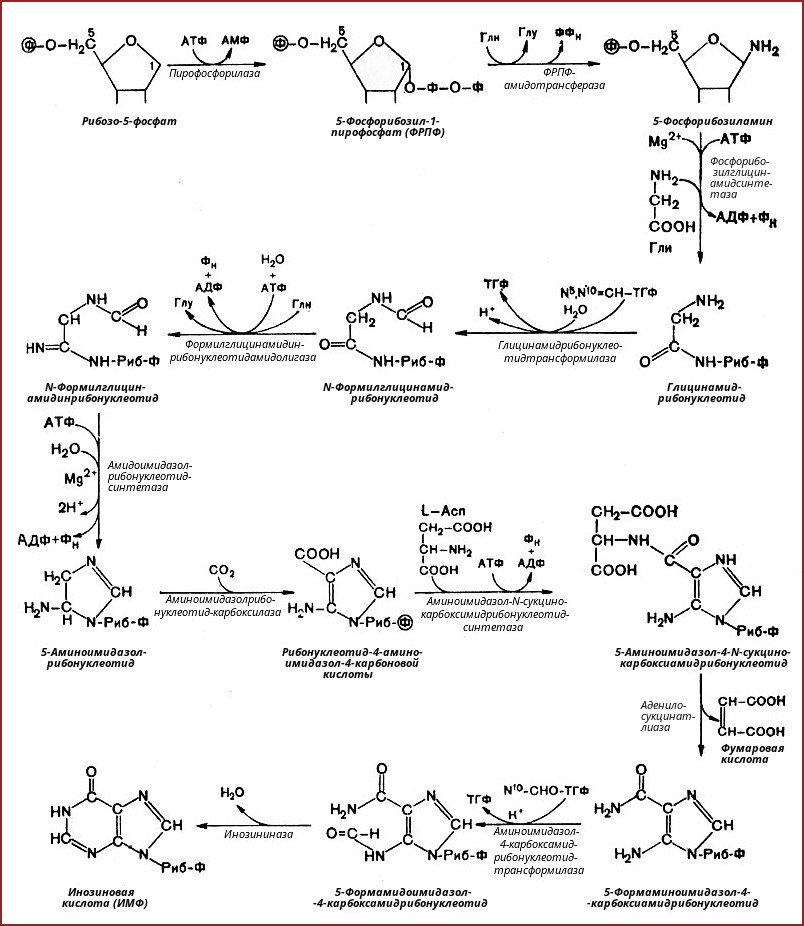
3. Синтез аденозинмонофосфата и гуанозинмонофосфата
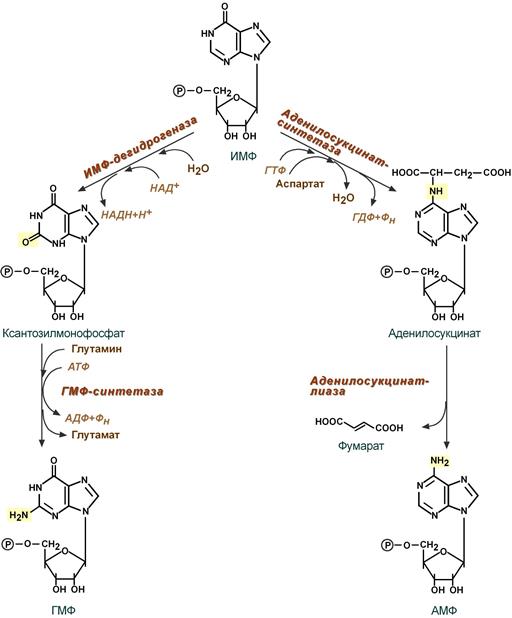
- Гуанозинмонофосфат (ГМФ) образуется в двух реакциях – сначала он окисляется ИМФ-дегидрогеназой до ксантозилмонофосфата, источником кислорода является вода, акцептором водорода – НАД. После этого работает ГМФ-синтетаза, она использует универсальный клеточный донор NH2-групп – глутамин, источником энергии для реакции служит АТФ.
- Аденозинмонофосфат (АМФ) также образуется в двух реакциях, но в качестве донора NH2-группы выступает аспарагиновая кислота. В первой, аденилосукцинат-синтетазной, реакции на присоединение аспартата используется энергия распада ГТФ, во второй реакции аденилосукцинат-лиаза производит удаление части аспарагиновой кислоты в виде фумарата.
4. Образование нуклеозидтрифосфатов АТФ и ГТФ.
Синтез ГТФ осуществляется в 2 стадии посредством переноса макроэргических фосфатных групп от АТФ. Синтез АТФ происходит несколько иначе. АДФ из АМФ образуется также за счет макроэргических связей АТФ. Для синтеза же АТФ из АДФ в митохондриях есть фермент АТФ-синтаза, образующий АТФ в реакциях окислительного фосфорилирования.
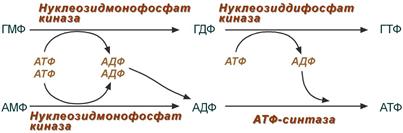
Другим минорным источником АТФ является субстратное фосфорилирование в гликолизе и ЦТК
Образование дезоксирибонуклеотидов
Особенностью обмена пуринов является то, что они могут образовывать не только рибонуклеотиды, но и дезоксирибонуклеотиды.
Дезоксирибонуклеозидтрифосфаты необходимы клетке для синтеза ДНК. Их образование протекает в три реакции, первая и третья реакции просты и понятны. Главные события происходят во второй реакции.
Все три реакции синтеза дезоксирибонуклеотидов
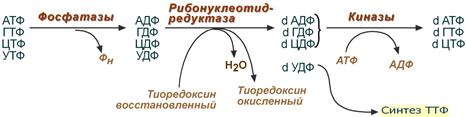
1. Реакция дефосфорилирования
В самом начале процесса происходит потеря рибонуклеозидтрифосфатами одной фосфатной группы и образуются АДФ, ГДФ, ЦДФ, УДФ.
2. Реакция восстановления
Во второй реакции фермент рибонуклеозид-редуктаза восстанавливает АДФ, ГДФ, ЦДФ, УДФ до дезоксирибонуклеозиддифосфатов dАДФ, dГДФ, dЦДФ, dУДФ. Донором водорода для восстановления рибозы является белок тиоредоксин, его SH-группы окисляются кислородом рибозы и образуется вода. Последующее восстановление тиоредоксина в рабочее состояние обеспечивается за счет НАДФН.
Механизм реакции синтеза дезоксирибонуклеотида
3. Реакция фосфорилирования
После образования dАДФ, dГДФ, dЦДФ фосфорилируются, а dУДФ используется для синтеза тимидилового нуклеотида.
Тиоредоксины
Тиоредоксины — семейство маленьких белков, представленный во всех организмах от архей до человека. Они участвуют во многих важных биологических процессах, включая определение окислительно-восстановительного потенциала клетки и передачу сигнала. У человека тиоредоксин кодируется геном TXN. Мутации, приводящие к потери функциональности даже одного аллеля этого гена, приводят к смерти на стадии четырёхклеточного эмбриона. Тиоредоксин играет значительную роль в организме человека, хотя и не до конца ясно какую именно. Всё чаще и чаще его возможные функции связывают с действием лекарств и противодействием активным формам кислорода. У растений тиоредоксины регулируют целый спектр жизненно важных функций, начиная от фотосинтеза и роста и заканчивая цветением, развитием и прорастанием семян. А совсем недавно выяснилось, что они также участвует в межклеточном взаимодействии и обмене информацией между растительными клетками
Тиоредоксины представляют собой белки с массой около 12 кДа. Их отличительная особенность — наличие двух расположенных рядом остатков остатков цистеина, заключённых в мотив типа CXXC, где С — цистеин, а Х — любая, как правило гидрофобная, аминокислота. Ещё одна отличительной черта всех тиоредоксинов — специфическая третичная структура, которая называется тиоредоксиновой укладкой.
Главной частью белка является дисульфидная связь. При помощи этой неё он может восстанавливать дисульфидные связи других белков, разрушая в них дисульфидные мостики. Таким образом он регулирует активность некоторых ферментов. Кроме того, восстанавливая дисульфидные связи, тиоредоксин поставляет электроны, которые затем используются во многих биохимических процессах клетки. Например, вместе с глутатионом он поставляет электроны для рибонуклеотидредуктазы, то есть участвует в синтезе дезоксинуктлеотидов, и ФАФС-редуктазы. В этом плане, его функция сходна с таковой у глутатиона и частично с ней перекрывается. Так, тиоредоксин является сильным антиоксидантом: вместе с глутатионовой системой тиоредоксиновая система участвует в обезвреживание активных форм кислорода, передовая электроны различным пероксидазам. Исследования показали, что тиоредоксин взаимодействует с рибонуклеазой, хориогонадотропинами, факторами коагуляции, глюкокортикоидным рецептором и инсулином. Реакцию тиоредоксина с инсулином традиционно используют для определения активности тиоредоксина. Было показано, что тиоредоксин способен стимулировать связывание факторов транскрипции с ДНК. Эти факторы были определены как ядерный фактор NF-κB, который является важным фактором в клеточной реакции на окислительный стресс, апоптоз и процессы опухолеобразования.
Восстановление тиоредоксина осуществляет специальный флавопротеин тиоредоксин редуктаза, который использует для этого одну молекулу НАДФН. Глутаредоксины во многом сходны по функциям с тиоредоксинами, но вместо специфической редуктазы они восстанавливаются глутатионом.
 | ↔ 2 H+ + 2 e- + |  |
| Восстановленный тиоредоксин | | Окисленный тиоредоксин |
Способность тиоредоксинов противостоять окислительному стрессу была продемонстрирована в эксперименте с трансгенными мышами у которых была повышенная экспрессия тиоредоксина. Трансгенные мыши лучше сопротивлялись воспалительным реакциям и жили на 35 % дольше. Такие данные служат существенным аргументом в пользу свободнорадикальной теории старения. Тем не менее, результаты исследования нельзя считать достоверными, поскольку контрольная группа мышей жила значительно меньше обычного, что могло создать иллюзию увеличения продолжительности жизни у трансгенных мышей[9].
У растений существует очень сложная система тиоредоксинов, состоящая из шести хорошо различимых типов (тиоредоксины f, m, x, y, h, и o). Они расположены в разных частях клетки и участвуют в массе различных процессов. Именно действие тиоредоксинов лежит в основе светозависимой активации ферментов. На свету, в результате совместного действия фотосистемы I и фотосистемы II образуется большое количество восстановительных эквивалентов — ферредоксинов. По достижении определённой концентрации ферредоксина, за счёт действия Фермент ферредоксин-тиоредоксинредуктазы происходит восстановление тиоредоксина, который в свою очередь активирует ферменты, восстанавливая дисульфидные связи. Таким путём активируется по крайней мере пять ключевых ферментов цикла Кальвина, а также белок-активаза Рубиско, альтернативная оксидаза митохондрий и терминальная оксидаза хлоропластов. Механизм активации через тиоредоксин позволяет регулировать активность ферментов не только в зависимости от соотношения НАДФН/НАДФ+, но и одновременно от интенсивности света. В 2010 году была открыта необычная способность тиоредоксинов перемещаться из клетки в клетку. Такая способность лежит в основе нового, ранее не известного для растений, способа межклеточной коммуникации