Нарушения пуринового обмена
13. Общие принципы терапии подагры
13.7. Фебуксостат
Для характеристики взаимодействия фебуксостата с энзимом-мишенью были проведены кинетические исследования с изучением образующейся при их взаимодействии кристаллической структуры фебуксостат—КОР. Было показано, что фебуксостат, как и аллопуринол, ингибирует фермент путем присоединения к молибден-птериновому центру, единому у всех пуринов (рис. 2). Однако имеется целый ряд различий этого взаимодействия.
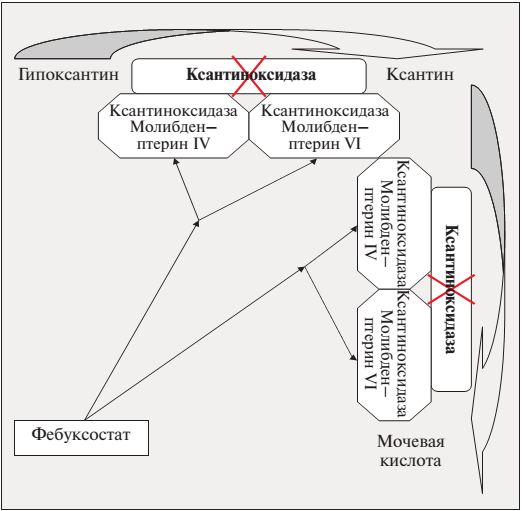
1. Подавление различных форм энзима: аллопуринол связывается только с редуцированной формой энзима, фебуксостат формирует комплекс с обеими формами КОР – редуцированной и оксидированной (MoVI и MoIV). Преимущество фебуксостата становится особым в свете того, что две различные формы энзима могут обмениваться ионами молибдена («пинг-понг»-механизм) и, превращаясь из одной формы в другую, «уходить» от действия аллопуринола.
2. Особенности формирования кристаллической связи с энзимом: фебуксостат практически полностью заполняет узкие каналы, ведущие к молибденовому центру, стойко подавляя активность фермента. Аллопуринол является ин- гибитором механизма действия энзима, временно устраняя его активность.
3. Плотность связей: фебуксостат ингибирует энзим путем образования высокоаффинных крепких связей c обеими формами энзима, аллопуринол демонстрирует более слабую связь с одной формой фермента.
4. Реактивация энзима: фермент, ингибированный аллопуринолом, реактивируется быстро (t1/2=300 мин при 25 °C) под действием спонтанной реоксидации молибде нового центра. Фебуксостат, напротив, подавляет энзим длительно из-за крайне стабильных связей вследствие того, что он не разрушается под действием окислительного статуса кофакторов.
5. Селективность: фебуксостат практически не влияет на другие ферменты пуринового и пиримидинового метаболизма, в отличие от аллопуринола, что позволяет называть его селективным ингибитором ксантиноксидазы. Предполагалось, что эти свойства могут обеспечить фебуксостату преимущество над аллопуринолом, позволяя получить клинический эффект при значительно меньшей концентрации препарата в плазме