Дисциплина Медицинская биохимия. Принципы измерительных технологий в биохимии. Патохимия, диагностика. Биохимия злокачественного роста». Часть 3
Молекулярная биология регуляции артериального давления и фармакологические мишени управления гемодинамикой.
3. Гуморальная регуляция тонуса гладких мышц сосудов и ОЦК
3.10. Ангиотензиновые рецепторы как мишень фармакологического воздействия.
Антагонисты рецепторов ангиотензина (АРА) — относительно новый класс среди гипотензивных препаратов первого ряда, рекомендованных для лечения артериальной гипертензии ВОЗ/МОГ в 1999 году. Первый препарат АРА для перорального применения — лосартан — был синтезирован группой исследователей во главе с P.Timmermans в 1988 году и применяется в клинике с 1994 года. В целом АРА оказывают антигипертензивный эффект, аналогичный другим препаратам первого ряда, но отличаются низкой частотой побочных эффектов и очень хорошей переносимостью.
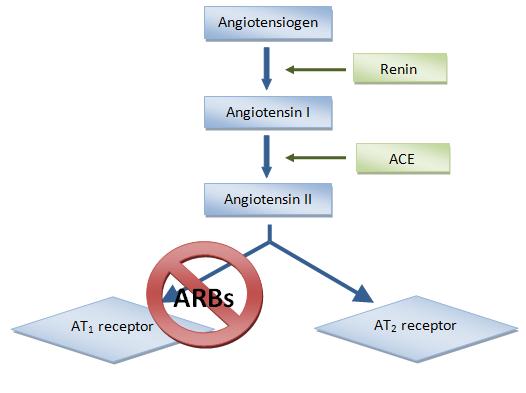
Препараты этой группы не влияют на образование ангиотензина II. Точка приложения их действия —рецепторы ангиотензина II 1-го типа — находится на периферии биохимического каскада ренин-ангиотензиновой системы (см. рис. 9.1). Избирательное действие АРА именно на рецепторы 1 -го типа ангиотензина II позволяет устранить негативные влияния РАС на сердечно-сосудистую систему, вместе с нежелательными эк- стракардиальными эффектами. В то же время сохраняются потенциально положительные эффекты стимуляции рецепторов 2-го типа (антипролиферативное действие, вазодилатация).

В 1970-х годах было показано, что повышение уровня Ang II может нанести вред сердцу и почкам, а люди с высоким уровнем активности ренина в плазме подвергались повышенному риску инфаркта миокарда и инсульта [4]. С введением ингибиторов ангиотензинпревращающего фермента (АПФ) в конце 1970-х годов было подтверждено, что Ang II играет важную роль в регулировании артериального давления, электролитов и баланса жидкости [5].
Ang II связывается с АТ1-рецепторами через различные сайты связывания [1]. Первичный сайт связывания находится во внеклеточной области АТ1-рецептора, где Ang II взаимодействует с остатками в N-конце рецептора AT1 и его первой и третьей внеклеточных петель. Трансмембранные спирали также способствуют связыванию через С-концевую карбоксильную группу, которая взаимодействует с Lys199 в верхней части спирали 5 рецептора, подробности см. На рисунке 1. [8]

Ионный мост, образованный между Lys199 и карбоксильной концевой группой остатка Phe8 Ang II, скорее всего, стабилизирован остатком Trp253. Кроме того, Phe259 и Asp263 в трансмембранной спирали 6 и Lys102 и Ser105 во внешней области трансмембранной спирали 3 также были вовлечены в связывание Ang II. Эта область может, возможно, участвовать в стабилизации ратификации рецептора и в образовании внутримембранного связующего кармана.

Большинство АРБ имеют один и тот же фармакофор, поэтому разница в их биохимическом и физиологическом эффектах в основном обусловлена различными заместителями. Активность лекарственного средства зависит от его сродства к сайту субстрата и продолжительности его связывания с сайтом. Липофильные заместители, такие как линейная алкильная группа в 2-положении на имидазольном кольце вместе с бифенилметильной группой, связываются с гидрофобными карманами рецептора. Кислотная группа, такая как тетразол, CO2H или NHSO2CF3 в 1-положении бифенилметильной группы, будет связываться с основным положением в рецепторе и необходима для сильной антагонистической активности [18].
В валсартане имидазольное кольцо лозартана было заменено ацилированной аминокислотой [4].
Несколько заместителей были испытаны в 4- и 5- положениях на имидазольном кольце. Хлор и гидроксиметильные группы, связанные с этими положениями в лозартане, вероятно, не имеют большого значения при связывании рецепторов, поскольку другие АРБ не обладают этими функциональными группами и имеют сравнимые или лучшие связывающие аффинности, чем лозартан. Ирбезартан имеет карбонильную группу в 5-положении, функционирующую в качестве акцептора водородной связи вместо гидроксиметильной группы лозартана, что приводит к более длительному связыванию с рецептором [1] [4] [18] Структура eprosartan отличается тем, что отличается от других ARB, обычная бифенилметильная группа была заменена карбоксибензильной группой, которая более точно имитирует фенольную группу Tyr4 группы Ang II. Это изменение приводит к более сильному связыванию с рецептором, но биохимические и физиологические эффекты существенно не улучшаются [1].
Telmisartan имеет карбоновую кислоту в 2-положении бифенилметильной группы и является более сильным, чем аналог тетразола [1]. Сообщалось, что имидазолы, которые имеют гидроксиметил- и карбоксильные группы в положении 4 и 5, обладают сильной антагонистической активностью, вызванной водородной связью и гидрофильностью гидроксиметильной группы [18]. Сообщалось также, что гидроксильная группа в 4-положении на имидазольном кольце играет важную роль в аффинности связывания и компенсирует недостаток липофильности объемной алкильной группы. [18] Эти результаты показывают, что гидроксиалкильная группа среднего размера, такая как CHMeOH и CMe2OH, благоприятна для заместителя 4-позиции на имидазольном кольце. Кроме того, ионизируемая группа благоприятна для аффинности связывания [18].
Большинство АРБ имеют один и тот же фармакофор, поэтому разница в их биохимическом и физиологическом эффектах в основном обусловлена различными заместителями. Активность лекарственного средства зависит от его сродства к сайту субстрата и продолжительности его связывания с сайтом. Липофильные заместители, такие как линейная алкильная группа в 2-положении на имидазольном кольце вместе с бифенилметильной группой, связываются с гидрофобными карманами рецептора. Кислотная группа, такая как тетразол, CO2H или NHSO2CF3 в 1-положении бифенилметильной группы, будет связываться с основным положением в рецепторе и необходима для сильной антагонистической активности [18].
В валсартане имидазольное кольцо лозартана было заменено ацилированной аминокислотой [4].
Несколько заместителей были испытаны в 4- и 5- положениях на имидазольном кольце. Хлор и гидроксиметильные группы, связанные с этими положениями в лозартане, вероятно, не имеют большого значения при связывании рецепторов, поскольку другие АРБ не обладают этими функциональными группами и имеют сравнимые или лучшие связывающие аффинности, чем лозартан. Ирбезартан имеет карбонильную группу в 5-положении, функционирующую в качестве акцептора водородной связи вместо гидроксиметильной группы лозартана, что приводит к более длительному связыванию с рецептором [1] [4] [18] Структура eprosartan отличается тем, что отличается от других ARB, обычная бифенилметильная группа была заменена карбоксибензильной группой, которая более точно имитирует фенольную группу Tyr4 группы Ang II. Это изменение приводит к более сильному связыванию с рецептором, но биохимические и физиологические эффекты существенно не улучшаются [1].
Telmisartan имеет карбоновую кислоту в 2-положении бифенилметильной группы и является более сильным, чем аналог тетразола [1]. Сообщалось, что имидазолы, которые имеют гидроксиметил- и карбоксильные группы в положении 4 и 5, обладают сильной антагонистической активностью, вызванной водородной связью и гидрофильностью гидроксиметильной группы [18]. Сообщалось также, что гидроксильная группа в 4-положении на имидазольном кольце играет важную роль в аффинности связывания и компенсирует недостаток липофильности объемной алкильной группы. [18] Эти результаты показывают, что гидроксиалкильная группа среднего размера, такая как CHMeOH и CMe2OH, благоприятна для заместителя 4-позиции на имидазольном кольце. Кроме того, ионизируемая группа благоприятна для аффинности связывания [18].
Candesartan и olmesartan имеют самое высокое сродство к рецепторам AT1, за которыми следуют ирбесартан и эпросартан. Валсартан, телмисартан и EXP 3174 имеют сходные сродства, которые примерно в десять раз меньше, чем у кандесартана. Лозартан имеет наименьшее сходство. [6] Сродство ARB к рецептору AT2 обычно значительно ниже (или примерно в 10 000 раз меньше), чем для подтипа AT1. Поэтому они допускают беспрепятственную стимуляцию АТ2-рецептора [19].
Candesartan и olmesartan имеют самое высокое сродство к рецепторам AT1, за которыми следуют ирбесартан и эпросартан. Валсартан, телмисартан и EXP 3174 имеют сходные сродства, которые примерно в десять раз меньше, чем у кандесартана. Лозартан имеет наименьшее сходство. [6] Сродство ARB к рецептору AT2 обычно значительно ниже (или примерно в 10 000 раз меньше), чем для подтипа AT1. Поэтому они допускают беспрепятственную стимуляцию АТ2-рецептора [19].
