Дисциплина Медицинская биохимия. Принципы измерительных технологий в биохимии. Патохимия, диагностика. Биохимия злокачественного роста». Часть 3
Болезни печени
7. Печеночные ферменты в сыворотке
ФЕРМЕНТЫ СЫВОРОТКИ КРОВИ |
Среди функциональных проб печени все большее значение приобретает определение активности ферментов сыворотки крови. В отдельных клинических лабораториях крупных стационаров выполнение этих тестов составляет половину работы биохимического сектора. Нам представляется необходимым знакомство с некоторыми данными, касающимися этих веществ, включая систематизацию ферментов сыворотки крови.
Под изоферментами подразумевают ферменты, которые катализируют распад одинаковых субстратов, но существенно различаются по физико-химическим свойствам. Изоферменты могут вырабатываться разными органами, например изоферменты щелочной фосфатазы и до известной степени лактатдегидрогеназы. Часть изоферментов аспартатаминотрансферазы размещается в цитоплазме, а часть - в митохондриях клетки.
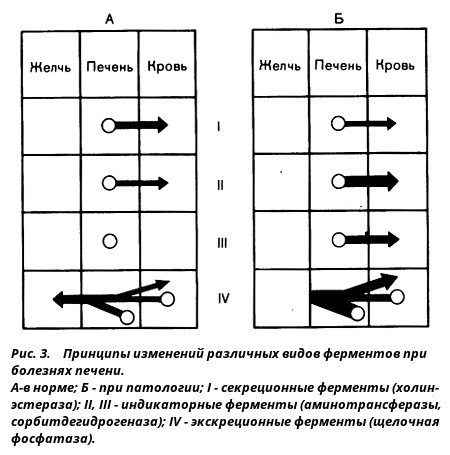
Наиболее распространено следующее деление [Richterich R., 1963] ферментов, используемых в диагностических целях (рис. 3).
- Секреционные, или плазмаспецифические, ферменты синтезируются органоидами гепатоцита (в основном рибосомами) и в нормальных условиях сецернируются в плазму крови, где они играют определенную физиологическую роль. К этим ферментам относятся холинэстераза (псевдохолинэстераза), большая часть прокоагулянтов и церулоплазмин. При повреждении печени и, в частности, ее рибосомального аппарата активность секреционных ферментов отчетливо снижается. Эта закономерность прослеживается при циррозах, "шоковой печени" и других заболеваниях.
- Индикаторные (так называемые клеточные) ферменты. К ферментам этой группы относят аминотрансферазы (трансаминазы), глутамат-, сорбит-, лактатдегидрогеназы, орнитин-карбамоилтрансферазы и ряд других ферментов. Большинство из них в нормальных условиях находится в плазме крови в относительно небольших количествах. При патологических процессах, сопровождающихся распадом клеток, активность этих ферментов возрастает во много раз. Индикаторные ферменты - главные и наиболее надежные показатели цитолитического синдрома в печени (см. ниже).
- Экскреционные ферменты производятся в печени (лейцинаминопептидаза) либо как в печени, так и в других органах (щелочная фосфатаза). В нормальных условиях эти ферменты выделяются в сыворотку крови и в желчь. Механизм выделения этих веществ изучен не полностью. При патологических условиях, особенно при затрудненном оттоке желчи, возрастает продукция этих ферментов и их активность в сыворотке крови увеличивается. Если прежде главная роль в повышении активности экскреционных ферментов отводилась затрудненной экскреции их в желчь (например, при механической желтухе), то в последние годы все большее значение отводится увеличению продукции этих ферментов гепатоцитами и эпителием мельчайших желчных протоков. При таком подходе суть самого термина "экскреционные ферменты" становится уязвимой.
Такие вещества, как билирубинглюкуронид, холестерин, желчные кислоты, β-липопротеиды, ведут себя в патологических условиях, в первую очередь при холестазе, подобно экскреционным ферментам.
В последние годы предпринимается попытка разделения ферментов по их преимущественной локализации в гепатоците. Выделяются: 1) цитоплазматические, 2) митохондриальные, 3) лизосомальные, 4) рибосомальные ферменты.
Это разделение ферментов представлено выше в разделе клинической морфологии печени. Большинство ферментов расположено не в одном, а в нескольких отделах гепатоцита, и обычно указывается лишь преимущественная локализация одного из изоферментов.
Деление ферментов на органоспецифические и органонеспецифические весьма условно. Из ферментов, широко применяемых в клинической практике, к органоспецифическим относят глутаматдегидрогеназу, сорбит(идитол) дегидрогеназу и др. Было бы ошибочным предполагать, что эти ферменты представлены только в клетках печени, в небольших количествах они встречаются и в других органах и тканях. Как уже указывалось, "органоспецифичность" фермента имеет относительное диагностическое значение. Главное диагностическое качество фермента - это его чувствительность как индикатора соответствующего синдрома.
В последние годы открыты [Nagamine М., Bieweng J., 1980, и др.] новые формы ферментов - макромолекулярные комплексы (макроферменты). Пока известны комплексы лишь отдельных ферментов - щелочной фосфатазы, лактатдегидрогеназы, креатининфосфокиназы и амилазы. Они представляют собой своеобразное соединение фермента с иммуноглобулином или липопротеином.
Макроферментам присущи две особенности:
- из-за более медленной деградации фермента его активность может оставаться повышенной существенно дольше обычного (иногда много месяцев);
- при электрофоретическом и хроматографическом определении изоферментов выявляется атипичная полоса активности.
Макроферменты выявляются редко. A. Wilhelm, U. Gerlach с сотр. (1982) на 4000 определений щелочной фосфатазы обнаружили макроферменты в 20 случаях.
Название фермента обычно складывается из названия субстрата (т. е. вещества или части молекулы, которые преобразует данный фермент) с прибавлением суффикса "аза". Так, фосфатаза гидролизирует фосфорные эфиры, аргиназа катализирует гидролиз аргинина и т. д.
В других случаях название фермента указывает на его функцию. Так, дегидрогеназы катализируют отрыв водорода, трансферазы способствуют переносу химических групп с одной молекулы на другую либо с одного отдела молекулы на другой. Часть ферментов сохранила свои традиционные названия: трипсин, катепсин и др.
В августе 1961 г. была принята классификация, согласно которой ферменты делятся на 6 основных классов. Однако в окончательном виде с принятой теперь нумерацией это деление получило права гражданства в 1972 г., когда Комиссия по номенклатуре биохимической и прикладной химии (УИРАС) предложила "Правила номенклатуры ферментов", выделив при этом:
| Таблица Период полураспада ферментов в плазме крови | ||
| Фермент | Фермент (полное название) | Период полураспада |
| - | Амилаза | 3-6 ч |
| АлАТ (ГПТ) | аланинаминотрансфераза | 47 ± 10 ч |
| АсАТ (ГОТ) | аспартатаминотрансфераза | 17 ± 5 ч |
| ГГТФ (ГГТП) | γ-Глутамилтрансфераза | 3-7 сут |
| ГЛДГ | глутаматдегидрогеназа | 18 ± 1 ч |
| ЛДГ1 (ГБДГ) | лактатдегидрогеназа (1) | 113 ± 60 ч |
| ЛДГ5 | лактатдегидрогеназа (5) | 10 ± 2 ч |
| ХЭ | холинэстераза | Около 10 сут |
| ЩФ | щелочная фосфатаза | 3-7 сут |
- Оксиредуктазы. Активируют или выполняют гидрогенизацию и дегидрогенизацию, т. е. переносят водород и электроны и катализируют биологическое окисление.
- Трансферазы. Осуществляют перенос функциональных групп (амино-, сульфа- и др.).
- Гидролазы. Осуществляют гидролитические реакции, катализируют гидролитическое расщепление. Ферменты этой группы называются в соответствии с типом разрываемой связи (например, эстеразы).
- Лиазы. Осуществляют присоединение по двойной связи (например, декарбоксилаза).
- Изомеразы. Выполняют изомеризацию.
- Лигазы (синтетазы, или синтазы). Синтезируют связи с помощью макроэргических фосфоангидридных соединений.
Согласно этой классификации, каждый фермент имеет свой шифр: первое число обозначает главный класс; второе число указывает на подкласс; третье число характеризует подподкласс; четвертое число - порядковый номер фермента.
Сравнительно мало распространенные ферменты обозначаются очень различно, и иногда трудно понять, идет речь об одном и том же ферменте или о разных. Приведенный порядковый номер устраняет подобные сомнения.
При оценке активности патологического процесса в печени, особенно при острых заболеваниях, необходимо учитывать скорость падения активности фермента в плазме крови (табл. 12).
Важно отметить, что при повреждении печени синтез одних ферментов нарушается значительно (АлАТ и др.), других (АсАТ, ЛДГ и др.) - существенно меньше.