Дисциплина Экспериментальная патобиохимия клетки
Медиаторы воспаления
3. Преформированные и вновь образующиеся медиаторы
3.9. NAMPT и NAPRT
Никотинамидфосфорибозилтрансфераза (NAMPT) и никотинатфосфорибозилтрансфераза (NAPRT) - это два внутриклеточных фермента, которые катализируют первую стадию биосинтеза НАД из никотинамида и никотиновой кислоты соответственно. Путем точной настройки внутриклеточных уровней НАД они участвуют в регуляции / перепрограммировании клеточного метаболизма и в контроле активности НАД-зависимых ферментов, включая сиртуины, PARP и НАДазы. Однако в ходе эволюции они оба приобрели новые функции в качестве внеклеточных эндогенных медиаторов воспаления. Хорошо известно, что клеточный стресс и / или повреждение вызывают высвобождение во внеклеточную среду эндогенных молекул, называемых аларминами или молекулярными паттернами, связанными с повреждениями (DAMP), которые модулируют иммунные функции посредством рецепторов распознавания паттернов связывания (PRR), таких как Toll -подобные рецепторы (TLR) и активируют воспалительные реакции. Все больше данных свидетельствует о том, что внеклеточные (е) NAMPT и eNAPRT являются новыми растворимыми факторами с цитокин / адипокином / DAMP-подобным действием. Повышенный eNAMPT был зарегистрирован при нескольких метаболических и воспалительных нарушениях, включая ожирение, диабет и рак, в то время как eNAPRT становится биомаркером сепсиса и септического шока.
Одна из ключевых ролей врожденной иммунной системы - инициировать иммунный ответ против инвазивных патогенов. Патоген-ассоциированные молекулярные структуры (PAMP) включают сахара / липопротеины или нуклеиновые кислоты [то есть бактериальную ДНК в виде неметилированных повторов динуклеотидного CpG, двухцепочечной (ds) или одноцепочечной (ss) РНК] (1, 2). PAMP могут инициировать иммунные ответы через активацию классических рецепторов распознавания образов (PRR), среди которых есть toll-подобные рецепторы (TLR), NOD-подобные рецепторы (NLR), рецепторы, подобные индуцибельному гену I ретиноевой кислоты (RIG-I). (RLR), рецепторы лектина C-типа (CLR), множественные внутриклеточные ДНК-сенсоры и другие рецепторы DAMP, не относящиеся к PRR (2–4). Однако эти рецепторы могут быть задействованы также эндогенными лигандами. В настоящее время широко признано, что клетки в условиях гипоксии, ацидоза, окислительно-восстановительного дисбаланса, гипертонического / гипотонического стресса и нарушений внутриклеточных ионов или цитоскелета могут выделять небольшие эндогенные молекулы, называемые молекулярными паттернами, связанными с повреждениями (DAMP), или иногда «сигналами опасности» или «Alarmins», запускающие иммунные ответы через активацию PRR (4–6). Интересно, что многие из этих DAMPs обладают хорошо охарактеризованной внутриклеточной функцией и были случайно идентифицированы во внеклеточном пространстве, где они инициируют воспалительные реакции, независимо от патогенной инфекции, явление, называемое стерильным воспалением (4, 7, 8). Подобно воспалению, вызванному патогенами, DAMP могут праймировать нейтрофилы, макрофаги и дендритные клетки (DC), а также неиммунные клетки, включая эндотелиальные и эпителиальные клетки и фибробласты (7). Активация этих клеток приводит к выработке нескольких цитокинов и хемокинов, которые, в свою очередь, привлекают воспалительные элементы и запускают адаптивные иммунные ответы. Хотя стерильное воспаление играет важную роль в восстановлении и регенерации тканей, неразрешенное хроническое воспаление вредно для хозяина, приводя к развитию метаболических, нейродегенеративных, аутоиммунных нарушений и рака.
С момента их первоначального определения как DAMPs в 2003 году список эндогенных молекул значительно увеличился (4) и теперь включает высокоподвижный белок группы 1 (HMGB-1), белки теплового шока (HSP), гистоны и компоненты внеклеточного матрикса (для например, гиалуроновая кислота и бигликан). Все эти молекулы обладают провоспалительными функциями, связываясь с TLR. HMGB-1 - один из наиболее изученных DAMP. Это белок, связывающий ядерную ДНК, который можно найти во внеклеточном пространстве не только в результате некроза, но и с помощью специальных механизмов секреции (9, 10). Внеклеточно HMGB-1 вызывает провоспалительные эффекты, связанные с последующим связыванием TLR4 и активацией сигнального пути ядерного фактора каппа B (NF-kB) (11, 12). В моделях на животных HMGB-1 является поздним медиатором летального системного воспаления, участвующим в отсроченной летальности эндотоксина (13). Другие DAMP включают F-актин, белок 130, связанный с Sin3A (SAP130), β-глюкозилцерамид и N-гликаны, связывающиеся с CLR; кристаллы мононатрия урата (MSU), кристаллы холестерина, β-амилоид (Aβ) и аденозин-5'-трифосфат (АТФ), которые активируют инфламмасому NLRP3 (4). Кроме того, многочисленные цитокины [например, интерлейкин (IL) -1β, фактор некроза опухоли (TNF) и интерферон I типа (IFN-I)], провоспалительные белки, такие как индуцированный интерфероном белок 35, и биоактивные липиды, такие как лизофосфолипиды называются «индуцибельными DAMP» или «условными DAMP» (14).
Нуклеотиды и нуклеозиды, долгое время считавшиеся просто переносчиками электронов, участвующими в поддержании энергетического метаболизма, вызывают интерес вместе с сетью ферментов, контролирующих их синтез и разложение. Интересно, что хотя все эти факторы обладают хорошо охарактеризованной внутриклеточной функцией, они могут высвобождаться во внеклеточное пространство, где они связываются и активируют различные наборы клеточных рецепторов, включая пуринергические и PRR. Например, АТФ, ключевая молекула внутриклеточной энергии, может массово высвобождаться за счет пассивной утечки, когда клетки травмируются, подвергаются стрессу или даже некротизируются, действуя как DAMP (15). Внеклеточный АТФ и его производные нуклеотиды (аденозин, АМФ, АДФ), синтезируемые эндонуклеотидазами, достигают многих из своих эффектов через пуринергические рецепторы, через воспалительные каскады и продукцию провоспалительных цитокинов (16, 17). Среди ферментов, участвующих в синтезе никотинамидадениндинуклеотида (НАД), никотинамидфосфорибозилтрансфераза (NAMPT) - предмет этого обзора - выступает в качестве нового медиатора воспаления. Внутриклеточно он катализирует первую и лимитирующую стадию биосинтеза НАД из никотинамида (Nam) (18, 19). Сообщается о повышении уровня eNAMPT в условиях острого или хронического воспаления (18, 20-25). Эффекты eNAMPT в основном связаны с активацией воспалительной сигнатуры, в основном в макрофагах, с недавними данными, предполагающими, что он связывает TLR4, таким образом добавляя фермент к ряду «опасных» сигналов, активирующих этот рецептор (26). NAMPT структурно и функционально связан со вторым ферментом биосинтеза NAD (NBE), то есть никотинатфосфорибозилтрансферазой (NAPRT), который ограничивает скорость в пути восстановления NAD, который начинается с образования никотиновой кислоты (Na) (27–29). Наша группа недавно обнаружила присутствие NAPRT во внеклеточных жидкостях (eNAPRT), подчеркнув роль этого фермента в качестве лиганда для TLR4.
В этом обзоре суммируются текущие знания о NAMPT и NAPRT, как о внутриклеточных NBE, участвующих в регуляции / перепрограммировании клеточного метаболизма, и о цитокинах / DAMP во внеклеточной среде. Наконец, мы обсудим роль этих ферментов, особенно в отношении развития воспалительных состояний, включая рак, и их потенциальную терапевтическую ценность.
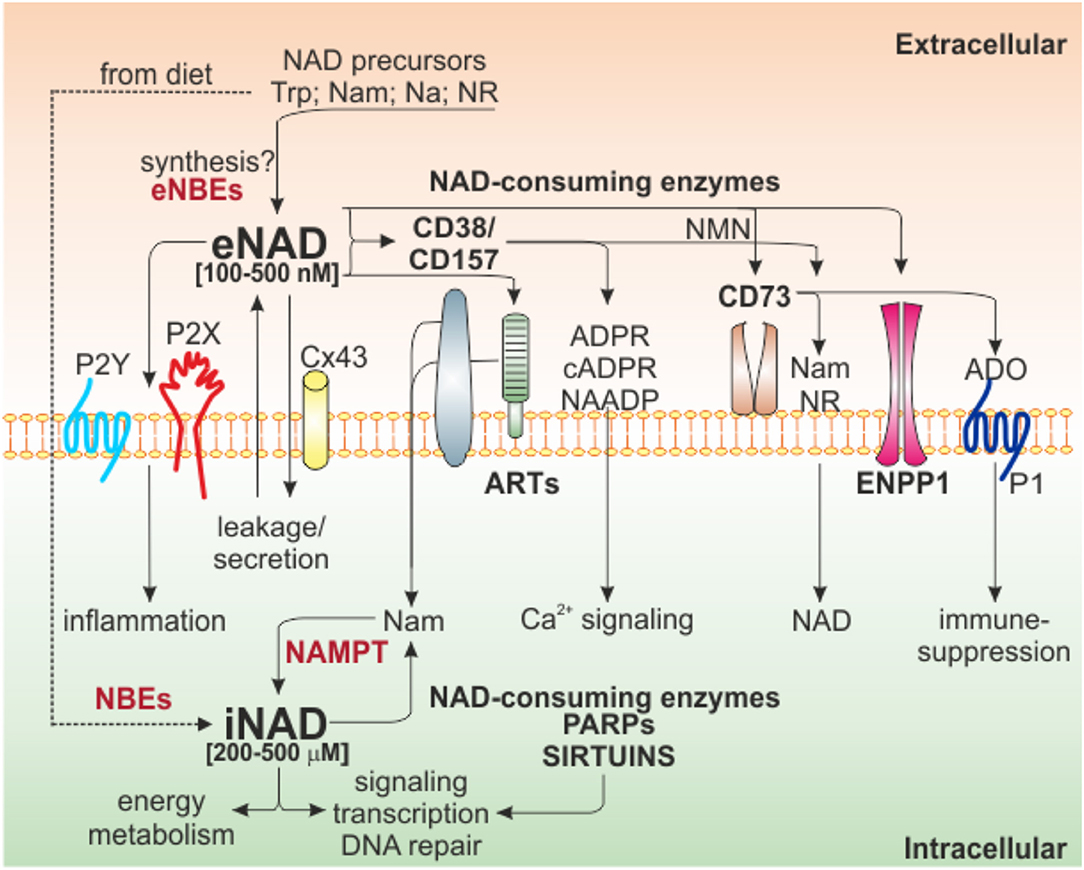
Рисунок 1. Интра/экстра клеточные взаимодействия НАД и ферменты, метаболизирующие НАД. Схематическое изображение сети NAD-метаболизирующих клеточных поверхностных и внутриклеточных ферментов и их продуктов. Некоторые предшественники НАД, полученные с пищей, могут быть интернализованы для генерации iNAD за счет активности NBE для поддержки энергетического метаболизма, передачи сигналов и других биологических процессов за счет активности внутриклеточных ферментов, потребляющих НАД (PARP и сиртуинов). Эти ферменты высвобождают Nam, который, в свою очередь, посредством NAMPT-зависимого пути восстановления поддерживает производство NAD. Попав во внеклеточное пространство из-за секреции / утечки через Cx43 или из-за прямого внеклеточного синтеза из предшественников (не подтверждено), eNAD может функционировать путем связывания пуринергических рецепторов (P2Y, P2X), что приводит к внутриклеточной передаче сигналов и воспалительным состояниям. . В качестве альтернативы, eNAD также может метаболизироваться серией эктоферментов на поверхности клетки (CD38 / CD157, ART, CD73, ENPP1), генерируя различные метаболиты (cADPR, ADPR и NAADP), участвующие в основном в передаче сигналов Ca2 +. Конечный продукт реакции, аденозин, может изменять передачу сигнала, воздействуя на пуринергические рецепторы P1, что обычно приводит к иммуносупрессии. В квадратных скобках указан диапазон iNAD [200–500 мкМ] или eNAD [100–500 нМ]. Trp, триптофан; Нам, никотинамид; NR, никотинамид рибозид; Na, никотиновая кислота; NBE, ферменты биосинтеза НАД; NAMPT, никотинамидфосфорибозилтрансфераза; АРТ, моноаденозиндифосфат (АДФ) -рибоза трансферазы; PARP, полимеразы поли-АДФ-рибозы; Сх43, коннексин 43; ADPR, ADP рибоза; cADPR, циклическая ADP рибоза; NAADP, адениндинуклеотидфосфат никотиновой кислоты; NMN, никотинамидмононуклеотид; АДО, аденозин; ENPP1, эктонуклеотидпирофосфатаза/фосфодиэстеразы.
Соотношение между НАД / НАДН и их относительной фосфорилированной формой (НАДФ / НАДФН) также имеет решающее значение для систем ферментативной защиты от окислительного стресса, регулируя окислительно-восстановительный гомеостаз через основные клеточные системы очистки, которыми являются глутатион (GSH / GSSG) и тиоредоксин. опосредованные (Trx-SH / Trx-SS) механизмы (34–37). В этом контексте НАДФН является незаменимым восстанавливающим агентом для элиминации АФК и окислительно-восстановительного гомеостаза, в первую очередь продуцируемого глюкозо-6-фосфатдегидрогеназой (G6PD) и -фосфоглюконатдегидрогеназой (6PGD) в пентозофосфатном пути (36).
НАД: Плейотропная сигнальная молекула
Независимо от его окислительно-восстановительных свойств, НАД также является субстратом ферментов, играющих фундаментальную роль в экспрессии генов и передаче сигналов в клетке (38). В этих реакциях NAD расщепляется по гликозидной связи между Nam и ADP-рибозой, приобретая характеристики сигнальной молекулы (27).nnБольшое семейство энзимов, потребляющих НАД, включает моноаденозиндифосфат (АДФ) -рибозо-трансферазы (АРТ) и поли-АДФ-рибозные полимеразы (ПАРП), НАД-зависимые деацетилазы, сиртуины (SIRT1-7) и циклические АДФ-рибозогидролазы. , NAD-гликогидролазы, эктонуклеотидпирофосфатаза / фосфодиэстеразы и экто-5'-нуклеотидаза (CD38 / CD157 и ENPP1 / CD73) (19, 39, 40) (Рисунок 1).nnБлагодаря своей функциональной активности посттрансляционных модификаций (АДФ-рибозилирование и деацетилирование) или посредством модуляции передачи сигналов Ca2 +, эти ферменты регулируют транскрипцию генов, дифференциацию клеток, развитие клеточного цикла, циркадный ритм, восстановление ДНК, стабильность хроматина, адаптацию клеток к сигналы стресса и иммунные ответы (41, 42). Следовательно, PARP и сиртуины представляют собой связующие элементы между метаболическим состоянием клетки и ее сигнальной и транскрипционной активностью (43).nnВнеклеточный НАД и его биологическая рольnКонцентрация eNAD находится в диапазоне 100–500 нМ, что значительно ниже, чем его внутриклеточные уровни (200–500 мкМ) (39, 44–46). Уровни eNAD и iNAD тесно связаны из-за внутримембранного транспорта предшественников NAD, промежуточных продуктов реакции и самого NAD (47). Каноническая точка зрения состоит в том, что NAD неспособен пересекать липидные бислои, но он входит в клетку с помощью специализированных транспортеров NAD, таких как каналы коннексина 43 (Cx43), или выходит через экзоцитоз (45, 48-50). Кроме того, стрессовые условия окружающей среды могут вызывать высвобождение НАД (51–53). С другой стороны, существует ли прямой синтез eNAD, остается спорным (39) (Рисунок 1), несмотря на присутствие внеклеточных предшественников и биосинтетических ферментов. В частности, известно, что среди различных форм витамина B3 (предшественник NAD) транспорт Na опосредуется системами мембранных носителей, потенциально включая pH-зависимый анионный антипортер или котранспортер протонов (54, 55). Nam присутствует внеклеточно, и его поглощение возможно либо в виде прямого транспорта в интактной форме, либо в виде метаболитов спасательного пути. Однако было показано, что субстраты NAMPT АТФ и 5-фосфорибозил-1-пирофосфат (PRPP) недоступны в достаточных количествах во внеклеточном пространстве (56), чтобы поддерживать прямую генерацию eNAD.nneNAD может связывать различные подтипы пуринергических рецепторов P2, включая P2Y11, что приводит к открытию каналов Ca2 + L-типа и активации сигнального каскада cAMP / cADPR / [Ca2 +] i, что в конечном итоге вызывает усиление пролиферации и миграции (57). В Т-клетках и моноцитах активация рецептора P2X7 обычно приводит к интернализации Ca2 +, открывая неселективные большие мембранные поры, вызывая гибель клеток (58, 59). eNAD также действует как нейротрансмиттер, высвобождаемый стимулированными окончаниями нейронов центральной нервной системы и периферической нервной системы млекопитающих, связываясь с постсинаптическими рецепторами P2Y1, подобно АТФ (60).nnОчень низкие уровни eNAD обусловлены его быстрым метаболизмом / деградацией NAD-катаболическими ферментами, присутствующими на поверхности клетки (61), что позволяет предположить, что метаболиты NAD также могут опосредовать клеточные ответы во внеклеточной среде.nneNAD расщепляется тремя основными классами специфических эктоферментов: CD38 и CD157 (62, 63), ART (64), ENPP1 и CD73 (61, 65, 66). NADase, ENPP1 и CD73 могут приводить к образованию аденозина (ADO), мощного иммунодепрессанта, независимо от активности CD39 (61, 67, 68). Помимо образования ADO, eNAD может расщепляться до никотинамидмононуклеотида (NMN) с помощью CD38, генерируя Nam, который может проникать через плазматические мембраны и повторно превращаться в NAD через NAMPT и NMN-аденилилтрансферазу (NMNAT) (69). С другой стороны, NMN также может использоваться CD73, который генерирует никотинамид рибозид (NR) (66, 70), который, вероятно, через уравновешивающие переносчики нуклеозидов (ENT), может быть импортирован как предшественник NAD (71, 72) (рис. 1). Недавно Slc12a8 был идентифицирован как специфический переносчик NMN (73), предполагая, что NMN может быть интернализован без преобразования в NR. Исследования паттерна экспрессии клеточного типа этого переносчика прояснят эту возможность.
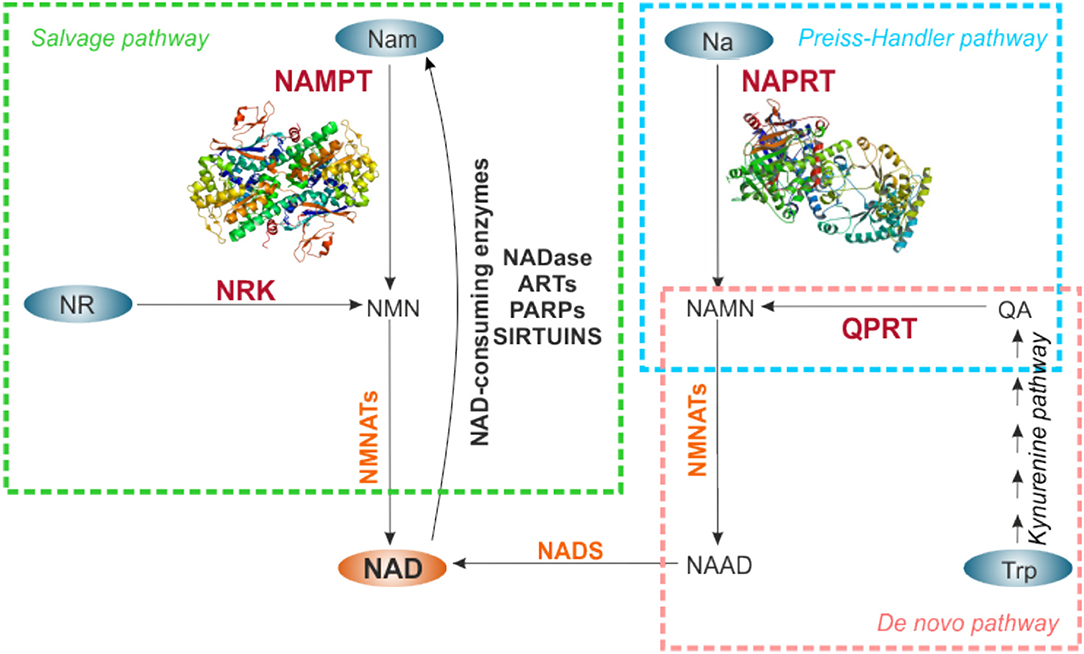
Рисунок 2. Пути биосинтеза НАД. НАД можно синтезировать de novo, начиная с Trp (розовый прямоугольник), или через пути спасения от Nam и NR (зеленый прямоугольник), или метаболизируя Na по пути Прейсс-Хэндлера (голубой прямоугольник). Предшественники НАД обозначены синими овалами. Ферменты, ограничивающие скорость каждого пути биосинтеза, обозначены красным цветом, другие ферменты, участвующие в реакциях, - оранжевым. Для NAMPT и NAPRT показаны кристаллические структуры. НАД, синтезируемый из Nam с помощью NAMPT, в свою очередь, используется потребляющими NAD активностями ферментов, которые высвобождают Nam, делая его доступным для непрерывной регенерации NAD. NAMPT, никотинамидфосфорибозилтрансфераза; НАПРТ, никотинатфосфорибозилтрансфераза; NRK, никотинамид-рибозидкиназа; QPRT, хинолинатфосфорибозилтрансфераза; NMNAT, никотинамидмононуклеотид аденилтрансферазы; НАДС, НАД-синтаза; Нам, никотинамид; NR, никотинамид рибозид; Na, никотиновая кислота; Trp, триптофан; QA, хинолиновая кислота; NMN, никотинамидмононуклеотид; НАМН, никотинатмононуклеотид; НААД, никотинатадениндинуклеотид; НАДаза, НАД-гликогидролаза; АРТ, моноаденозиндифосфат (АДФ) -рибоза трансферазы; PARP, полимеразы поли-АДФ-рибозы.
В частности, de novo биосинтез НАД начинается с катаболизма аминокислоты триптофана до кинуренина индоламин-2,3-диоксигеназой. Затем кинуренин метаболизируется посредством кинуренинового пути до хинолиновой кислоты (QA), которая превращается хинолатфосфорибозилтрансферазой (QPRT), ограничивающим скорость ферментом, в мононуклеотид натрия (NaMN). Путь Прейсса-Хэндлера метаболизирует NaMN, полученный из кинуренинового пути, или NaMN, полученный из пищи, или Na, как продукт дезамидирования Nam кишечной флорой (76) до NAD, посредством NAPRT-ограничивающей активности. В пути спасения NAMPT метаболизирует Nam и PRPP до NMN на этапе ограничения скорости, который затем превращается в NAD. В другом способе спасения NR, полученный из диеты, может использоваться никотинамид-рибозидкиназой (NRK) для генерации NAD (рис. 2).
Количественно путь спасения Nam является наиболее значимым в клетках млекопитающих. Это наблюдение подтверждается несколькими доказательствами. Во-первых, Nam является наиболее распространенным предшественником НАД в кровотоке (39), и его можно легко ввести с пищей (витамин B3). Во-вторых, Nam является побочным продуктом активности всех ферментов, метаболизирующих НАД, что увеличивает его доступность (77). В-третьих, ограничивающий скорость фермент NAMPT (EC 2.4.2.12) экспрессируется во всех тканях млекопитающих (78), как подробно описано ниже. Связанная с этим делеция гена NAMPT у мышей является эмбрионально летальной (79), что свидетельствует о важности этого пути для регенерации NAD. На этом пути Nam N-methyltransefase (NNMT) недавно стала эволюционно консервативным регулятором доступности Nam. Фактически, NNMT N-метилирует Nam, предотвращая его накопление и ингибирование ферментов, потребляющих NAD, а с другой стороны, ограничивая его доступность для NAMPT (80, 81).
Функциональный NAMPT образует гомодимер, катализирующий превращение Nam и PRPP в NMN. Исследования структурного и сайт-направленного мутагенеза Khan et al. продемонстрировали, что Asp219 играет фундаментальную роль в определении субстратной специфичности NAMPT (82). Wang et al. показали, что NAMPT обладает аутофосфорилирующей активностью и гидролизует АТФ. Аутофосфорилирование может повысить его ферментативную активность (83). Недавно было обнаружено, что NAMPT является прямым субстратом деацетилирования SIRT6, посттрансляционного механизма, который регулирует его ферментативную активность (84). Напротив, мутации His247, центрального консервативного остатка в активном центре фермента, значительно снижают или отменяют ферментативную активность NAMPT (83).
NAPRT (EC 2.4.2.11) катализирует превращение Na и PRPP в NaMN и пирофосфат (PPi). Фермент, первоначально названный пирофосфорилаза NaMN, был впервые описан Хэндлером в человеческих эритроцитах, где он увеличивает уровни НАД (85).
Активность NAPRT более тканеспецифична. Хотя активность фермента может быть обнаружена в большинстве тканей мыши (86), Na действует как более эффективный предшественник, чем Nam, в печени, кишечнике, сердце и почках мышей (87). Кроме того, Na более эффективен, чем Nam, в повышении уровня НАД в клетках, подверженных окислительному стрессу (56, 85, 88).
В отличие от NAMPT, NAPRT не ингибируется NAD, что объясняет его значительно более высокую эффективность в повышении уровня NAD in vivo (56, 89). Более того, NAPRT сильно активируется фосфатом (85), в то время как АТФ ведет себя как аллостерический модулятор фермента (29, 85, 90).
В 2015 году Марлетта и др. разрешили структуру человеческого (h) NAPRT, подчеркнув высокую степень структурной гомологии между человеческими и бактериальными NaPRTases из-за эволюционной адаптации (91). Как и в случае с NAMPT, функциональный фермент NAPRT работает как димеры, и, несмотря на очень ограниченное сходство последовательностей, hNAPRT демонстрирует молекулярную складку, которая очень похожа на ту, что впервые была описана для hNAMPT (83). Это открыло новые гипотезы об общих мотивах в NAMPT и NAPRT, участвующих в связывании внеклеточных белков с рецептором, как описано в разделе Функции eNAMPT.
Наличие этих множественных путей биосинтеза NAD, скорее всего, отражает различия в тканевом распределении и / или внутриклеточной компартментализации NBE (39, 46, 76, 92, 93). Наша группа недавно показала, что NAMPT и NAPRT в основном расположены в цитоплазме и ядре, тогда как NRK больше экспрессируется в митохондриях, влияя на уровни iNAD и ответ на ингибиторы NAMPT (39, 46, 76, 92, 93).
https://www.frontiersin.org/articles/10.3389/fonc.2020.00358/full
Front. Oncol., 19 March 2020 | https://doi.org/10.3389/fonc.2020.00358
Одна из ключевых ролей врожденной иммунной системы - инициировать иммунный ответ против инвазивных патогенов. Патоген-ассоциированные молекулярные структуры (PAMP) включают сахара / липопротеины или нуклеиновые кислоты [то есть бактериальную ДНК в виде неметилированных повторов динуклеотидного CpG, двухцепочечной (ds) или одноцепочечной (ss) РНК] (1, 2). PAMP могут инициировать иммунные ответы через активацию классических рецепторов распознавания образов (PRR), среди которых есть toll-подобные рецепторы (TLR), NOD-подобные рецепторы (NLR), рецепторы, подобные индуцибельному гену I ретиноевой кислоты (RIG-I). (RLR), рецепторы лектина C-типа (CLR), множественные внутриклеточные ДНК-сенсоры и другие рецепторы DAMP, не относящиеся к PRR (2–4). Однако эти рецепторы могут быть задействованы также эндогенными лигандами. В настоящее время широко признано, что клетки в условиях гипоксии, ацидоза, окислительно-восстановительного дисбаланса, гипертонического / гипотонического стресса и нарушений внутриклеточных ионов или цитоскелета могут выделять небольшие эндогенные молекулы, называемые молекулярными паттернами, связанными с повреждениями (DAMP), или иногда «сигналами опасности» или «Alarmins», запускающие иммунные ответы через активацию PRR (4–6). Интересно, что многие из этих DAMPs обладают хорошо охарактеризованной внутриклеточной функцией и были случайно идентифицированы во внеклеточном пространстве, где они инициируют воспалительные реакции, независимо от патогенной инфекции, явление, называемое стерильным воспалением (4, 7, 8). Подобно воспалению, вызванному патогенами, DAMP могут праймировать нейтрофилы, макрофаги и дендритные клетки (DC), а также неиммунные клетки, включая эндотелиальные и эпителиальные клетки и фибробласты (7). Активация этих клеток приводит к выработке нескольких цитокинов и хемокинов, которые, в свою очередь, привлекают воспалительные элементы и запускают адаптивные иммунные ответы. Хотя стерильное воспаление играет важную роль в восстановлении и регенерации тканей, неразрешенное хроническое воспаление вредно для хозяина, приводя к развитию метаболических, нейродегенеративных, аутоиммунных нарушений и рака.
С момента их первоначального определения как DAMPs в 2003 году список эндогенных молекул значительно увеличился (4) и теперь включает высокоподвижный белок группы 1 (HMGB-1), белки теплового шока (HSP), гистоны и компоненты внеклеточного матрикса (для например, гиалуроновая кислота и бигликан). Все эти молекулы обладают провоспалительными функциями, связываясь с TLR. HMGB-1 - один из наиболее изученных DAMP. Это белок, связывающий ядерную ДНК, который можно найти во внеклеточном пространстве не только в результате некроза, но и с помощью специальных механизмов секреции (9, 10). Внеклеточно HMGB-1 вызывает провоспалительные эффекты, связанные с последующим связыванием TLR4 и активацией сигнального пути ядерного фактора каппа B (NF-kB) (11, 12). В моделях на животных HMGB-1 является поздним медиатором летального системного воспаления, участвующим в отсроченной летальности эндотоксина (13). Другие DAMP включают F-актин, белок 130, связанный с Sin3A (SAP130), β-глюкозилцерамид и N-гликаны, связывающиеся с CLR; кристаллы мононатрия урата (MSU), кристаллы холестерина, β-амилоид (Aβ) и аденозин-5'-трифосфат (АТФ), которые активируют инфламмасому NLRP3 (4). Кроме того, многочисленные цитокины [например, интерлейкин (IL) -1β, фактор некроза опухоли (TNF) и интерферон I типа (IFN-I)], провоспалительные белки, такие как индуцированный интерфероном белок 35, и биоактивные липиды, такие как лизофосфолипиды называются «индуцибельными DAMP» или «условными DAMP» (14).
Нуклеотиды и нуклеозиды, долгое время считавшиеся просто переносчиками электронов, участвующими в поддержании энергетического метаболизма, вызывают интерес вместе с сетью ферментов, контролирующих их синтез и разложение. Интересно, что хотя все эти факторы обладают хорошо охарактеризованной внутриклеточной функцией, они могут высвобождаться во внеклеточное пространство, где они связываются и активируют различные наборы клеточных рецепторов, включая пуринергические и PRR. Например, АТФ, ключевая молекула внутриклеточной энергии, может массово высвобождаться за счет пассивной утечки, когда клетки травмируются, подвергаются стрессу или даже некротизируются, действуя как DAMP (15). Внеклеточный АТФ и его производные нуклеотиды (аденозин, АМФ, АДФ), синтезируемые эндонуклеотидазами, достигают многих из своих эффектов через пуринергические рецепторы, через воспалительные каскады и продукцию провоспалительных цитокинов (16, 17). Среди ферментов, участвующих в синтезе никотинамидадениндинуклеотида (НАД), никотинамидфосфорибозилтрансфераза (NAMPT) - предмет этого обзора - выступает в качестве нового медиатора воспаления. Внутриклеточно он катализирует первую и лимитирующую стадию биосинтеза НАД из никотинамида (Nam) (18, 19). Сообщается о повышении уровня eNAMPT в условиях острого или хронического воспаления (18, 20-25). Эффекты eNAMPT в основном связаны с активацией воспалительной сигнатуры, в основном в макрофагах, с недавними данными, предполагающими, что он связывает TLR4, таким образом добавляя фермент к ряду «опасных» сигналов, активирующих этот рецептор (26). NAMPT структурно и функционально связан со вторым ферментом биосинтеза NAD (NBE), то есть никотинатфосфорибозилтрансферазой (NAPRT), который ограничивает скорость в пути восстановления NAD, который начинается с образования никотиновой кислоты (Na) (27–29). Наша группа недавно обнаружила присутствие NAPRT во внеклеточных жидкостях (eNAPRT), подчеркнув роль этого фермента в качестве лиганда для TLR4.
В этом обзоре суммируются текущие знания о NAMPT и NAPRT, как о внутриклеточных NBE, участвующих в регуляции / перепрограммировании клеточного метаболизма, и о цитокинах / DAMP во внеклеточной среде. Наконец, мы обсудим роль этих ферментов, особенно в отношении развития воспалительных состояний, включая рак, и их потенциальную терапевтическую ценность.
Уровни NAD модулируют клеточные транскрипционные ответы и метаболическую адаптацию
Наши знания о биологии НАД значительно выросли за последние несколько лет, в том числе о биосинтетических и деградирующих путях. Общее снижение клеточного НАД описано при многих возрастных заболеваниях, тогда как повышение уровня НАД связано с воспалительными состояниями, включая рак. На рисунке 1 показаны основные пути биосинтеза и потребления НАД, а также перекрестные помехи между внутриклеточным (i) НАД и eNAD.
Рисунок 1. Интра/экстра клеточные взаимодействия НАД и ферменты, метаболизирующие НАД. Схематическое изображение сети NAD-метаболизирующих клеточных поверхностных и внутриклеточных ферментов и их продуктов. Некоторые предшественники НАД, полученные с пищей, могут быть интернализованы для генерации iNAD за счет активности NBE для поддержки энергетического метаболизма, передачи сигналов и других биологических процессов за счет активности внутриклеточных ферментов, потребляющих НАД (PARP и сиртуинов). Эти ферменты высвобождают Nam, который, в свою очередь, посредством NAMPT-зависимого пути восстановления поддерживает производство NAD. Попав во внеклеточное пространство из-за секреции / утечки через Cx43 или из-за прямого внеклеточного синтеза из предшественников (не подтверждено), eNAD может функционировать путем связывания пуринергических рецепторов (P2Y, P2X), что приводит к внутриклеточной передаче сигналов и воспалительным состояниям. . В качестве альтернативы, eNAD также может метаболизироваться серией эктоферментов на поверхности клетки (CD38 / CD157, ART, CD73, ENPP1), генерируя различные метаболиты (cADPR, ADPR и NAADP), участвующие в основном в передаче сигналов Ca2 +. Конечный продукт реакции, аденозин, может изменять передачу сигнала, воздействуя на пуринергические рецепторы P1, что обычно приводит к иммуносупрессии. В квадратных скобках указан диапазон iNAD [200–500 мкМ] или eNAD [100–500 нМ]. Trp, триптофан; Нам, никотинамид; NR, никотинамид рибозид; Na, никотиновая кислота; NBE, ферменты биосинтеза НАД; NAMPT, никотинамидфосфорибозилтрансфераза; АРТ, моноаденозиндифосфат (АДФ) -рибоза трансферазы; PARP, полимеразы поли-АДФ-рибозы; Сх43, коннексин 43; ADPR, ADP рибоза; cADPR, циклическая ADP рибоза; NAADP, адениндинуклеотидфосфат никотиновой кислоты; NMN, никотинамидмононуклеотид; АДО, аденозин; ENPP1, эктонуклеотидпирофосфатаза/фосфодиэстеразы.
NAD: энергетический кофактор
Как энергетический кофермент, НАД играет важную роль в качестве донора акцептора электронов в различных метаболических путях, включая цитозольный гликолиз, биосинтез серина, цикл трикарбоновых кислот (TCA), окислительное фосфорилирование, а также окислительно-восстановительные реакции гомеостаза окислительно-восстановительного состояния клетки (30, 31). Кофактор почти 300 дегидрогеназ, НАД в основном используется во время гликолиза на шестой стадии ферментативной цепи глицеральдегидфосфатдегидрогеназой (ГАФД) и в конце процесса лактатдегидрогеназой (ЛДГ), катализируя взаимное превращение пирувата и лактата и одновременно НАДН и НАД. Конечный гликолитический продукт пируват может метаболизироваться с образованием ацетилСоА комплексом пируватдегидрогеназы (PDC), реакция, сопровождающаяся восстановлением НАД до НАДН (32). Во время цикла TCA NAD восстанавливается до фрагментов NADH в несколько ключевых этапов под действием изоцитратдегидрогеназы (IDH), оксоглутаратдегидрогеназы (OGD) и малатдегидрогеназы (MDH). НАДН, образующийся во всех этих реакциях, работая как перераспределитель электронных эквивалентов, используется цепью переноса электронов (ETC) для генерации АТФ (33).Соотношение между НАД / НАДН и их относительной фосфорилированной формой (НАДФ / НАДФН) также имеет решающее значение для систем ферментативной защиты от окислительного стресса, регулируя окислительно-восстановительный гомеостаз через основные клеточные системы очистки, которыми являются глутатион (GSH / GSSG) и тиоредоксин. опосредованные (Trx-SH / Trx-SS) механизмы (34–37). В этом контексте НАДФН является незаменимым восстанавливающим агентом для элиминации АФК и окислительно-восстановительного гомеостаза, в первую очередь продуцируемого глюкозо-6-фосфатдегидрогеназой (G6PD) и -фосфоглюконатдегидрогеназой (6PGD) в пентозофосфатном пути (36).
НАД: Плейотропная сигнальная молекула
Независимо от его окислительно-восстановительных свойств, НАД также является субстратом ферментов, играющих фундаментальную роль в экспрессии генов и передаче сигналов в клетке (38). В этих реакциях NAD расщепляется по гликозидной связи между Nam и ADP-рибозой, приобретая характеристики сигнальной молекулы (27).nnБольшое семейство энзимов, потребляющих НАД, включает моноаденозиндифосфат (АДФ) -рибозо-трансферазы (АРТ) и поли-АДФ-рибозные полимеразы (ПАРП), НАД-зависимые деацетилазы, сиртуины (SIRT1-7) и циклические АДФ-рибозогидролазы. , NAD-гликогидролазы, эктонуклеотидпирофосфатаза / фосфодиэстеразы и экто-5'-нуклеотидаза (CD38 / CD157 и ENPP1 / CD73) (19, 39, 40) (Рисунок 1).nnБлагодаря своей функциональной активности посттрансляционных модификаций (АДФ-рибозилирование и деацетилирование) или посредством модуляции передачи сигналов Ca2 +, эти ферменты регулируют транскрипцию генов, дифференциацию клеток, развитие клеточного цикла, циркадный ритм, восстановление ДНК, стабильность хроматина, адаптацию клеток к сигналы стресса и иммунные ответы (41, 42). Следовательно, PARP и сиртуины представляют собой связующие элементы между метаболическим состоянием клетки и ее сигнальной и транскрипционной активностью (43).nnВнеклеточный НАД и его биологическая рольnКонцентрация eNAD находится в диапазоне 100–500 нМ, что значительно ниже, чем его внутриклеточные уровни (200–500 мкМ) (39, 44–46). Уровни eNAD и iNAD тесно связаны из-за внутримембранного транспорта предшественников NAD, промежуточных продуктов реакции и самого NAD (47). Каноническая точка зрения состоит в том, что NAD неспособен пересекать липидные бислои, но он входит в клетку с помощью специализированных транспортеров NAD, таких как каналы коннексина 43 (Cx43), или выходит через экзоцитоз (45, 48-50). Кроме того, стрессовые условия окружающей среды могут вызывать высвобождение НАД (51–53). С другой стороны, существует ли прямой синтез eNAD, остается спорным (39) (Рисунок 1), несмотря на присутствие внеклеточных предшественников и биосинтетических ферментов. В частности, известно, что среди различных форм витамина B3 (предшественник NAD) транспорт Na опосредуется системами мембранных носителей, потенциально включая pH-зависимый анионный антипортер или котранспортер протонов (54, 55). Nam присутствует внеклеточно, и его поглощение возможно либо в виде прямого транспорта в интактной форме, либо в виде метаболитов спасательного пути. Однако было показано, что субстраты NAMPT АТФ и 5-фосфорибозил-1-пирофосфат (PRPP) недоступны в достаточных количествах во внеклеточном пространстве (56), чтобы поддерживать прямую генерацию eNAD.nneNAD может связывать различные подтипы пуринергических рецепторов P2, включая P2Y11, что приводит к открытию каналов Ca2 + L-типа и активации сигнального каскада cAMP / cADPR / [Ca2 +] i, что в конечном итоге вызывает усиление пролиферации и миграции (57). В Т-клетках и моноцитах активация рецептора P2X7 обычно приводит к интернализации Ca2 +, открывая неселективные большие мембранные поры, вызывая гибель клеток (58, 59). eNAD также действует как нейротрансмиттер, высвобождаемый стимулированными окончаниями нейронов центральной нервной системы и периферической нервной системы млекопитающих, связываясь с постсинаптическими рецепторами P2Y1, подобно АТФ (60).nnОчень низкие уровни eNAD обусловлены его быстрым метаболизмом / деградацией NAD-катаболическими ферментами, присутствующими на поверхности клетки (61), что позволяет предположить, что метаболиты NAD также могут опосредовать клеточные ответы во внеклеточной среде.nneNAD расщепляется тремя основными классами специфических эктоферментов: CD38 и CD157 (62, 63), ART (64), ENPP1 и CD73 (61, 65, 66). NADase, ENPP1 и CD73 могут приводить к образованию аденозина (ADO), мощного иммунодепрессанта, независимо от активности CD39 (61, 67, 68). Помимо образования ADO, eNAD может расщепляться до никотинамидмононуклеотида (NMN) с помощью CD38, генерируя Nam, который может проникать через плазматические мембраны и повторно превращаться в NAD через NAMPT и NMN-аденилилтрансферазу (NMNAT) (69). С другой стороны, NMN также может использоваться CD73, который генерирует никотинамид рибозид (NR) (66, 70), который, вероятно, через уравновешивающие переносчики нуклеозидов (ENT), может быть импортирован как предшественник NAD (71, 72) (рис. 1). Недавно Slc12a8 был идентифицирован как специфический переносчик NMN (73), предполагая, что NMN может быть интернализован без преобразования в NR. Исследования паттерна экспрессии клеточного типа этого переносчика прояснят эту возможность.
Биосинтез NAD: ферментативные функции NAMPT и NAPRT
Оборот NAD в клетке является динамическим, демонстрируя циркадные колебания, которые регулируются механизмом основных часов CLOCK: BMAL1 (74, 75). Общие внутриклеточные уровни поддерживаются между 200 и 500 мкМ, в зависимости от типа клетки или ткани, увеличиваясь в ответ на различные стимулы (43). Гомеостаз НАД является результатом баланса между рядом реакций, потребляющих НАД, и путями биосинтеза НАД через три различных пути: путь биосинтеза de novo, путь Прейсс-Хэндлера и путь спасения, как описано в Houtkooper et al. . (27), Ruggieri et al. (29) и Audrito et al. (42) и показано на рисунке 2.
Рисунок 2. Пути биосинтеза НАД. НАД можно синтезировать de novo, начиная с Trp (розовый прямоугольник), или через пути спасения от Nam и NR (зеленый прямоугольник), или метаболизируя Na по пути Прейсс-Хэндлера (голубой прямоугольник). Предшественники НАД обозначены синими овалами. Ферменты, ограничивающие скорость каждого пути биосинтеза, обозначены красным цветом, другие ферменты, участвующие в реакциях, - оранжевым. Для NAMPT и NAPRT показаны кристаллические структуры. НАД, синтезируемый из Nam с помощью NAMPT, в свою очередь, используется потребляющими NAD активностями ферментов, которые высвобождают Nam, делая его доступным для непрерывной регенерации NAD. NAMPT, никотинамидфосфорибозилтрансфераза; НАПРТ, никотинатфосфорибозилтрансфераза; NRK, никотинамид-рибозидкиназа; QPRT, хинолинатфосфорибозилтрансфераза; NMNAT, никотинамидмононуклеотид аденилтрансферазы; НАДС, НАД-синтаза; Нам, никотинамид; NR, никотинамид рибозид; Na, никотиновая кислота; Trp, триптофан; QA, хинолиновая кислота; NMN, никотинамидмононуклеотид; НАМН, никотинатмононуклеотид; НААД, никотинатадениндинуклеотид; НАДаза, НАД-гликогидролаза; АРТ, моноаденозиндифосфат (АДФ) -рибоза трансферазы; PARP, полимеразы поли-АДФ-рибозы.
В частности, de novo биосинтез НАД начинается с катаболизма аминокислоты триптофана до кинуренина индоламин-2,3-диоксигеназой. Затем кинуренин метаболизируется посредством кинуренинового пути до хинолиновой кислоты (QA), которая превращается хинолатфосфорибозилтрансферазой (QPRT), ограничивающим скорость ферментом, в мононуклеотид натрия (NaMN). Путь Прейсса-Хэндлера метаболизирует NaMN, полученный из кинуренинового пути, или NaMN, полученный из пищи, или Na, как продукт дезамидирования Nam кишечной флорой (76) до NAD, посредством NAPRT-ограничивающей активности. В пути спасения NAMPT метаболизирует Nam и PRPP до NMN на этапе ограничения скорости, который затем превращается в NAD. В другом способе спасения NR, полученный из диеты, может использоваться никотинамид-рибозидкиназой (NRK) для генерации NAD (рис. 2).
Количественно путь спасения Nam является наиболее значимым в клетках млекопитающих. Это наблюдение подтверждается несколькими доказательствами. Во-первых, Nam является наиболее распространенным предшественником НАД в кровотоке (39), и его можно легко ввести с пищей (витамин B3). Во-вторых, Nam является побочным продуктом активности всех ферментов, метаболизирующих НАД, что увеличивает его доступность (77). В-третьих, ограничивающий скорость фермент NAMPT (EC 2.4.2.12) экспрессируется во всех тканях млекопитающих (78), как подробно описано ниже. Связанная с этим делеция гена NAMPT у мышей является эмбрионально летальной (79), что свидетельствует о важности этого пути для регенерации NAD. На этом пути Nam N-methyltransefase (NNMT) недавно стала эволюционно консервативным регулятором доступности Nam. Фактически, NNMT N-метилирует Nam, предотвращая его накопление и ингибирование ферментов, потребляющих NAD, а с другой стороны, ограничивая его доступность для NAMPT (80, 81).
Функциональный NAMPT образует гомодимер, катализирующий превращение Nam и PRPP в NMN. Исследования структурного и сайт-направленного мутагенеза Khan et al. продемонстрировали, что Asp219 играет фундаментальную роль в определении субстратной специфичности NAMPT (82). Wang et al. показали, что NAMPT обладает аутофосфорилирующей активностью и гидролизует АТФ. Аутофосфорилирование может повысить его ферментативную активность (83). Недавно было обнаружено, что NAMPT является прямым субстратом деацетилирования SIRT6, посттрансляционного механизма, который регулирует его ферментативную активность (84). Напротив, мутации His247, центрального консервативного остатка в активном центре фермента, значительно снижают или отменяют ферментативную активность NAMPT (83).
NAPRT (EC 2.4.2.11) катализирует превращение Na и PRPP в NaMN и пирофосфат (PPi). Фермент, первоначально названный пирофосфорилаза NaMN, был впервые описан Хэндлером в человеческих эритроцитах, где он увеличивает уровни НАД (85).
Активность NAPRT более тканеспецифична. Хотя активность фермента может быть обнаружена в большинстве тканей мыши (86), Na действует как более эффективный предшественник, чем Nam, в печени, кишечнике, сердце и почках мышей (87). Кроме того, Na более эффективен, чем Nam, в повышении уровня НАД в клетках, подверженных окислительному стрессу (56, 85, 88).
В отличие от NAMPT, NAPRT не ингибируется NAD, что объясняет его значительно более высокую эффективность в повышении уровня NAD in vivo (56, 89). Более того, NAPRT сильно активируется фосфатом (85), в то время как АТФ ведет себя как аллостерический модулятор фермента (29, 85, 90).
В 2015 году Марлетта и др. разрешили структуру человеческого (h) NAPRT, подчеркнув высокую степень структурной гомологии между человеческими и бактериальными NaPRTases из-за эволюционной адаптации (91). Как и в случае с NAMPT, функциональный фермент NAPRT работает как димеры, и, несмотря на очень ограниченное сходство последовательностей, hNAPRT демонстрирует молекулярную складку, которая очень похожа на ту, что впервые была описана для hNAMPT (83). Это открыло новые гипотезы об общих мотивах в NAMPT и NAPRT, участвующих в связывании внеклеточных белков с рецептором, как описано в разделе Функции eNAMPT.
Наличие этих множественных путей биосинтеза NAD, скорее всего, отражает различия в тканевом распределении и / или внутриклеточной компартментализации NBE (39, 46, 76, 92, 93). Наша группа недавно показала, что NAMPT и NAPRT в основном расположены в цитоплазме и ядре, тогда как NRK больше экспрессируется в митохондриях, влияя на уровни iNAD и ответ на ингибиторы NAMPT (39, 46, 76, 92, 93).
https://www.frontiersin.org/articles/10.3389/fonc.2020.00358/full
Front. Oncol., 19 March 2020 | https://doi.org/10.3389/fonc.2020.00358
