Дисциплина Экспериментальная патобиохимия клетки
Медиаторы воспаления
3. Преформированные и вновь образующиеся медиаторы
3.1. Гистамин
Гистамин - Моноамин гистамин - продукт декарбоксилирования аминокислоты гистидина.

История Изначально гистамин был «молекулой-сиротой»: ученые, проводившие первые исследования, даже не думали, что он может присутствовать в теле человека. Но обо всём по порядку. Однако первым антигистаминным средством, вошедшим в клиническую практику, стал антегран (RP 2339): Впоследствии на рынок была выпущена его модификация – пириламин: Стоит также отметить, что из-за недостатка фактического материала первые исследования антигистаминных препаратов проводились достаточно грубо: единственным свойством, определявшим допуск вещества к клиническим испытаниям, являлась способность купировать бронхоспазм у экспериментальных животных. На побочные эффекты вроде сонливости и частичного холинолитического действия никто не обращал внимания. Тип гистаминовых рецепторов, находящихся в бронхах и подвздошной кишке, получил обозначение Н1. Исследователям стало очевидно, что для характеризации и изучения функций Н2-рецепторов (в предыдущих исследованиях они были обнаружены в матке и правом предсердии) нужны новые селективные лиганды. Нужные соединения были созданы в 1965 году. Джеймс Блек, работавший ранее над разработкой лигандов бета-адренорецепторов, решил пойти по пути модификации исходных гормонов. Следуя логике, которой он руководствовался при создании изопреналина и дихлоризопреналина, Блек решил синтезировать различные модификации гистамина и провести анализ их фармакологической активности. Итогом стали два соединения – 5-метилгистамин и N-альфагуанилгистамин, избирательно возбуждавшие Н2-рецепторы. Окончательным итогом его работы стали Н2-блокаторы буримамид и метиамид. Буримамид интересен тем, что он первым полностью блокировал эффекты гистамина в отношении тонуса сосудов. Метиамид же стал отправной точкой для разработки циметидина – Н2-блокатора, использующегося для понижения кислотности желудочного сока и лечения язвенной болезни. Наконец, в 1990х был выделен четвёртый тип гистаминовых рецепторов. В 1996 году Рейбль обнаружил, что увеличение внутриклеточной концентрации кальция в эозинофилах в ответ на введение гистамина можно успешно блокировать тиоперамидом, но не пириламином или циметидином. Это стало доказательством того, что в данном случае эффект являлся следствием возбуждения Н3-рецепторов. Однако в последующих экспериментах с альфа-метилгистамином (избирательным Н3-агонистом) увеличения концентрации кальция в эозинофилах не происходило. Подобным образом были протестированы и другие известные на тот момент Н3-агонисты, однако они не оказывали на эозинофилы такого же эффекта, как чистый гистамин. Это дало исследователям основания утверждать о выделении нового типа гистаминовых рецепторов – Н4. В дальнейшем выяснилось, что Н4-рецепторы находятся главным образом в клетках иммунной системы, и с нарушением их функционирования связали несколько аутоиммунных заболеваний, однако их селективные лиганды до сих пор не нашли клинического применения. У мышей, лишённых Н4-рецепторов, нарушен процесс хемотаксиса иммунных клеток. Также Н4-рецепторы являются единственными, чья структура остаётся не ясной до конца.
Эрготизм, или же Антониев огонь, был описан ещё средневековыми медиками. Это заболевание с довольно интересной симптоматикой: диарея, галлюцинации, судороги, при тяжёлых формах возможно возникновение гангрены. Однако лишь к середине XIX века у врачей появилось относительно реалистичное представление о главной причине эрготизма – паразитическом грибке Claviceps purpurea, он же спорынья. Внимательный читатель спросит: «А причём здесь, собственно, спорынья, если мы говорим о гистамине?» В 1904 году кембриджский аспирант-физиолог Генри Дейл и его научный руководитель Джон Лэнгли были приглашены на работу в лабораторию Генри Уэллкома в Южном Лондоне. Уэллком поставил исследователям задачу выяснить механизмы действия экстракта спорыньи и найти ему новые терапевтические приложения. К их работе подключился Джордж Баргер, который к тому времени уже имел опыт выделения и очистки отдельных соединений из спорыньи, и вместе с Дейлом они начали систематизацию и описание фармакологических свойств выделенных веществ. В 1910 году они выделили из стандартизированного экстракта спорыньи бета-аминоэтилимидазол, имевший структурное сходство с аминокислотой гистидином, но лишённый карбоксильной группы. Впоследствии он получил название «гистамин». Однако позднее выяснилось, что за три года до выделения гистамина из спорыньи это вещество уже было описано в 1907 году Виндхаусом и Вогтом в качестве синтетического аналога гистидина. Это не могло не порадовать Дейла: синтез гистамина оказался намного легче его выделения. Таким образом, Дейл получил источник больших количеств гистамина для последующих исследований его фармакодинамики и фармакокинетики. Первые исследования по изучению действия гистамина проводились на млекопитающих; в процессе выяснилось, что соединение способно вызывать сокращение гладкой мускулатуры матки, бронхов и кровеносных сосудов, также гистамин вызывал усиление секреторной функции слизистых оболочек и увеличение кислотности желудочного сока. Также Дейл в сотрудничестве с Линдлоу отметил существенное сходство между анафилактической реакцией и эффектами, вызываемыми введением больших количеств гистамина подопытным морским свинкам. В 1927 году Дейл доказал существование эндогенного гистамина, обнаружив его в экстрактах печени и лёгких сенситизированных животных.
Спустя десятилетие медики признали связь между гистамином и аллергическими реакциями, и в 1937 году Бове и Штауб из Института Пастера, используя соединения, синтезированные Эрнестом Форно, показали возможность частичного блокирования действия гистамина. Первым антигистаминным препаратом, показавшим нужную активность, был пипероксан.
Со временем выяснилось, что не все эффекты гистамина блокируются введением антигистаминных препаратов. Это натолкнуло учёных на мысль о существовании нескольких типов рецепторов гистамина.
Доказательства этой гипотезы появились уже в 1940-х годах: первые модели действия гистамина были опубликованы Уэллсом в 1945 и Фолкоу в 1948 годах. В качестве доказательства существования нескольких типов гистаминовых рецепторов приводился опытах на кошках, где димедрол лишь частично блокировал вазодилатацию, вызванную введением гистамина.
В 1960 году Тренделенбург в процессе уточнения pA2* для пириламина обнаружил, что для разных органов (сердце и подвздошная кишка) значение pA2 довольно сильно отличается. Впоследствии было установлено, что пириламин в малых дозах блокирует эффекты гистамина в отношении бронхов и мускулатуры подвзошной кишки, однако не оказывает никакого воздействия на тонус матки и правого предсердия.
*pA2 применяется для относительного измерения фармакологической активности соединений; это отрицательный логарифм молярной концентрации антагониста, при которой для получения стандартного эффекта агониста его концентрацию надо увеличить вдвое.
Однако и это ещё не все. В последующих исследованиях выяснилось, что совместное введение Н1- и Н2-блокаторов купировало не все эффекты гистамина, и особенно ярко это проявилось во время опытов на изолированных срезах мозга. В 1983 году Аррандж проводил исследование с меченным изотопной меткой гистамином и выяснил, что буримамид (раннее классифицированный как Н2-блокатор) и импромидин (Н2-блокатор) имели слишком большую разницу в активности: относительно гистаминовых рецепторов, находившихся в срезах коры головного мозга мышей, буримамид оказался в 300 раз более активным. Это дало основание для выделения нового типа гистаминовых рецепторов – Н3. Позже, в 1987 году, Тжечаковский обнаружил похожую разницу в фармакологических активностях буримамида и импромидина относительно активности нервов ауэрбахового сплетения. Его исследования привели к разработке модельных лигандов Н3-рецепторов – агониста альфа-метилгистамина и антагониста тиоперамида. В настоящее время некоторые лиганды Н3-рецепторов рассматриваются как потенциальные лекарства против болезни Альцгеймера, СДВГ и нарколепсии.
Недавно (2012, «Histamine-gated ion channels in mammals?» Fleck M., Biochemical Pharmacology) появились сообщения об ионных каналах каналах хлора, для которых гистамин является специфическим лигандом, однако на сегодняшний день они недостаточно хорошо описаны.
Главный источник гистамина при воспалении у человека - тучные клетки тканей и базофилы крови. Как тучные клетки, так и базофилы - высокоспециализированные клетки, содержащие большое число гранул - округлых, ограниченных мембраной структур, основу которых составляет протеогликановый матрикс. В тучных клетках соединительной ткани человека роль протеогликанового матрикса выполняет гепарин, в базофилах - хондроитин 4-сульфат. Внутри гранул, в среде с низким pH, содержатся в преформированном виде биологически активные вещества, в том числе и гистамин, который удерживается кислыми группами гранулярного матрикса с помощью ионной связи. На долю гистамина приходится около 10% сухой массы гранул тучных клеток.

Значительная часть тучных клеток сосредоточена в коже, в слизистых оболочках верхних и нижних дыхательных путей, желудочно-кишечного тракта, мочеполовых органов, где они располагаются вокруг мелких кровеносных и лимфатических сосудов и в местах скопления нервных окончаний.
Высвобождение гистамина из тучных клеток и базофилов есть сложный процесс, тесно связанный с изменением их гранулярного аппарата - с дегрануляцией. По результатам морфологических исследований, дегрануляция одних гистамин-содержащих клеток, например тучных клеток кожи человека, обусловлена выбросом интактных гранул вместе со всем их содержимым во внеклеточную среду. Дегрануляция других клеток, например тучных клеток слизистой носа и легких, обусловлена слиянием мембран отдельных гранул друг с другом и с цитоплазматической мембраной. В результате образуются сообщающиеся с внешней средой каналы, через которые солюбилизированное содержимое гранул диффундирует во внеклеточное пространство. Во внеклеточной среде, pH которой значительно выше чем внутри гранул, гистамин становится свободно растворимым и легко диффундирует из места своего высвобождения. Дегрануляция тучных клеток и базофилов может быть вызвана различными стимулами (таблица 1).
Таблица 1.
Факторы, вызывающие дегрануляцию тучных клеток
- Иммуноглобулины класса Е (после фиксации антигена)
- Фрагменты комплемента (С3а, С5а)
- Нейропептиды (вещество Р, нейротензин)
- АТФ
- Физические стимулы (вибрация, нагревание, охлаждение)
- Факторы, высвобождаемые клетками, участвующими в воспалении: нейтрофилами, лимфоцитами, тромбоцитами, эндотелиальными клетками, эозинофилами, макрофагами легких
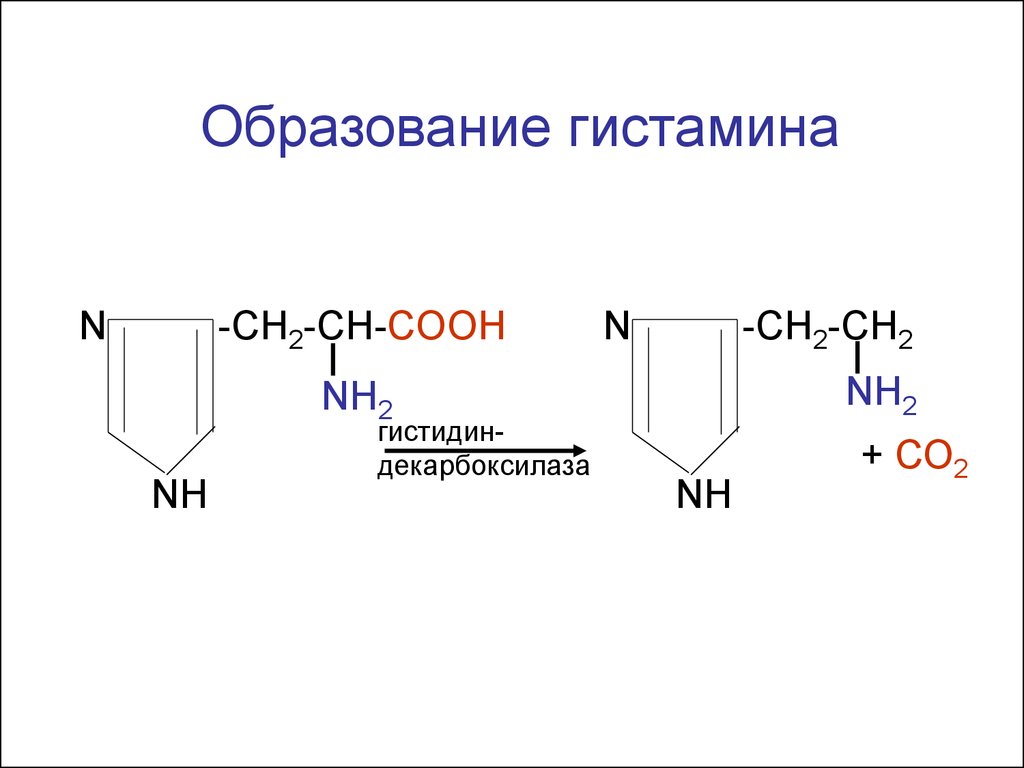
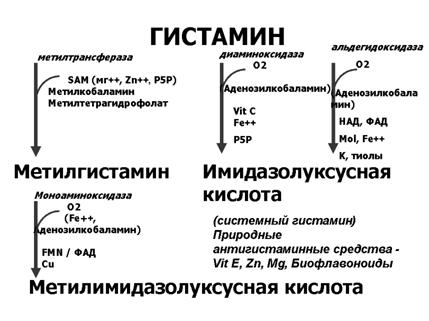
Рисунок 1. Синтез и распад гистамина.
От 50 до 70% свободного гистамина преобразуется ( метаболизируется) N-метилтрансферазой в N-метилгистамин. Фермент N-метилтрансфераза содержится в тонком кишечнике, печени, почках, в других органах, в лейкоцитах. Остальной гистамин метаболизируется диаминоксидазой (гистаминазой) в имидазолуксусную кислоту. Значительные количества гистаминазы содержатся в слизистой кишечника, в плаценте, печени, тимусе, эозинофилах, нейтрофилах.
Рецепторы к гистамину
Действие гистамина на клетки-мишени реализуется через специальные рецепторы. Все изученные и охарактеризованные на сегодняшний день рецепторы гистамина являются метаботропными и осуществляют своё действие через цепь вторичных внутриклеточных мессенджеров.
ПНС: ключевое звено механизма бронхоконстрикции, регулирует процессы вазодилатации, висцеральной ноцицепции, участвует в развитии крапивницы и зуда. ПНС: гладкая мускулатура, эндотелий, чувствительные нейроны.Рецептор Тип Функция Местонахождение Агонисты Антагонисты Н1 Gq – вызывает повышение уровня IP3 и ДАГ. ЦНС: регуляция цикла «сон-бодрствование» (осуществляет переход в состояние бодрствования), регуляция температуры тела, ноцицепции, нейроэндокринного гомеостаза, процессов запоминания и аппетита. ЦНС: туберомаммилярные ядра гипоталамуса, которые имеют проекции к дорсальным ядрам шва и синему пятну. Гистамин, HTFMT, UR-AK49, бетагистин, 2-пиридилэтиламин Дифенгидрамин, лоратадин, цетиризин, фексофенадин, клемастин Н2 Gs – увеличивает уровень цАМФ. Частично участвует в процессе вазодилатации, регулирует секрецию желудочного сока и функции ЖКТ. Париетальные клетки желудка, гладкая мускулатура сосудов. Гистамин, амтамин, бетазол, димаприт, HTFMT, импромидин, UR-AK49 Ранитидин, циметидин, фамотидин, низатидин Н3 Gi – снижает уровень цАМФ. Пресинаптический ауторецептор, ингибирует выброс гистамина, серотонина, норадреналина и ацетилхолина. Регулирует аппетит и частично секрецию желудочного сока. Главным образом находятся в ЦНС. Гистамин, альфа-метилгистамин, ципралисант, иметит, иммепип, имметридин, метимипип, проксифан ABT-239, ципроксифан, клобенпропит, тиоперамид Н4 Gi – снижает уровень цАМФ. Участвует в осуществлении хемотаксиса, развитии зуда и воспаления, выбросе цитокинов. Также играет роль в возникновении болевых ощущений. Базофилы, CD4+ лимфоциты, костный мозг, тимус, тонкая кишка, селезёнка, толстая кишка. Гистамин, 4-метилгистамин, альфа-метилгистамин, OUP-16, VUF-8430 Тиоперамид, JNJ-7777120
Также стоит перечислить меченные изотопными метками специфические лиганды, которые используются для исследования рецепторов: Н1 – [3H]-пириламин, Н2 – [125I]-аминопотентидин, Н3 – [125I]-йодопроксифан, Н4 –[3H]- JNJ7777120
![Схема действия гистамина на уровне тканей и клеток на примере аллергической реакции. [2] Источник: журнал Nature](http://medach.pro/wp-content/uploads/2016/01/fig2_1.png)
Рисунок 2. Функциональные последствия активации гистаминовых рецепторов.
Можно заключить, что основные последствия активации Н1 гистаминовых рецепторов у человека
это:
- сокращение гладких мышц (в том числе мышц бронхиол и желудочно-кишечного тракта);
- увеличение сосудистой проницаемости, прежде всего посткапилярных венул;
- увеличение содержания цГМФ в клетках-мишенях ;
- кожный зуд;
- стимуляция образования простагландинов;
- укорочение времени проведения по атриовентрикулярному
- узлу;
- раздражение чувствительных окончаний блуждающего нерва
- в воздухоносных путях;
- Секреция соляной кислоты в желудке;
- Увеличение секреции слизи эпителием воздухоносных путей;
- Увеличение содержания цАМФ в клетках-мишенях;
- Сокращение мышц пищевода;
- Н1+ Н2 Гипотензия; Покраснения кожи;
- Головная боль; Тахикардия.
Гистамин обнаруживается в очаге воспаления по существу одновременно с возникновением повреждения. Вызывает расширение микроциркуляторных сосудов, увеличивает их проницаемость, стимулирует окончания болевых нервов. Таким образом, гистамин “запускает” острый воспалительный Когда специфический антиген связывается с FCER1, запускается LYN-зависимое фосфорилирование ITAM-фрагментов и активация протеинкиназ FYN и SYK. Эти активные протеинкиназы, в свою очередь, фосфорилируют LAT (LYN и SYK) и GAB2 (FYN). Фосфорилирование LAT ведёт к активации фосфолипазы С γ (PLCγ), а фосфорилирование GAB2 – к активации фосфоинозитид-3-киназы (PI3K). Их активация ведёт к запуску сигнальных путей, активируемых вторичными мессенджерами – инозитолтрифосфатом (InsP3), диацилглицеролом (DAG) и фосфатидилинозитол-3-фосфатом (PtdIns(3,4,5)P3). Это ведёт к активации протеинкиназы С и выходу Ca2+ из эндоплазматического ретикулума в цитозоль. Выход Ca2+ из ЭПР ведёт к активации белка STIM1, который открывает ионные каналы ORAI1 и TRPC1. Они также повышают концентрацию внутриклеточного Ca2+, впуская кальций из межклеточного пространства внутрь. И, наконец, активированная протеинкиназа С и повышенный уровень Ca2+ являются триггерами для запуска процесса дегрануляции. Созревшие везикулы подтягиваются по микротрубочкам ещё ближе к мембране благодаря коронинам 1А и 1В, происходят множественные слияния везикул одна с другой благодаря связям между t-SNARE и v-SNARE, а после везикулы сливаются с мембраной и их содержимое выбрасывается во внеклеточное пространство. Краткая схема работы трёх типов гистаминовых рецепторов (Н4-рецепторы не показаны, т.к. их механизм действия схож с Н3-рецепторами) Сокращения АА – арахидоновая кислота АС – аденилатциклаза CREB – фактор транскрипции, связывающийся с цАМФ-реактивным элементом DAG – диацилглицерол GC – гуанилатциклаза HVACC – потенциал-зависимый кальциевый ток IAHP – кальций-зависимый калиевый ток Ih — активируемый гиперполяризацией катионный ток Ik, leak – калиевый ток утечки Ins(1,4,5)P3 – инозитол-1,4,5-трифосфат MAPK – митоген-активируемая протеинкиназа NCX – натрий-кальциевый обменник NMDA – N-метил-D-аспартат и его рецептор NO – оксид азота II PKA – протеинкиназа А PLA – фосфолипаза А PLC – фосфолипаза С
ответ.
Как следует из схемы, одним из ключевых моментов в запуске аллергической реакции является высвобождение гистамина вместе с протеазами и цитокинами из тучных клеток (mast cells); также этот процесс называют дегрануляцией. Рассмотрим этот момент поподробнее:Гистамин синтезируется в цитозоле из аминокислоты гистидина. Затем он с помощью белка VMAT2 (везикулярный транспортёр моноаминов) закачивается в «молодые» везикулы, отделившиеся от комплекса Гольджи. Кроме того, в процессе созревания и движения по микротрубочкам к мембране в везикулы упаковываются различные протеазы и цитокины.На поверхности тучной клетки расположены высокоспецифичные рецепторы FCER1. Данные рецепторы прочно связываются с высокоспецифичными IgE, выработанными плазматическими клетками в ответ на аллерген. Связывание с рецептором происходит таким образом, что Fab-регион, ответственный за связывание с антигеном, остаётся вне клетки. Соответственно, таким образом тучная клетка уже «знает», на какой из антигенов нужно среагировать.
FCER1 состоят из нескольких субъединиц: альфа-субъединица ответственна за связь с IgE и антигеном, бета-субъединица содержит активационный тирозинсодержащий мотив иммунорецепторов (ITAM), гамма-субъединица также содержит два ITAМ-фрагмента, соединённых дисульфидной связью.
Ну а дальше вы знаете: покраснение кожных покровов, отёк, повышение секреции слизи, иногда бронхоконстрикция и всё такое.
Стоит также отметить, что в париетальных клетках желудка дела обстоят намного легче: там гистамин просто активирует Н2-рецептор, активация которого ведёт к увеличению количества цАМФ и запуску работы H/K-АТФазы через активацию протеинкиназы А. Н/К-АТФаза (она же протонная помпа) транспортирует ионы водорода против градиента концентрации, что ведёт к синтезу HCl и повышению кислотности желудочного сока.
Участие гистамина в развитии воспаления очевидно при многих болезнях человека, но, в особенности, при аллергических болезнях, язвенной болезни желудка и двенадцатиперстной кишки (см. таблицу 4).
Выше указывали, что появление гистамина в очаге воспаления тесно связано с дегрануляцией тучных клеток. Однако внутри гранул тучных клеток и базофилов содержатся помимо гистамина еще и другие вещества - медиаторы воспаления. Кроме того, сам процесс дегрануляции стимулирует синтез новых медиаторов, источником которых служат липиды мембран активированных тучных клеток и базофилов.





![Источник: журнал Nature [2]](http://medach.pro/wp-content/uploads/2016/01/fig3_1-1.png)

