Дисциплина Экспериментальная патобиохимия клетки
Клеточный цикл
6. Сигнальные пути, регулирующие клеточный цикл
6.3. Map киназный сигнальный каскад
Сигнальные пути MAPK (англ. mitogen-activated protein kinase — митоген-активируемая протеинкиназа) — группа мультифункциональных внутриклеточных сигнальных путей, содержащих одну из митоген-активируемых протеинкиназ и контролирующих транскрипцию генов, метаболизм, пролиферацию и подвижность клеток, апоптоз и другие процессы
Сигнальные пути MAPK консервативны у эукариот и содержат характерный модуль, состоящий из трёх протеинкиназ. Эти пути активируются внеклеточными сигналами, такими как гормоны, факторы роста, хемокины и нейротрансмиттеры, которые распознаются соответствующими рецепторными тирозинкиназами или рецепторами, ассоциированными с G-белками. Рецепторы активируют ГТФазы семейств Ras и Rho. ГТФазы передают сигнал на модуль, состоящий из киназы киназы митоген-активируемой киназы (англ. MAPK kinase kinase, MKKK), которая фосфорилирует и активирует киназу митоген-активируемой киназы (англ. MAPK kinase, MKK), которая, в свою очередь, активирует митоген-активируемую киназу. MAPK фосфорилируют белки-мишени по остаткам серина и треонина и таким образом передают сигнал дальше. Кроме киназ, в состав сигнальных путей входят протеинфосфатазы и белки, которые обеспечивают сборку белковых комплексов
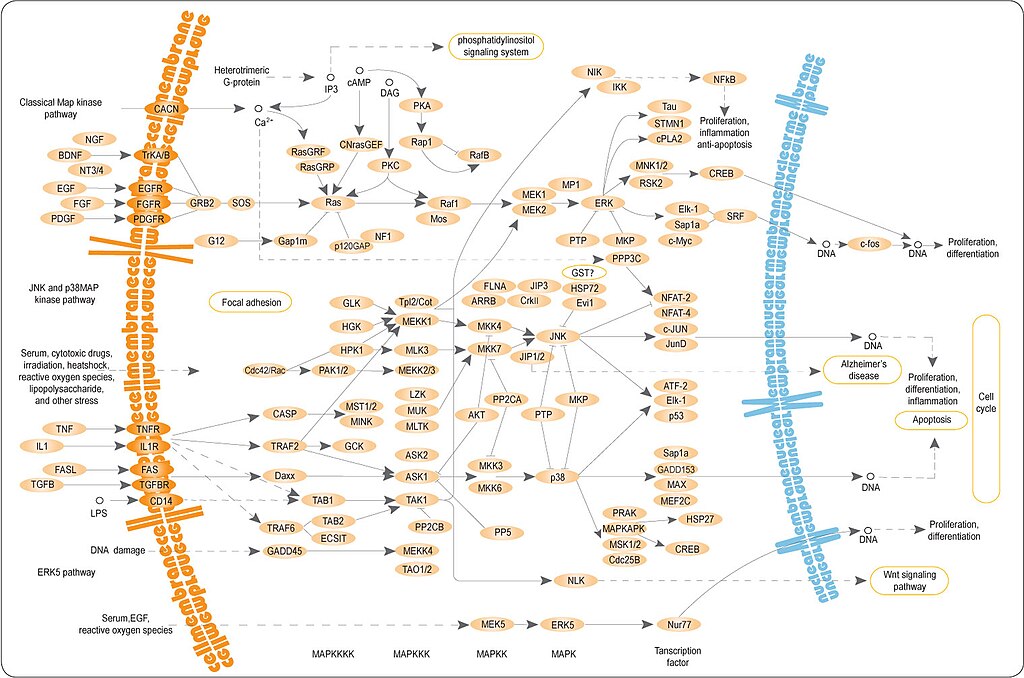
Классификация
У млекопитающих известно 4 основных MAPK-сигнальных пути:
- пути ERK (англ. extracellular signal-regulated kinase),
- ERK5 (англ. extracellular signal-regulated kinase 5),
- JNK (англ. c-Jun N-terminal kinase) и
- p38.
Как правило, сигнальные пути ERK отвечают на факторы роста, в то время как JNK и p38 реагируют на внеклеточные стрессовые сигналы. Такие же пути были обнаружены у Drosophila и Caenorhabditis elegans. Однако у млекопитающих эти пути более сложно устроены за счёт того, что MAP-киназы представлены не одним ферментом, а группой близких по структуре ферментов, которые кодируются несколькими генами (например, ERK1, ERK2 и др.). Кроме того, дополнительное разнообразие ферментов порождается альтернативным сплайсингом.

Сигнальный путь ERK (Ras-ERK, MAPK/ERK) — это один из ключевых и наиболее хорошо изученных сигнальных путей MAPK (англ. mitogen-activated protein kinase). Своё название этот путь получил по центральной MAP-киназе ERK (англ. extracellular signal-regulated kinase), которая представлена двумя близкими по структуре белками, ERK1 и ERK2. Данный путь может быть активирован внеклеточными сигналами, такими как гормоны, факторы роста, хемокины и нейротрансмиттеры, которые распознаются соответствующими рецепторными тирозинкиназами или рецепторами, ассоциированными с G-белками. Передача сигнала по ERK-пути в конечном итоге приводит к выживанию, пролиферации и увеличению подвижности клеток.
Как было сказано выше, сигнальный путь ERK может быть активирован в ответ на сигналы, полученные клеткой через рецепторные тирозинкиназы или рецепторы, сопряжённые с G-белками. Около цитоплазматической части таких рецепторов собирается сигнальный комплекс из множества белков, который в конце концов активирует ГТФазу Ras. Ras связывает и активирует киназу киназы MAPK/ERK (MAPK/ERK kinase kinase или MEKK), главными компонентами которой являются белки семейства Raf (Raf-1, A-Raf и B-Raf). MEKK фосфорилирует и активирует киназу MAPK/ERK (MAPK/ERK kinase или MEK), представленную двумя компонентами MEK1 и MEK2. MEK1/2 активирует ERK1/2.

Фосфорилирование ERK1/2 происходит вблизи клеточной мембраны[1]. После этого фермент диффундирует в цитоплазму, где фосфорилирует сигнальные белки, в том числе p90 киназу рибосомального белка S6 (p90 ribosomal S6 kinase или RSK), а затем в ядро, где он регулирует транскрипцию. ERK1/2 индуцирует транскрипцию ранних генов c-Fos и c-Myc, продукты которых являются факторами транскрипции и обеспечивают транскрипцию поздних генов, ответственных за пролиферацию, выживание и подвижность клеток[2].
Сигнальный путь ERK принимает участие в активации T-клеток, пролиферации эндотелиальных клеток при ангиогенезе, в регуляции синаптической пластичности и фосфорилировании транскрипционного фактора p53
Роль Raf-MEK-ERK наиболее хорошо изучена в патогенезе опухолей

После стимуляции рецептора EGF факторами роста, он димеризуется, что позволяет ему связать Grb2 на своих внутриклеточных доменах. Grb2 затем ассоциируется Sos, который способен активировать Ras, который затем инициирует каскад фосфорилирования МАР-киназ приводит к фосфорилированию и активации ERK (MAPK). Фосфорилированные ERKs могут образовывать гомодимеры и транслокации в ядро, где они активируют различные факторы транскрипции, приводящих к изменению экспрессии генов. Часто путь Raf-MEK-ERK приводит к усилению клеточной пролиферации (19, 21). Как видно на рисунке, как Ras и Raf часто оказываются мутировать в результате чего их конститутивной активации в различных видах опухолей (21). Ras белки функционируют как ВВП / GTP-регулируемых выключателей с внутренней GTPase активностью. Обмен ВВП к GTP приводит к активации Ras обусловлено факторами обмена гуанин нуклеотидных (RasGEFs е. Г. СЦ), в то время как гидролиз GTP к GDP, вызывающего инактивацию производится самой Ras через свою активность ГТФ. Мутировали Ras белки часто теряют способность гидролизовать ГТФ, оставляя РАС в стимула-независимого активированном состоянии, в то время как Raf, как известно, является сильным ретровирус онкоген (21). Несколько ингибиторов Ras, Raf и MEK были разработаны и показали большие перспективы. Благодаря высокому возникновению лекарственной устойчивости раковых клеток, два ингибитора (д. Ж. Один против Raf и один против МЕК) часто используются в комбинации (21). На сегодняшний день ни одного успешного ингибитора ERK разработано не было (21)
